重组质粒介导hTGF-β1基因在体转染模型动物椎间盘髓核细胞的表达
2011-06-09谢延平刘利刘振武颜继英杨朝晖刘炳智江丽强
谢延平 刘利 刘振武 颜继英 杨朝晖 刘炳智 江丽强
近年来随着分子生物学等相关学科的飞速发展,基因工程作为一种治疗手段越来越被广泛应用于外科领域。该项目的研究,就是运用当今的分子生物学技术,采用重组质粒载体基因转染模型动物腰椎间盘髓核细胞,定量的观察基因的有效表达,从而为椎间盘退变的基因治疗提供实验依据。
1 材料与方法
1.1 材料 重组质粒DNA(15 μl TGF-β1 cDNA,克隆在 EcoRⅠ位点,购于上海第二军医大学微生物实验室),质粒快速提取试剂盒(购于北京鼎国生物技术有限公司),大肠杆菌JM109菌液(购于上海生工生物技术有限公司),EcoRⅠ内切酶、蛋白Marker(购于北京鼎国生物技术有限公司),胰蛋白胨、酵母提取物、琼脂粉(购于美国sigma生物技术有限公司),TGF-β1兔抗兔一抗(购于武汉博士德生物技术有限公司),IgG鼠抗兔二抗(购于北京中山生物技术有限公司)。
1.2 构建椎间盘退行性变的动物模型 选择健康成年的新西兰大白兔21只,雌雄不拘,用20%的乌拉坦4 ml/kg静脉注射麻醉实验动物后,采用腰椎侧前方倒八字手术入路,于腹膜外显露腰椎间盘,用髓穿针于 L3~4,L4~5,L5~6间隙各注入 20 μl 0.9%氯化钠溶液,并于L3~4所对应的腰大肌处以黑色丝线做标记,术后8周随机处死1只实验动物,检测退变程度。
1.3 重组质粒DNA的扩增与提取 采用划痕法在平板培养基上接种大肠杆菌JM109菌液,37℃过夜培养,挑选单菌落于液体培养基中37℃剧烈摇震培养至OD260=0.3~0.4。采用CaCl2法制备大肠杆菌感受态,然后加入含有目的基因的质粒DNA,通过42℃热休克转化至大肠杆菌体内,继续于液体培养基中过夜培养。将培养好的菌液平铺于含有抗生素和X-gal、IPTG的平板培养基中,通过抗药性筛选及蓝白斑试验挑选所需的大肠杆菌菌株,继续于液体培养基中过夜培养。采用离心柱式快速回收提取质粒DNA的方法,提取并纯化小量的重组质粒DNA,用分光光度法测定其浓度及纯度,最后用限制性内切酶酶切及琼脂糖凝胶电泳鉴定。
1.4 活体转染 对已形成椎间盘退行性变的动物模型,再次施行对侧腹部入路手术,用髓穿针于L5~6间隙注射20 μl含有治疗基因 TGF-β1 的重组质粒 DNA,L3~4间隙注射20 μl蛋白因子TGF-β1,术后分笼饲养,自由活动。
1.5 动物分组及标本处理 所有实验动物于2次手术后分成1 d、4 d、1周、2周4个时间组,每个时间组5只实验动物,其中各个时间组内又按腰椎间隙的不同又分为实验组(L5~6)、实验对照组(L3~4)和空白组(L4~5)。各时间组分别于手术后不同时期处死动物,取出相应椎间盘后置4%多聚甲醛保存,常规脱水、透明、石蜡包埋、切片,应用TGF-β1免疫组织化学试剂盒和DAB显色试剂盒进行免疫组织化学染色。
1.6 统计学分析应用SPSS 11.0统计软件,计量资料以表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 动物模型的鉴定 (1)肉眼观察:造模术后8周,随机处死 1 只模型动物解剖观察,L3~4、L4~5、L5~6椎间盘周缘与毗邻组织粘连紧密,不易分离,椎间盘成骨样硬化,间盘突向硬脊膜,脊神经根有粘连,分离困难。(2)镜下观察:8周后,椎间盘缩小,骨质增生明显,大部分区域为类骨质和骨质,纤维组织被挤向边缘,髓核消失。(3)腰椎X线片显示:8周后腰椎间隙明显变窄,甚至消失,可见到椎间隙内有线形钙化。见图1~4。
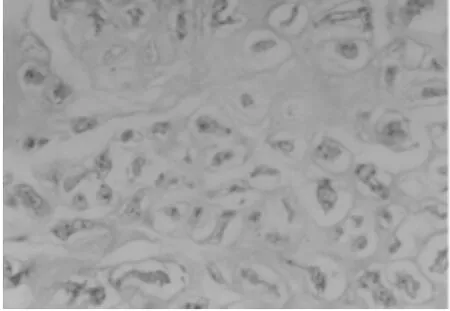
图1 镜下观察正常髓核组织(HE×200)
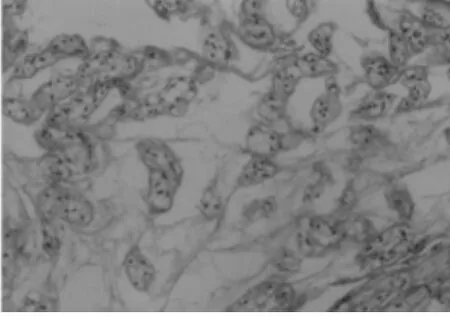
图2 造模术后2周镜下观察退变的髓核组织(HE×200)
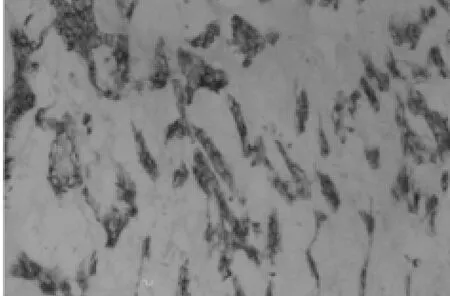
图3 基因转染后2周注射转基因的椎间盘髓核组织(免疫组化×200)

图4 琼脂糖凝胶电泳后基因片段的表达
2.2 重组质粒DNA的鉴定 (1)浓度与纯度的鉴定:算得所提重组质粒 DNA 溶液的浓度为 0.067 μg/μl,纯度为 1.782。(2)重组质粒DNA的鉴定:进行琼脂糖凝胶电泳后,结果显示:经过酶切的重组质粒DNA样品中,可见一条插入的外源基因DNA区带。根据对比参照物蛋白Marker分子量标准,可初步判断其为目的基因TGF-β1的插入片断。
2.3 基因表达活性的鉴定 术后实验组4 d即呈现阳性颗粒,阳性表达可持续至少2周,实验对照组阳性表达仅维持3 d,空白组均呈阴性反应。如图 TGF-β1抗体被染成棕色,利用CMIAS图像分析系统对各个时间组内不同间隙的椎间盘的阳性蛋白表达进行半定量测定,其光密度值如附表所示。实验组与实验对照组比较,差异有统计学意义(P﹤0.05);4 d、1周、2周时实验组与空白组比较,差异有统计学意义(P﹤0.05);1 d时实验对照组与空白组比较,差异有统计学意义(P<0.05)。见表 1,图 5。
表1 3组在不同时期基因表达的光密度评分比较
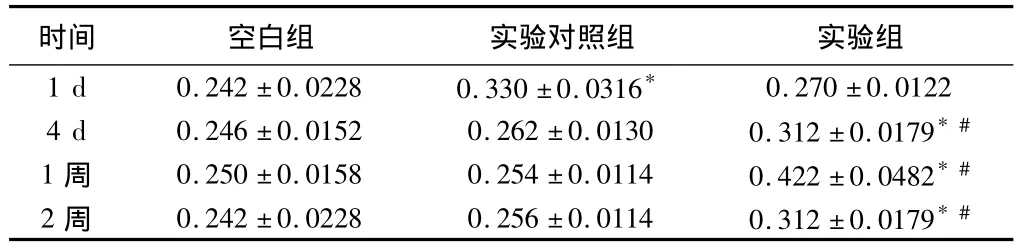
表1 3组在不同时期基因表达的光密度评分比较
注:与空白组比较,*P<0.05;与实验对照组比较,#P<0.05
时间 空白组 实验对照组 实验组1 d 0.242±0.0228 0.330±0.0316*0.270±0.01224 d 0.246±0.0152 0.262±0.0130 0.312±0.0179*#1 周 0.250±0.0158 0.254±0.0114 0.422±0.0482*#2 周 0.242±0.0228 0.256±0.0114 0.312±0.0179*#

图5 3组在不同时期基因表达的光密度评分
3 讨论
3.1 模型动物的构建 (1)实验动物的选择:家兔为非直立啮齿类动物,其髓核与纤维细胞形态改变同人类变化相似,但其退变程度,不如人类明显。虽然两者存在物种上的差别,但可作为研究椎间盘退变的实验模型。根据本实验观察,造模后实验兔的腰椎间盘病理性退变与人类相似,基本符合椎间盘退变的模型要求。(2)造模方法的选择:综合考虑要椎间盘退变的生理、病理机制,以及条件和地方的可行性,对实验动物进行无创性经棘旁穿刺造模方法设计本实验方法。实验较顺利,经X线片,组织切片观察,说明椎间盘退变符合实验造模要求。(3)实验造模机制:促使椎间盘退变的原因众多,至今尚未清楚。实验结果,正是椎间盘局部人为压力,可以加剧椎间盘退变,并且光镜下观察其形态退变过程可以证实其造模的机制,因此,实验模型的构建可作为研究人体腰椎间盘退行性变的基础,可用于病因、病机,治疗学的探讨。
3.2 基因转移方式及重组载体DNA的选择 (1)基因转移方式:当前实施基因转移的途径有两类[1],一类是 in vivo(在体)即活体直接转移;另一类是 ex vivo(体外)方法。后者比较经典、安全,而且效果较易控制,但是步骤多,技术复杂,难度大不容易推广。相反前者方法操作简单,容易推广,这类方法目前技术虽未成熟,存在起疗效短、免疫排斥及安全性等问题,但它是基因转移研究的方向,只有in vivo基因转移方法成熟了,基因治疗才能真正走向临床[2]。另外由于椎间盘髓核细胞处于一种高封闭状态,故选择直接体内的转染方法可以基本达到对靶细胞的较高选择,有利于保持高浓度的目的基因载体。(2)载体DNA的选择:目前,基因治疗所采用的载体很多,大体上可以分成两大类:病毒载体类和非病毒载体类。前者容量大、效率高、滴度稳定,但在技术上有待成熟,且由于其含有病毒蛋白,容易引起宿主体内的不良反应,严重者可以导致肿瘤的发生。相对于前者,后者虽然转移效率低,持续时间短,组织特异性不强,但通过采用特异性启动子(如CMV)和增强子以及修饰识别蛋白的方法可以提高其靶向性。而且非病毒载体易于操作、纯化,可以根据目的基因的大小来选择有不同容量的真核表达载体,没有DNA整合和产生野病毒的危险,无免疫反应等。质粒载体的优点在于便于制备,安全性好,缺点在于体内转染效率低,但随着分子生物学技术的发展,高转染效率的质粒越来越受青睐[3]。
3.3 髓核细胞转染外源性基因后表达的持续性 综合文献报道,在体实验中,Nishida等[4]采用腺病毒作为载体携带hTGF-β1基因转染兔椎间盘髓核细胞仅报道了1周的结果,国内实验室虽然对体外培养退变椎间盘髓核细胞进行目的基因的转染获得较高的表达,但未能进行细胞的传代。体外转染椎间盘软骨终板的软骨细胞,只有1%~3%细胞出现了标记基因表达的阳性染色。由于基因表达的调控是一个多层次,多水平的复杂过程,其中包括基因组、转录、转录后、翻译及翻译后等多种水平,所以椎间盘退变的研究要从多个层次寻找高效、长期的目的基因表达方法。
1 张雷,胡有谷.hTGF-β1基因治疗腰椎间盘退变研究进展.中华矫形外科杂志,2001,12:1216-1218.
2 Evans CH,Robbins PD.Genetically augmented tissue engimeering of the musculo-skeletal system.Cline Orthop,2003,367:410-418.
3 张维康,徐杰.瘤体内转化生长因子β1基因转移对实体瘤的治疗作用.中华实验外科杂志,2003,15:507-509.
4 Nishida K,Kang JD,Gilbertson LG,et al.1999 volvo award winer in basic science studis:modulstion of the biologic activity of the rabbit intervertebral disc by gene therapy;an in vivo study of adenovirus mediated transfer of the human transforming growth factor β1encoding gene.Spine,2002,24:2419-2425.
