犬肺源性心脏病模型的建立及肺静脉P样细胞的表达
2011-06-08申严
申严
慢性肺源性心脏病(COPD)是严重威胁人类健康的常见疾病,其住院病死率长期以来居高不下[1-3]。既往大多以低氧高压等方法直接制备动物COPD模型,其实质更大程度上是肺动脉高压模型,而临床上80%以上的肺心病均是由COPD所引起[4-6],因此本研究拟在形成犬COPD模型后进一步建立肺心病模型,使之更贴近临床实际,并在此基础上了解犬肺静脉组织中P样细胞的表达,以期为日后研究肺心病患者易并发房颤的机制奠定基础。
1 材料与方法
1.1 材料 采用健康雄性犬10只,体重(18±0.6)kg,年龄1~2岁,均严格按实验用动物标准规范化饲养。随机分为实验组与对照组,每组5只,其中实验组犬采用脂多糖(LPS)法制作COPD模型,对照组犬不采用任何处理。
1.2 方法
1.2.1 实验组犬采用每日熏5%大前门牌香烟0.5 h和2次气管内注入脂多糖各200 μg制作慢性阻塞性肺疾病模型,其后以低氧高二氧化碳仓制备肺源性心脏病模型,取肺静脉组织行连续切片后进行HE法染色。
1.2.2 肺功能测定:实验组犬末日熏香烟后,与对照组一起用1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉,仰卧位固定于操作台,气管切开插入Y型气管插管。Y型气管插管两端分别与流速、压力传感器连接,流速传感器对应端与动物呼吸器相连接。设置潮气量10 ml/kg,呼吸频率60次/min。将压力、流速传感器分别与Maclab数据记录分析系统连接。外加25 cm H2O的压力,迫使动物深吸气,再以25 cm H2O的负压吸引,造成深呼气,较准确测出峰值呼气流速(PEF)和0.3 s呼气最大流速(FEV 0.3)。
1.2.3 肺动脉及右心室压力测定[7]:用 10% 乌拉坦(1 ml/100 g)腹腔麻醉,分离大鼠右侧颈外静脉,将塑料导管(外径=1 mm,内径016 mm),一端连接压力传导器,一端从颈外静脉插入,用POLYGRAPH SYSTEM生理记录仪观察压力波形,以辨别导管顶端在右心室及肺动脉位置,测定并记录平均肺动脉压力(Pap)和平均右心室压力(Rvp),测试完毕由颈内静脉取血样本。立即剪开大鼠胸腔,取出心脏,剪去心房组织,沿心室间隔边缘剪下右心室,分别称量右心室和左心室加室间隔的重量,以右心室/(左心室+室间隔)[R/(L+S)]的重量比和右心室/体重(R/BW),来反映右心室重量的变化,确定右心室有无肥厚。
1.2.4 γ-GCS活性的测量按照试剂盒(南京建成生物工程研究所)说明书进行,分光光度计分别测量412 nm及532 nm处吸光度值变化。采用免疫组化和原位杂交方法检测肺组织中γ-CCS及γ-CCS mRNA表达和p-PKB蛋白表达。
1.2.5 肺静脉切片[8]:分离其肺静脉。垂直肺静脉长轴切成2 mm宽度的连续环形组织块,以碳素墨汁作为边缘标记。其中1、3、5等单编号的组织块用10%中性福马林固定24 h后制成蜡块,作肺静脉环状连续切片,行HE染色,×400光学显微镜观察。
1.3 统计学分析应用SPSS 13.0统计软件,计量资料以表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组肺动脉压、右心室压及右心室比较 实验组犬右心室明显肥厚,右心室游离壁重增加。光镜检查肥厚心肌细胞有不同程度增大,但以细胞数量增多为主,细胞核变大。实验组犬肺动脉压力与对照组相比明显增高(P<0.05)。见表1。
表1 2组犬肺动脉压、右心室压及右心重量的变化n=5,

表1 2组犬肺动脉压、右心室压及右心重量的变化n=5,
R/BW实验组组别 Pap(mm Hg)Rvp(mm Hg) R/(L+S)41 ±7 39.2 ±5.6 0.69 ±0.12 0.78 ±0.11对照组 25 ±5 19.2 ±2.7 0.22 ±0.03 0.48 ±0.11 t值<0.05 <0.05 <0.05 <0.056.229 9.218 8.356 11.158 P值
2.2 电镜观察 观察到形态与窦房结P细胞相似的苍白细胞,单个或成群出现,细胞呈圆形、椭圆形,细胞浆染色浅。细胞核呈圆形或椭圆形位于细胞中央,染色质和核仁不明显。苍白细胞大多分布在靠近肺静脉内膜侧的肌袖组织中。
2.3 2组肺内γ-GCS活性、γ-GCS mRNA表达 2组γ-GCS活性比较,差异具有统计学意义(P <0.05)。2组γ-GCSmRNA OD值比较,差异也具有统计学意义(P<0.05)。见表2。
表2 2组犬肺内γ-GCS活性、γ-GCS mRNA表达n=5,
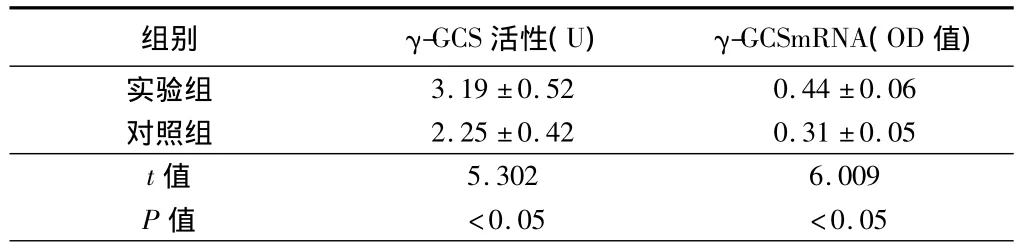
表2 2组犬肺内γ-GCS活性、γ-GCS mRNA表达n=5,
组别 γ-GCS活性(U) γ-GCSmRNA(OD值)3.19 ±0.52 0.44 ±0.06对照组 2.25 ±0.42 0.31 ±0.05 t值实验组<0.05 <0.055.302 6.009 P值
2.4 2组肺内γ-GCS和p-PKB蛋白表达(OD值) 实验组与对照组γ-GCS中IH、蛋白质印迹比较,差异均有统计学意义(P<0.05)。实验组与对照组p-PKB中IH、蛋白质印迹比较,差异也均有统计学意义(P<0.05)。见表3。
2.5 p-PKB蛋白表达与γ-GCS活性、mRNA、蛋白表达相关性p-PKB蛋白表达与γ-GCS活性、mRNA、蛋白表达均为正相关(P <0.05)。见表4。
表3 2组犬肺内γ-GCS和p-PKB蛋白表达(OD值)n=5,

表3 2组犬肺内γ-GCS和p-PKB蛋白表达(OD值)n=5,
组别 γ蛋白质印迹实验组 0.357 ±0.045 0.217 ±0.040 0.326 ±0.038 0.198 ±-GCS IH 蛋白质印迹p-PKB IH 0.030对照组 0.241 ±0.039 0.125 ±0.031 0.219 ±0.035 0.071 ±0.012 t值6.589 7.368 6.275 13.738 P值 <0.05 <0.05 <0.05 <0.05

表4 p-PKB蛋白表达与γ-GCS活性、mRNA、蛋白表达相关系数(r值)
3 讨论
本研究模拟人类慢性阻塞性肺疾病的发生、发展过程,采用每日熏香烟和两次气管内注入脂多糖(LPS)法,继而低氧高二氧化碳仓制作犬肺源性心脏病模型,结果此制备成功,模型符合犬肺源性心脏病的病生理学和形态学标准。我们在实验中发现,COPD大鼠模型中γ-GCS活性、mRNA和蛋白表达水平均增高,同时在免疫组化和western印迹检测中发现p-PKB表达水平也相应增高,并且表达强度与γ-GCS活性、mRNA和蛋白表达呈正相关,从而提示p-PKB对γ-GCS表达有调控作用,而γ-GCS作为谷胱甘肽限速酶在慢性阻塞性肺疾病的氧化/抗氧化失衡发病机制中起重要作用。本研究结果显示:(1)犬终末细支气管管壁增厚,管腔狭窄,肺泡壁变薄及肺泡孔扩大,右室游离壁组织体积及重量均明显增加;(2)肺静脉组织中可见散在分布的P样细胞。因此,通过先烟熏、脂多糖法,继而低氧高二氧化碳仓可成功制备犬肺源性心脏病模型;犬肺静脉组织中存在P样细胞。
1 中华医学会呼吸分会慢性阻塞性疾病组.慢性阻塞性肺疾病诊治指南.中华结核和呼吸杂志,2002,25:453-460.
2 Kenneth Zasadny,Michael Callahan,Laigao Chen,et al.Evaluation of acute lipopolysaccharide lung inflammation model in the rat by FDG microPET/microCT imaging.J NUCL,2006,47:213-216.
3 袁桂莉,王义成,曹文红,等.超声评价前列地尔指数球载体制剂对对慢性肺心病患者心功能的影响.河北医药,2011,33:569-571.
4 申严,戴爱国.γ-GCS的信号传导与慢性阻塞性肺疾病.国外医学内科学分册,2004,31:260-263.
5 宋一平,崔德键,茅培英,等.慢性阻塞性肺疾病大鼠模型气道重塑及生长因子的研究.中华结核和呼吸杂志,2001,24:283-287.
6 缪胜菊,马杰军,桂峰.低分子肝素联用银杏达莫注射液治疗慢性肺心病急性加重期疗效观察.中国全科医学,2010,13:3970-3972.
7 薛全福,谢剑鸣,胡长贵,等.常压缺氧性大鼠肺动脉高压模型的建立.中华结核和呼吸杂志,1989,12:350-351.
8 Haissaguerre M,Jais P,Shah DC,et al.Spontaneous initiation of atrial fibrillation by ectop ic beats originating in the pulmonary veins.N Engl J Med,1998,339:659-666.
