FADD在人肺腺癌细胞A549诱导T淋巴细胞凋亡中的作用
2011-05-28王红梅张国强闵家新
王红梅 张国强 闵家新
第三军医大学新桥医院胸外科,重庆 400037
FADD在人肺腺癌细胞A549诱导T淋巴细胞凋亡中的作用
王红梅 张国强 闵家新
第三军医大学新桥医院胸外科,重庆 400037
背景与目的:细胞凋亡是肺癌免疫逃逸的机制之一。Fas相关死亡结构域蛋白(Fas associated death domain protein,FADD)在细胞凋亡过程中起着重要作用。本研究旨在探讨FADD在人肺腺癌细胞A549诱导人T淋巴细胞凋亡过程中的作用。方法:用人肺腺癌细胞株A549细胞诱导人淋巴瘤T细胞株Jurkat细胞凋亡,分别于0、2、4和6 h后用流式细胞术检测Jurkat细胞的凋亡率;RT-PCR及Western blot检测Jurkat细胞中FADD的mRNA及蛋白表达情况。结果:人肺腺癌细胞A549诱导Jurkat细胞凋亡呈时间依赖性,各实验组中Jurkat细胞表达FADD蛋白及mRNA水平较对照组显著升高。结论:肺癌细胞可能通过影响T淋巴细胞FADD表达从而反击机体免疫系统,达到自身免疫逃逸的目的。
肺癌; Fas相关死亡结构域蛋白; 凋亡
肺癌是常见恶性肿瘤之一,目前主要的治疗方法为手术、化疗及放疗,但仍然存在术后复发率高,生存期短的问题[1],因此肺癌的免疫治疗已经成为近年来研究的热点。目前对肺癌发病机制的研究表明,在肺癌发生、发展过程中,肺癌细胞不仅可以通过“免疫逃逸”机制逃避宿主免疫系统的监视和攻击,减少自身凋亡;还可以通过“Fas反击”机制造成宿主免疫能力降低[2]。由于Fas相关死亡结构域蛋白(Fas associated death domain protein,FADD)是Fas凋亡信号途径中的必需蛋白[3],本研究利用人肺腺癌细胞株A549细胞诱导人淋巴瘤T细胞株Jurkat细胞凋亡,形成“Fas反击”的体外细胞培养模型,检测不同培养时间后Jurkat细胞凋亡及FADD表达的变化情况,为进一步明确FADD在肺癌免疫逃逸中的作用机制、寻找肺癌免疫治疗新方法提供依据。
1 材料和方法
1.1 材料
人肺癌细胞株A549由第三军医大学新桥医院呼吸研究所提供,人淋巴瘤T细胞株Jurkat(ATCC TIB-152)由上海麦莎生物科技有限公司代购;澳大利亚优质胎牛血清、RPMI-1640培养基购于Hyclone公司。Annexin V(FITC)/PI凋亡检测试剂盒购于杭州隆基生物工程研究所。蛋白提取液购于Pierce公司,羊抗人FADD单克隆抗体、鼠抗人β-actin单克隆抗体购于Santa Cruz公司,考马斯亮蓝试剂盒购于南京建成生物科技有限公司。总RNA提取试剂盒及两步法RT-PCR试剂盒购于GENEAID公司。
1.2 方法
1.2.1 细胞培养
从液氮中取出冻存的A549细胞及Jurkat细胞,37 ℃迅速解冻,分别以含10%胎牛血清的RPMI 1640培养基进行复苏、培养,细胞传至第4代左右,台盼蓝染色排斥法检测2种细胞活性均在95%以上开始实验。将A549细胞以5×105mL-1密度接种至培养瓶内,待细胞长满至85%左右,计数约1×106mL-1,吸去培养液;用含10%胎牛血清的RPMI 1640新鲜培养基将对数生长期约1×106个Jurkat细胞制成细胞悬液,加入A549细胞培养瓶中分别共培养0、2、4和6 h后分组收集Jurkat细胞。
1.2.2 流式细胞术检测各组Jurkat细胞凋亡率
用离心管分别收集各组中Jurkat细胞,1 500 r/min、离心半径5 cm,离心10 min,弃上清液,用PBS洗涤离心1次,弃上清液,向离心管中加入300 μL Banding buffer及5 μL AnnexinV-FITC,混匀,室温避光温育15 min,再加入5 μL PI,室温避光温育5 min,上流式细胞仪检测细胞凋亡率,同时以不加AnnexinV-FITC及PI的一管作为对照。
1.2.3 RT-PCR检测各组Jurkat细胞中FADD的mRNA表达
将收集的Jurkat细胞用PBS离心洗涤后,按试剂盒说明书,提取细胞总RNA,采用两步法进行R T-P C R操作。所用引物序列由华大基因上海鼎安生物科技有限公司设计,F A D D上游引物序列为:5’-CCGCCATCCTTCACCAGA-3’,下游引物序列为:5’-TACGAGATCCCGCTGCCT-3’,扩增片段长度为415 bp;GAPDH上游引物序列为:5’-CATGGGTGTGAACCATGAGAAGTA T-3’,下游引物序列为:5’-GACTGTGGTCAT GAGTCCTTCCA -3’,扩增片段长度为139 bp。取PCR产物5 μL,用1.5%琼脂糖凝胶电泳成像。
1.2.4 Western blot检测各组Jurkat细胞中FADD蛋白表达
把已收集的Jurkat细胞用PBS洗涤,于1 500 r/min、离心半径5 cm,离心10 min后,加入含蛋白酶抑制剂的蛋白提取液,提取细胞总蛋白,用考马斯亮蓝G250试剂盒检测蛋白浓度,画蛋白标准曲线并调整浓度基本一致后100 ℃煮沸变性。取适量蛋白进行SDS-PAGE电泳,半干法转膜,封闭,按1∶1 000分别温育羊抗人FADD单克隆抗体及鼠抗人β-actin单克隆抗体,4 ℃过夜后洗膜,按1∶1 000分别温育二抗,洗膜后用化学发光底物显影照相。
1.3 统计学处理
实验结果用表示,利用SPSS 13.0软件对各组数据进行单因素方差分析,组间多重比较采用Tukey法,P<0.05为差异有统计学意义。
2 结 果
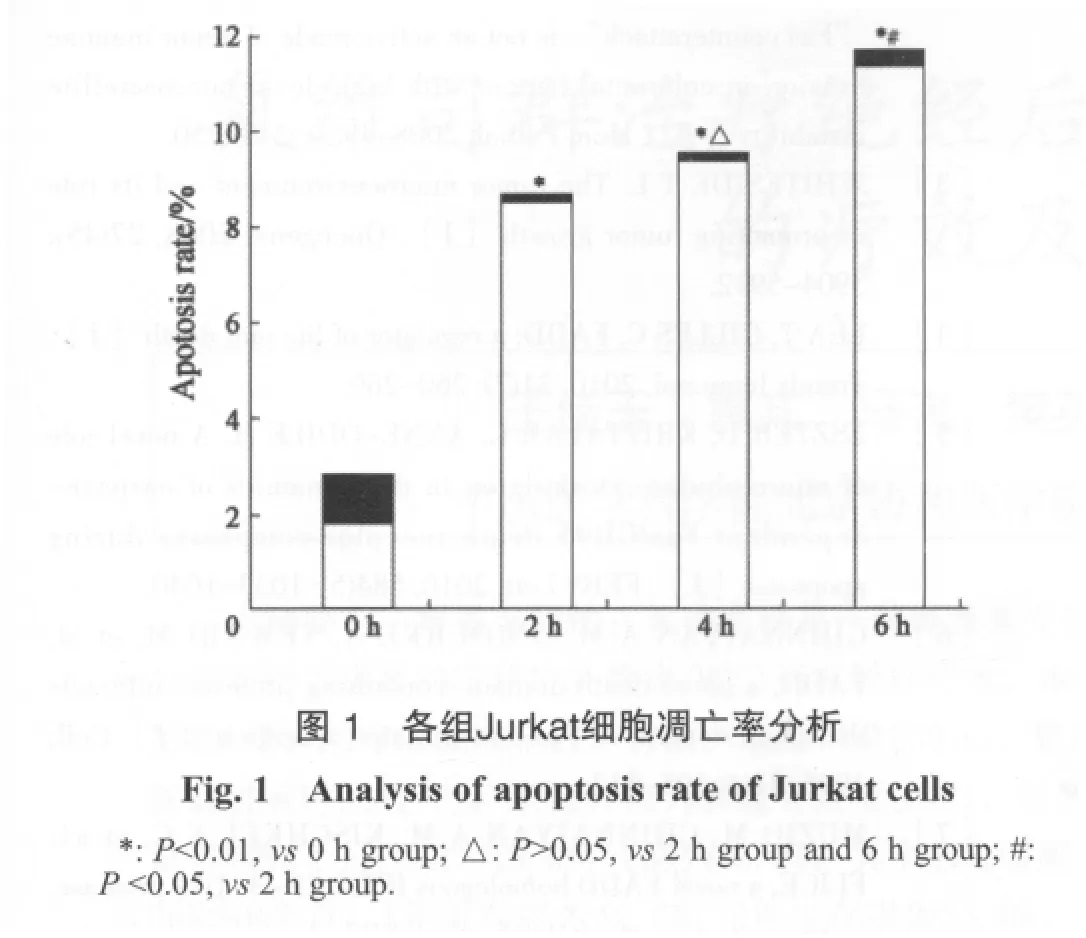
2.1 Jurkat细胞凋亡率检测
从检测结果可以看出,在A549细胞对Jurkat细胞分别作用2、4和6 h后,Jurkat细胞凋亡率分别为(8.23±0.17)%、(9.11±0.21)%和(11.11±0.32)%,呈明显增高趋势;空白对照组凋亡率为(1.53±0.10)%,实验组与对照组比较差异有统计学意义(P<0.01);2 h组与6 h组间比较差异有统计学意义(P<0.05),其余组间比较差异均无统计学意义(图1)。
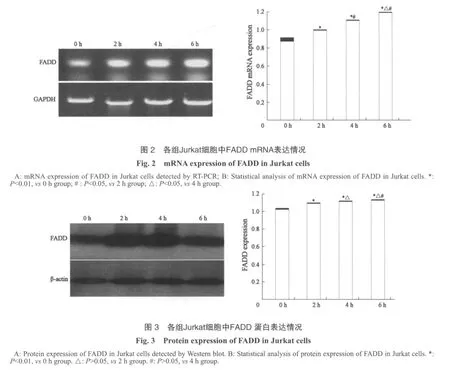
2.2 FADD表达的检测
各组中Jurkat细胞均表达FADD,所有实验组中FADD蛋白及mRNA的表达均显著高于对照组(P<0.01),随A549作用时间的延长,各实验组中Jurkat细胞在mRNA水平的FADD表达明显升高,差异有统计学意义(P<0.05)(图2A、B),各实验组中FADD蛋白水平的表达也呈现逐渐升高的趋势,实验组显著高于对照组,差异有统计学意义(P<0.01),但组间差异并未达统计学意义(P>0.05)(图3A、B)。
3 讨 论
FADD又名MORT1、FAS相关死亡结构域蛋白,存在于细胞胞质中,是细胞凋亡信号通路中的胞质死亡信号衔接蛋白,也是Fas/FasL介导的凋亡途径中的必需分子[4-6]。人FADD蛋白组织分布无特异性,存在于许多成年个体和胚胎的多种组织中。当Fas与FasL结合导致Fas胞内的死亡域形成三聚体而活化,并引起与之结合的FADD构象改变,使Caspase-8活化并激发下游的Caspase-3、6等级联反应,诱发细胞凋亡[7]。
研究表明,FADD的表达在恶性肿瘤组织中低于肿瘤周边正常组织。通过上调肿瘤组织中FADD的表达,可以促进肿瘤细胞凋亡的发生。但对于在肿瘤细胞免疫逃逸过程中,机体淋巴细胞表达FADD的变化情况研究很少。向青等[8]和王红梅等[9]利用不同种类的人肺癌细胞株细胞诱导人淋巴瘤T细胞株Jurkat细胞凋亡,证实了肺癌细胞可以通过“Fas反击”攻击机体免疫系统,但对于这一过程中T淋巴细胞表达FADD的变化情况报道甚少。
本研究结果表明,在肺癌细胞A549介导的Jurkat细胞凋亡发生过程中,随着凋亡的发生,Jurkat细胞中FADD蛋白及mRNA表达水平均明显升高,由此可以推论,在肺癌发生、发展的进程中,肺癌细胞可能通过促进机体T淋巴细胞高表达FADD,导致部分T淋巴细胞的凋亡,从而逃避机体免疫系统的攻击。同时研究发现,Jurkat细胞凋亡率随着A549作用时间的延长而升高,呈时间依赖性;这也可以解释肺癌患者晚期出现抵抗力下降、手术效果差等情况[10]。
Peggs等[11]的研究表明,化疗药物可以上调多种肿瘤细胞包括人淋巴瘤T细胞株Jurkat的FADD表达。结合本研究还可以推测,很多恶性肿瘤患者经过化疗后机体免疫状况的下降,很可能与化疗药物引起机体T淋巴细胞FADD表达变化有关,FADD可成为筛选化疗药物和化疗方案的一个重要因子;同时,通过改变机体免疫系统FADD的表达来抑制肿瘤细胞的免疫逃逸也成为可能。
FADD不仅与细胞凋亡有关,还参与细胞周期的调控,与细胞增殖有关[12-13]。在此次试验中,并未验证人肺癌细胞A549作用导致Jurkat细胞中FADD改变的情况是否与细胞周期相关。在肺癌发病过程中,肺癌细胞是否通过改变宿主T淋巴细胞FADD的表达,影响T淋巴细胞的增殖,从而影响机体的免疫能力,还有待进一步研究。
[1]MASSIMILIANO P, TOMMASO R, GUGLIELMO F, et al.Circulating plasma DNA as diagnostic biomarker in non-small cell lung cancer [J]. Lung Cancer, 2009, 64(1): 92-97.
[2]AILEEN M H, JULIE M M R, MICHAEL D W, et al. The“Fas counterattack” is not an active mode of tumor immune evasion in colorectal cancer with high-level microsatellite instability [J]. Hum Pathol, 2008, 39(2): 243-250.
[3]WHITESIDE T L. The tumor microenvironment and its role in promoting tumor growth [J]. Oncogene, 2008, 27(45):5904-5912.
[4]LÉA T, GILLES C. FADD: a regulator of life and death [J].Trends Immunol, 2010, 31(7): 260-269.
[5]ESZTER D, KRITTALAK C, ANNE-ODILE H. A novel role of microtubular cytoskeleton in the dynamics of caspasedependent Fas/CD95 death receptor complexes during apoptosis [J]. FEBS Lett, 2010, 584(5): 1033-1040.
[6]CHINNAIYAN A M, O’ROURKE K, TEWARI M, et al.FADD, a novel death domain-containing protein,interacts the death domain of Fas and initiates apoptosis [J].Cell,1995, 81(4):505-512.
[7]MUZIO M, CHINNAIYAN A M, KISCHKEL F C, et a1.FLICE, a novel FADD homologous ICE/CED-3-1ike protease,is recruited to the CD95 (Fas/AP0-1) death-inducing signaling complex[J]. Cell, 1996, 85(6): 817-827.
[8]向青, 徐波, 徐梅. Fas/FasL途径介导的人肺癌细胞免疫逃逸 [J]. 中国病理生理杂志, 2006, 22(1): 168-171.
[9]王红梅, 张国强, 戴纪纲, 等. 人淋巴瘤细胞Jurkat通过Fas/FasL途径抑制人肺癌细胞A549的免疫逃逸[J]. 中国肺癌杂志, 2010, 13(7): 681-685.
[10]MOHIT A, GOVINDA B, GARY W C, et al. Age, tumor size,type of surgery, and gender predict survival in early stage (stageⅠ and Ⅱ) non-small cell lung cancer after surgical resection[J]. Lung Cancer, 2010, 68, (3): 398-402.
[11]PEGGS K S, QUEZADA S A, ALLISON J P. Cell intrinsic mechanisms of T-cell inhibition and application to cancer therapy [J]. Immunol Rev, 2008, 224(1): 141-165.
[12]GARCÍA-FUSTER M J, RAMOS-MIGUEL A, MIRALLES A, et al. Opioid receptor agonists enhance the phosphorylation state of Fas-associated death domain (FADD) protein in the rat brain: functional interactions with casein kinase Ialpha, Galpha(i) proteins, and ERK1/2 signaling[J].Neuropharmacology, 2008, 55(5): 886-899.
[13]GIULIANA P, NADIA T, ROBERTA C, et al. FADD-calmodulin interaction: A novel player in cell cycle regulation[J]. Biochim Biophys Acta, 2010, 1803(8): 898-911.
Role of FADD in apoptosis of T lymphocyte induced by human lung carcinoma cell A549
WANG Hong-mei,ZHANG Guo-qiang, MIN Jia-xin(Department of Thoracic Surgery, Xinqiao Hospital, the Third Military University, Chongqing 400037, China)
ZHANG Guo-qiang E-mail:Zhang006006@163.com
Background and purpose:Studies have conf i rmed that one mechanism of immune evasion in lung cancer is apoptosis, and the Fas associated death domain (FADD) is important in the process. This study aimed to investigate the function of Fas associated death domain (FADD) in apoptosis of T lymphocyte induced by human lung carcinoma cell A549.Methods:Human T lymphocytes (Jurkat cells) had been cocultured with human lung carcinoma cells (A549) for 0, 2, 4 and 6 h.Apoptosis rates of Jurkat cells was assessed by fl ow cytometry, the protein and mRNA expression of FADD in Jurkat cells were detected respectively by RT- PCR and Western blot.Results:There were time dependence significance in apoptosis rates and FADD expressions in Jurkat cells (P<0.05).Conclusion:Changes of the FADD expression in T lymphocytes induced by human lung carcinoma cells play an important role in immune evasion of human lung carcinoma cells,it may facilitate the apoptosis of T lymphocytes and depress the immune competence.
Lung cancer; FADD; Apoptosis
10.3969/j.issn.1007-3969.2011.06.007
R734.2
A
1007-3639(2011)06-0457-04
张国强 E-mail:Zhang006006@163.com
2011-03-04
2011-06-02)
