ω-3多不饱和脂肪酸对慢性轻度应激鼠海马基因表达的影响☆
2011-04-19郭晓云俞瑾崔东红傅迎美吴根诚江三多翁史旻张燃江开达
郭晓云俞瑾崔东红傅迎美吴根诚江三多翁史旻张燃江开达
·论 著·
ω-3多不饱和脂肪酸对慢性轻度应激鼠海马基因表达的影响☆
郭晓云*俞瑾△*崔东红*傅迎美*吴根诚△江三多*翁史旻*张燃*江开达*
目的 采用基因芯片技术筛选ω-3多不饱和脂肪酸(omega-3 polyunsaturated fatty acids,ω-3PUFAs)对慢性轻度应激(chronic mild stress,CMS)抑郁大鼠海马作用的相关基因。方法 将大鼠根据随机数字表分为3组(6只/组)给予相应处理8周:研究组(ω-3PUFAs 3.1 ml·kg-1·d-1+CMS),模型对照组(生理盐水+CMS)和正常对照组。每周进行行为学指标(体重和糖水摄入量)的测定。采用大鼠10,891条全基因组cDNA芯片,检测研究组(随机取3只大鼠)和模型对照组(全部大鼠)海马的差异表达基因,评价ω-3PUFAs对基因表达的影响。结果 整个试验过程,ω-3PUFAs对体重没有显著影响(P>0.05),试验第7、8周,研究组糖水摄入量高于模型对照组(P<0.01),且与正常对照组无差异(P>0.05)。与模型对照组比较,研究组共35条基因有差异表达,其中12条基因上调表达,23条基因下调表达,其中主要包括:转运蛋白基因(Slc17a9、Rtp4、Slc15a4、Kpnb1、Abcb7),信号转导通路基因(Jun、Strada),电压依赖性离子通道基因(Vdac2),免疫功能蛋白基因(IgE受体β亚单位、IgG2a重链)等。结论 ω-3PUFAs具有抗抑郁作用,其作用机制可能与对转运蛋白、信号转导通路、离子通道、免疫功能蛋白等多类基因的表达调节有关。
抑郁症 ω-3多不饱和脂肪酸 基因芯片 慢性轻度应激抑郁模型
一直以来,新药开发以及新的抗抑郁靶点的探索是精神医学界的重要课题。分子药理学从基因表达的角度去阐释药物作用机制,这为新药开发以及新抗抑郁靶点的探索研究开辟了崭新的领域。ω-3多不饱和脂肪酸(omega-3 polyunsaturated fatty acids,ω-3PUFAs)在近年来的很多临床试验结果中显示能有效改善抑郁症的临床症状[1-2],对ω-3PUFAs作用机制的深一步探讨可能会给新药开发及新抗抑郁靶点的探索带来突破。由于海马的结构和功能异常在抑郁症患者广泛存在,而海马损伤导致了与抑郁症相关的情感、认知以及记忆的损害[3]。因此,本研究选用慢性轻度应激(chronic mild stress,CMS)抑郁症大鼠的海马这一特定脑区,从基因表达的水平着手,采用高通量的大鼠全基因组cDNA芯片,研究ω-3PUFAs的作用机制,从而可能极大地增加发现新的药物靶点的机率。
1 材料与方法
1.1 实验动物 清洁级雄性Sprague-Dawley大鼠(上海斯莱克实验动物有限公司),共18只,体质量100 g~120 g。除特别说明外,动物房维持室温(22±1)℃,所有大鼠均单笼(40 cm×25 cm×20 cm)饲养,自由饮水和摄食,人工明/暗12 h/12 h昼夜节律(光照时间9:00-21:00)。本研究所有试验操作均遵守中华人民共和国实验动物管理条例和上海市实验动物管理条例。
1.2 材料和仪器 鱼油 (货号F8020)购自美国Sigma公司。采用的大鼠全基因组表达谱芯片(v1.5)(产品编号SBC-R-RC-100-13)购自上海生物芯片公司,该芯片包含10,891条基因。RNA抽提试剂TRIzol和RNA纯化试剂购自德国Qiagen公司,Cy3、Cy5荧光染料购自英国 Amersham公司,G2655AA芯片扫描仪和G2938B分析软件购自美国Agilent公司。
1.3 ω-3PUFAs对慢性轻度应激模型作用的行为学实验
1.3.1 大鼠糖水摄入试验训练及行为学评估 本
实验动物模型的制造在复旦大学中西医结合系完成。先对大鼠进行3 d的适应性饲养,继而进行每周1次共4次的糖水摄入试验训练,在以后的每周六(共8次)的12:00-13:00采用糖水摄入试验对大鼠进行行为学评估。方法:将大鼠禁食禁水14 h,大鼠在1 h内自由饮用质量分数为1%的稀蔗糖水,所饮用的蔗糖水质量为糖水摄入量(sucrose intake)。最末次糖水摄入试验训练结束计为第0周。
1.3.2 大鼠抑郁模型的建立及ω-3PUFAs干预 将上述训练后的大鼠根据随机数字表分为3组(6只/组):研究组、模型对照组、正常对照组。试验1~4周采用慢性轻度应激(chronic mild stress,CMS)法对研究组和模型对照组进行抑郁模型的建立。模型建立方法:每周2次禁食禁水,2次45°鼠笼倾斜,2次随机配对饲养,2次频闪仪的闪光刺激(300次/min),2次潮湿垫料(300 mL水泼入垫料中),1次通宵照明,1次白噪声刺激(90 db),每次刺激持续12~14 h。试验第5~8周在CMS模型建立同时,研究组每日灌胃鱼油 3.1 mL/kg(含 ω-3PUFAs 0.72 mg),模型对照组每日等体积生理盐水灌胃。末次糖水摄入试验结束的次日清晨,将大鼠用10%水合氯醛(350 mg/kg)腹腔注射麻醉后,断头取脑,冰上分离双侧海马,冰生理盐水冲洗,称重,用锡纸包裹迅速投入液氮中,-80℃冻存备用。
1.4 基因芯片杂交与分析 研究组 (随机数字表随机抽取6只中的3只大鼠)及模型对照组(6只大鼠)海马样本。将所取样本双侧海马组织抽提总RNA,继而纯化RNA,所得RNA用紫外分光光度计检测260 nm和280 nm处吸光度值 (A260和A280)。RNA纯度用A260/A280比值判定(标准范围1.8-2.1),结果显示RNA质检全部合格。等量混合6个模型对照组RNA作为阴性对照,每张芯片需1个研究组和6个混合模型对照组的一对样本,所需RNA总量为2 μg。反应体系总体积为20 μL。用MMLV反转录酶1 μL反转录RNA,用Inorganic焦磷酸酶0.6 μL将RNA转录为cRNA,取上述纯化后的cRNA 4 μg加入到Cy3,Cy5荧光染料中混匀,其中研究组RNA采用Cy3荧光标记,模型对照组RNA采用荧光Cy5标记。RNA进行标记后利用等量的探针进行杂交:42℃16 h杂交,55℃洗片。
芯片结果采用Agilent(Axon)扫描仪进行扫描,软件读取数据,最后采用Genespring进行均质化处理分析,最后比值为Cy3/Cy5,比值≥2或≤0.5表明该基因具有上调或下调2倍以上的差异表达。根据基因芯片信息中所提供的基因号,通过美国国立医学生物信息中心(NCBI)http://www.ncbi.nlm.nih.gov中的Gene数据库对差异基因进行基因信息学分析:在Summary中查找基因名;Genomic context中查找基因位点;在Pathways from Biosystems和 Gene Ontology中查找基因功能分类。
1.5 统计学处理 采用SPSS 13.0对数据进行统计分析。行为学实验结果采用(±s)表示。采用一般线性模型(general linear model,GLM)的重复测量过程 (repeated measures)分析大鼠行为学指标(体重和糖水摄入量)随试验周次的变化趋势,以组别作为组间因素,试验周次作为组内因素;随后采用多元方差分析 (multivariate analysis of variance,MANOVA)分析各时点造模和给药两个因素对行为学指标的影响,以LSD检验进行两两比较。检验水准α=0.05,双侧检验。
2 结果
2.1 ω-3PUFAs对抑郁模型大鼠体重和糖水摄入量的作用 重复测量数据分析结果显示,试验第0~8周试验周次(F=29.14,P<0.01)和组别(F=45.6,P<0.01)对体重有显著影响,两者之间存在交互作用(F=3.44,P<0.01)。MANOVA分析显示,整个试验过程ω-3PUFAs对体体重没有显著影响(P>0.05);自第4周起至第8周,CMS造模对体重有显著影响 (F分别为:25.29,18.82,16.70,18.39,24.03,P均小于0.01)。两两比较显示,第4、5、6、7、8周,研究组与模型对照组体重均明显低于正常对照组(P<0.01)。
重复测量数据分析结果显示,试验第0~8周试验周次(F=3.42,P<0.01)和组别(F=8.58,P<0.01)对糖水摄入量有显著影响,两者之间存在交互作用(F=8.30,P<0.01)。MANOVA分析显示:自第3周起至第8周,CMS造模对糖水摄入量有显著性影响 (F分别为:18.90,13.03,24.83,22,75,18.71,23.81,P均小于0.01);自第7周起,ω-3PUFAs对糖水摄入量有显著性影响(F=22.51,P<0.01;F=38.84,P<0.01)。两两组间比较显示,试验第3、4、5、6周,研究组糖水摄入量低于正常对照组(P<0.01),与模型对照组差异无统计学意义(P>0.05);试验第7、8周,研究组糖水摄入量高于模型对照组(P<0.01),与正常对照组无差异(P>0.05)。见表1。
2.2 ω-3PUFAs对抑郁模型大鼠海马基因表达的影响 3对样本共做3张芯片,芯片信号强度高,片内信号均一,具有较低的整体背景和较高的信噪比。阳性质控点信号均匀一致,阴性质控点信号低,变异系数变化小。按照 cy3/cy5比值均≥2或≤0.5的标准挑选表达差异基因,共有35条,其中12条基因为上调表达,23条基因为下调表达。具体基因见表2。
表1 3组大鼠不同试验阶段行为学指标的比较(g,±s)
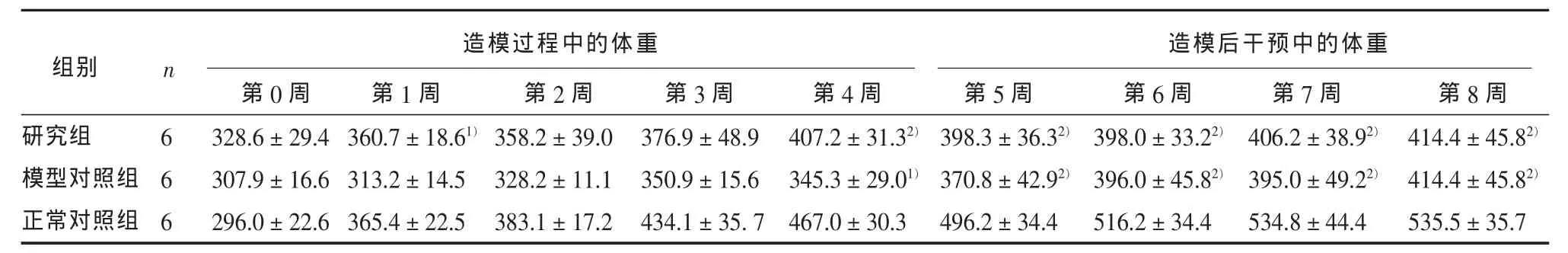
表1 3组大鼠不同试验阶段行为学指标的比较(g,±s)
造模过程中的体重造模后干预中的体重n组别研究组模型对照组正常对照组666第0周328.6±29.4 307.9±16.6 296.0±22.6第1周360.7±18.61)313.2±14.5 365.4±22.5第2周358.2±39.0 328.2±11.1 383.1±17.2第3周376.9±48.9 350.9±15.6 434.1±35.7第4周407.2±31.32)345.3±29.01)467.0±30.3第5周398.3±36.32)370.8±42.92)496.2±34.4第6周398.0±33.22)396.0±45.82)516.2±34.4第7周406.2±38.92)395.0±49.22)534.8±44.4第8周414.4±45.82)414.4±45.82)535.5±35.7
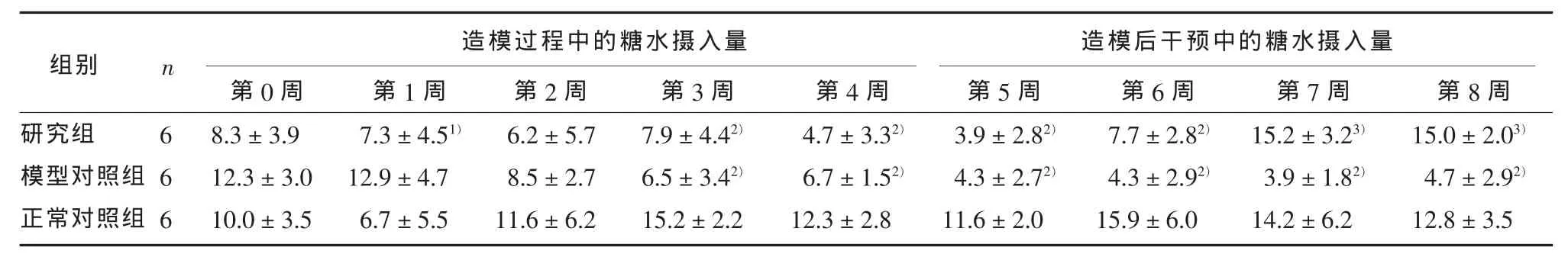
续表1
3 讨论
慢性轻度应激模型是一个具有高的信度和效度的抑郁症动物模型,被一致认为适用于抗抑郁药的药理机制研究,该模型采用糖水消耗试验评估动物的快感缺失的程度(结构效度),糖水消耗量降低反映动物快感缺失,多种抗抑郁药物能逆转能逆转造模所致的糖水摄入量的降低 (预测效度)[4]。因此,糖水摄入量的改变是国内外很多研究作为造模是否成功及抗抑郁药治疗疗效评估的指标[4]。本研究结果显示,试验第3、4、5、6周,研究组糖水摄入量低于正常对照组但与模型对照组无差异,而试验第7、8周研究组糖水摄入量高于模型对照组,表明ω-3PUFAs能有效逆转慢性轻度应激大鼠糖水摄入量降低这一类抑郁样行为。这与既往结果一致,均提示ω-3PUFAs对缓解抑郁症状有效。一个包含了21项临床随机对照研究的Meta分析显示,ω-3PUFAs能有效改善患者抑郁症状,并存在剂量-效应关系[5];而动物研究也发现,长期慢性给予ω-3PUFAs能有效逆转抑郁症动物模型所致的类抑郁样行为[6]。
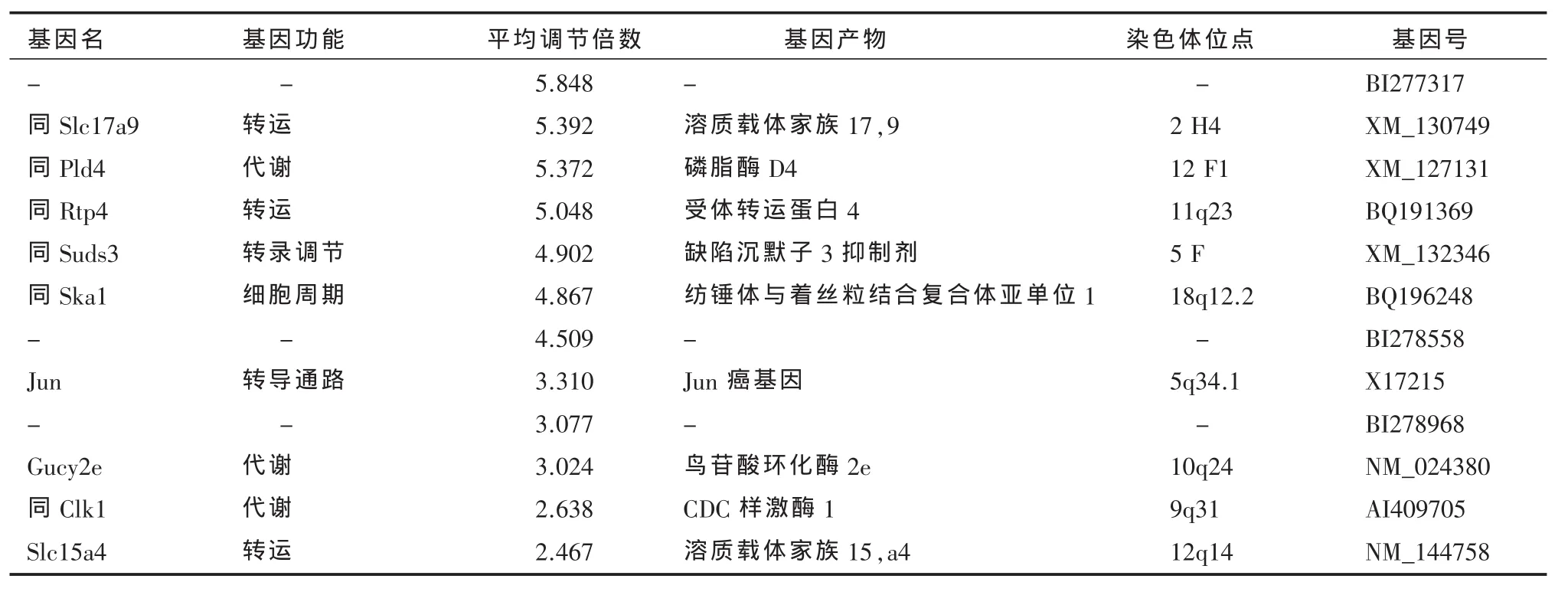
表2 -1 ω-3多不饱和脂肪酸上调基因
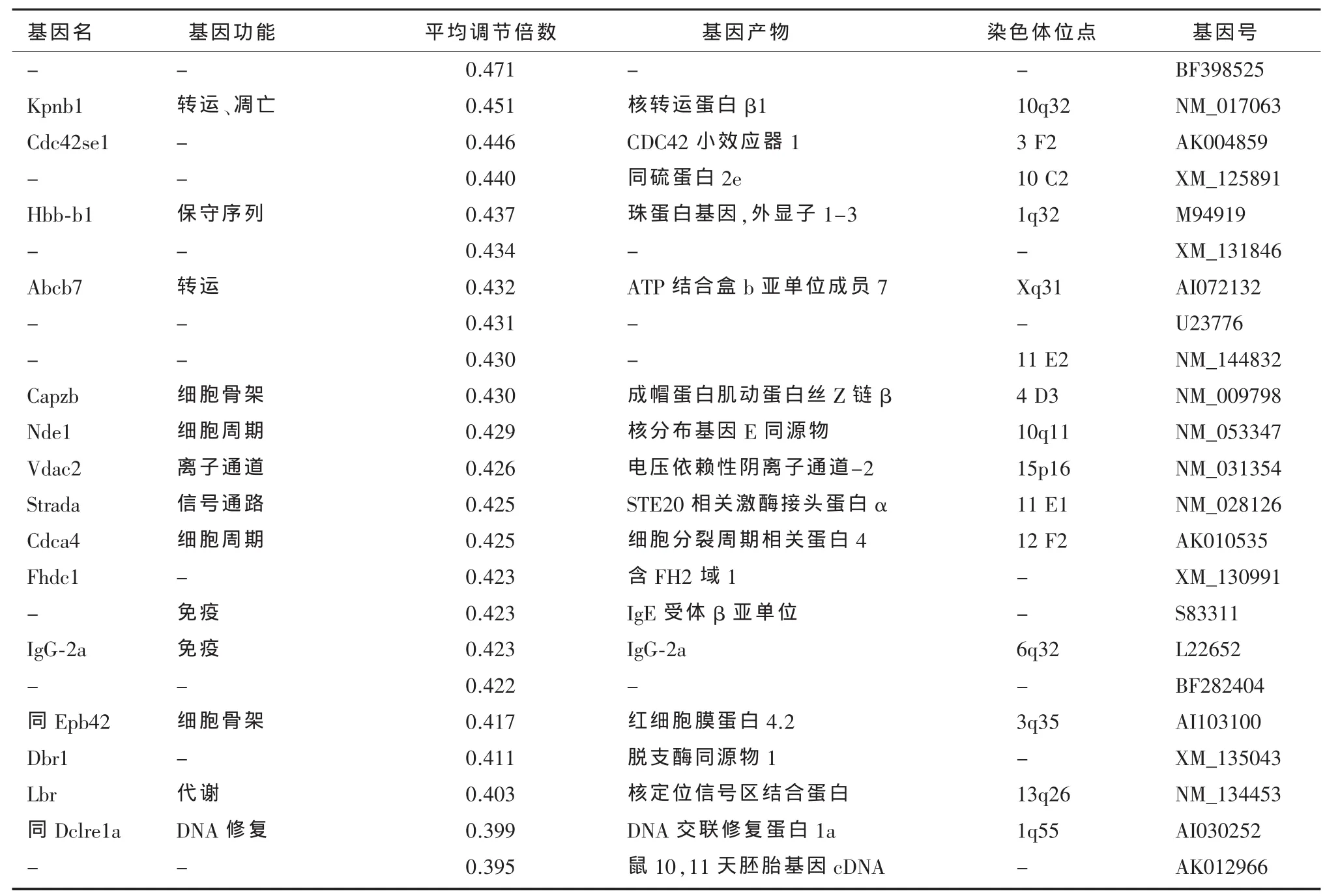
表2 -2 ω-3多不饱和脂肪酸下调基因
目前关于ω-3PUFAs的抗抑郁机制仍不清楚,对ω-3PUFAs作用机制的深一步探讨可能会给新药开发及新抗抑郁靶点的探索带来突破。基因芯片的出现为分子药理学研究提供了有效的手段,因此,本研究采用基因芯片这一高通量和系统性的研究手段,研究ω-3PUFAs作用相关基因。结果显示,CMS抑郁症动物模型海马基因的表达受到ω-3PUFAs的调节,这些基因与中枢神经系统的多种功能相关,对这些基因的深一步研究,对于发现新的抗抑郁药物靶点并由此开发新的抗抑郁药物,具有重要意义。
本研究采用混合模型对照组RNA的方法,选取差异基因的标准为所有的研究组基因均大于2或小于0.5的标准,以减少研究组和对照组单个样本产生的误差。本研究结果显示共有35条基因表达异常,提示他们可能参与了ω-3PUFAs作用机制。根据基因的功能分类分析结果表明,其中ω-3PU FAs对 5个转运蛋白基因 Slc17a9(XM_130749)、Rtp4(BQ191369)、Slc15a4(NM_144758)、Kpnb1(NM_017063)、Abcb7(AI072132)可能起到调节作用。Abcb7基因产物的主要功能为ATP转运,目前认为,在中枢神经系统,ATP是一种兴奋性神经递质,在神经胶质细胞之间以及神经胶质细胞-神经元的相互作用中,起到重要作用[7],而ATP的释放又受到囊泡核苷酸转运体 Slc17a9的影响[8],因此,本研究结果提示,ω-3PUFAs可能通过对Abcb7和Slc17a9基因的调节,对ATP这一特殊神经递质的功能起重要调节作用。另外,本研究还显示ω-3PUFAs对Slc15a4基因起上调作用,该基因产物在海马密集分布,主要参与寡肽的降解过程[9]。目前认为,除了经典的单胺类、乙酰胆碱及氨基酸以外,一些寡肽在中枢神经系统中具有神经递质的作用。上述研究结果提示,ω-3PUFAs可能通过对转运蛋白从而对神经递质的调节,调控中枢神经系统功能。
本研究结果显示,ω-3PUFAs对两个信号转导通路基因Jun(X17215)和 Strada(NM_028126)也可能起调控作用。本研究显示ω-3PUFAs上调Jun基因(X17215)的表达。而目前研究表明,该基因参加了众多的信号转导通路,包括:凋亡途径,B细胞受体信号通路,Notch信号通路,ErbB信号通路,神经营养信号通路,MAPK信号通路,Wnt信号通路,而抗抑郁药物和情感稳定剂能有效逆转抑郁症所存在的上述通路的异常[10-11]。另外一个Strada基因参与了胰岛素的信号通路,主要功能是对胰岛素受体起活化作用,而I型糖尿病与抑郁症可能存在生物学相关[12]。因此,对上述基因进行进一步研究,对于寻找ω-3PUFAs对抑郁症信号转导通路的靶点并由此开发新的抗抑郁药物,具有重要意义。
本研究结果显示,ω-3PUFAs能下调电压依赖性离子通道基因Vdac2(NM_031354)的表达。Vdac基因共有 3个同分异构体:Vdac1、Vdac2和Vdac3。Vdac基因表达产物蛋白位于细胞质和线粒体膜,在调控细胞凋亡过程中起重要作用。Akanda等[13]研究显示,在正常的海马神经元中,Vdac的通道呈关闭状态,然而在凋亡的神经元中,Vdac通道开放,抗Vdac的抗体则能有效抑制神经元凋亡。King等[14]的研究也表明,ω-3PUFAs能有效减少成年大鼠脊髓挤压损伤导致的神经细胞凋亡,增加神经细胞的存活。上述研究提示,ω-3PUFAs可能通过下调Vdac基因表达继而抑制凋亡的途径,发挥抗抑郁效应。
本研究结果表明,ω-3PUFAs对2条免疫功能蛋白基因:IgE受体β亚单位(S83311)、IgG2a重链(L22652)的表达均起到下调作用。目前已有研究发现,IgE可诱发变态反应性疾病,并可引起脑的神经生化改变,患者在春季抑郁症和自杀的高发生率可能与IgE升高有关[15]。上述研究提示,ω-3PUFAs可能通过抗炎作用的机制发挥抗抑郁作用。
另外,本研究还发现,ω-3PUFAs对3个细胞骨架蛋白基因Ska1(BQ196248)Capzb(NM_009798)、Epb42(AI103100)和2个细胞周期蛋白基因Nde1(NM_053347)和Cdca4(AK010535)起调节作用。并且,ω-3PUFAs对转录调节基因Suds3(XM_132346)起下调表达作用,ω-3PUFAs对4个代谢相关基因Pld4(XM_127131),Gucy2e(NM_024380)、Clk1(AI409705)、Lbr(NM_134453)。尽管目前关于这些基因与抑郁症和抗抑郁药物的研究还较少,但现有研究发现以上几类基因与脑也有着密切的关系,如Capzb蛋白在轴突末端的生长锥形成、轴突生长中发挥重要作用[16]。NDE1基因在神经胶质细胞高度表达,在大脑皮质发育中起重要作用,NDE1缺陷导致神经发育缺陷[17]。因此,对这些基因进一步研究,对于进一步阐明ω-3PUFAs与脑功能的联系具有重要意义。
综上,ω-3PUFAs能改善CMS模型鼠的类抑郁行为,并且本研究结果显示ω-3PUFAs对该CMS模型的转运蛋白、信号转导通路、离子通道、免疫等基因以及一些功能未明基因起调节作用。对上述基因作进一步的基因定量表达验证,排除假阳性发现,并对有阳性重复结果的基因作进一步研究,对于阐明ω-3PUFAs的作用机制,以及寻找新的抗抑郁靶点,具有重要意义。
致谢 中国医科大学第一临床学院精神科李晓白教授对本课题设计及方法学的指导。
[1]Nemets H,Nemets B,Apter A,et al.Omega-3 treatment of childhood depression: a controlled, double-blind pilot study[J].Am J Psychiatry,2006,163(6):1098-1100.
[2]Marangell LB,Martinez JM,Zboyan HA,et al.A doubleblind, placebo-controlled study of the omega-3 fatty acid docosahexaenoic acid in the treatment of major depression[J].Am J Psychiatry,2003,160(5):996-998.
[3]Frodl T,Reinhold E,Koutsouleris N,et al.Interaction of childhood stress with hippocampus and prefrontal cortex volume reduction in major depression[J].J Psychiatr Res,2010,44(13):799-807.
[4]Willner P.Validity,reliability and utility of the chronic mild stress model of depression: a 10-year review and evaluation[J].Psychopharmacology,1997,134(4):319-329.
[5]Kraguljac NV,Montori VM,Pavuluri M,et al.Efficacy of omega-3 Fatty acids in mood disorders-a systematic review and metaanalysis[J].Psychopharmacol Bull,2009,42(3):39-54.
[6] 郭晓云,崔东红,顾靖,等.ω-3多不饱和脂肪酸对慢性轻度应激抑郁症动物模型的作用及单胺类神经递质的影响 [J].中华精神科杂志,2007,40(4):238-242.
[7]Butt AM.ATP:a ubiquitous gliotransmitter integrating neuronglial networks[J].Semin Cell Dev Biol,2011,22(2):205-213.
[8]Larsson M, Sawada K, Morland C, et al.Functional and anatomical identification of a vesicular transporter mediating neuronal ATP release[J].Cereb Cortex,2011.[Epub ahead of print]
[9]Yamashita T,Shimada S,Guo W,et al.Cloning and functional expression of a brain peptide/histidine transporter[J].J Biol Chem,1997,272(15):10205-10211.
[10]Bachis A, Cruz MI, Nosheny RL, et al.Chronic unpredictable stress promotes neuronal apoptosis in the cerebral cortex[J].Neurosci Lett,2008,442(2):104-108.
[11]Gupta A,Schulze TG,Nagarajan V,et al.Interaction networks of lithium and valproate molecular targets reveal a striking enrichment of apoptosis functional clusters and neurotrophin signaling[J].Pharmacogenomics J,2011.
[12]Korczak DJ,Pereira S,Koulajian K,et al.Type 1 diabetes mellitus and major depressive disorder: evidence for a biological link[J].Diabetologia,2011,54(10):2483-2493.
[13]Akanda N,Tofighi R,Brask J,et al.Voltage-dependent anion channels(VDAC)in the plasma membrane play a critical role in apoptosis in differentiated hippocampal neurons but not in neural stem cells[J].Cell cycle,2008,7(20):3225-3234.
[14]King VR,Huang WL,Dyall SC,et al.Omega-3 fatty acids improve recovery,whereas omega-6 fatty acids worsen outcome,after spinal cord injury in the adult rat[J].J Neurosci,2006,26(17):4672-4680.
[15]Postolache TT,Roberts DW,Langenberg P,et al.Allergen specific IgE,number and timing of past suicide attempts,and instability in patients with recurrent mood disorders[J].Int J Child Health Hum Dev,2008,1(3):297-304.
[16]Davis DA,Wilson MH,Giraud J,et al.Capzb2 interacts with beta-tubulin to regulate growth cone morphology and neurite outgrowth[J].PLoS Biol,2009,7(10):e1000208.
[17]Bakircioglu M,Carvalho OP,Khurshid M,et al.The Essential Role of Centrosomal NDE1 in Human Cerebral Cortex Neurogenesis[J].Am J Hum Genet,2011,88(5):523-535.
The effect of omega-3 polyunsaturated fatty acids on gene expression profile in the hippocampus in chronic mild stress rats.
GUO Xiaoyun,YU Jin,CUI Donghong,FU Yingmei,WU Gencheng,JIANG Sanduo,WENG Shimin,ZHANG Ran,JIANG Kaida.Shanghai Mental Health Center,Shanghai Jiaotong University School of Medicine,No.600 South Wanping Road,Shanghai 200030.China.Tel:021-64860502.
Objective To study the effect of omega-3 polyunsaturated fatty acids(ω-3PUFAs)on gene expression profile of the hippocampus in chronic mild stress rats using microarray.Methods All rats were divided into three groups(6 rats per group)according to the table of random digit:research group(treateol with ω-3PUFAs 3.1 ml·kg-1· d-1+CMS),model control group(treateol with saline+CMS)and normal control group.Weight and sucrose intake were examined every week.The hippocampus tissues from research group (3rats randomly chosen) and model control group(all rats)was used to assess the impact ofω-3PUFAs on gene expression profile of the hippocampus using a cDNA microarray with 10,891 distinct rat genes.Results There were no difference in weight between research group and model control group throughout the whole experiment(P>0.05).On week 7 and 8, sucrose intake were higher in research group than in model control group(P<0.01),but were no different between research group and normal control group(P>0.05).Thirty-five genes had altered change in ω-3PUFAs treated rats.Among them,12 genes were upregulated and 23 genes was downregulated.Those genes include transport protein gene(Slc17a9、Rtp4、Slc15a4、Kpnb1、Abcb7),signal transduction gene(Jun、Strada),voltage dependence ion channel gene(Vdac2)and immune function protein gene(IgE receptor β subunit、IgG2a heavy chain).Conclusions ω-3PUFAs can improve the depressant-like behavior in chronic mild stress rats which may invlove many genes including transport protein, signal transduction, ion channel,and immune genes and some genes with ambiguous function.
Depression Omega-3 polyunsaturated fatty acids Microarray Chronic mild stress depression model
R794.4
A
2011-06-22)
(责任编辑:曹莉萍)
☆ 上海市科委“登山行动计划”项目基础性研究重点项目(编号:06JC14061);上海市精神卫生中心院级课题(编号:2010-YJ-06)
* 上海交通大学医学院附属精神卫生中心(上海 200030)
(Email:jiangkaida@yahoo.com.cn;gcwu@shmu.edu.cn)
△ 复旦大学上海医学院中西医系,针刺原理研究所
