优化多重PCR扩增效果的实验研究
2011-03-06赵邦荣张香改齐娜娜胡振华马静
赵邦荣 张香改 齐娜娜 胡振华 马静
聚合酶链式反应(polymerase chain reaction,PCR)是一种体外扩增特异DNA片段的技术,具有特异性高、敏感性强、产率高、操作简单、重复性好、快速、易自动化等突出优点,在生命科学研究及相关诸多领域已经得到了广泛应用。多重PCR是在一个反应体系中使用多对引物,针对多个DNA模板或同一模板的不同区域进行扩增的过程,满足同时分析不同DNA序列的需要,尤其是在临床检测和科学研究时,在一个反应体系中能够同时检测多种目的DNA,这不仅能节省珍贵的实验样品,而且能使以往繁琐的操作变得省时省力,具有高效快捷、高度特异敏感、实验成本低等优点,具有普通PCR方法不可比拟的优越性。本研究采用Y染色体10对引物探讨了基因组DNA的多重PCR反应体系中各种因素对扩增结果的影响,优化了反应体系和反应条件,以期为应用多重PCR反应检测Y染色体微缺失提供稳定可靠的方法。
1 材料与方法
1.1 材料
1.1.1 引物:检索NCBI的UniSTS获得10对Y染色体引物序列(sY14、sY67、sY129、sY133、sY145、sY150、sY152、sY153、sY157、sY254),引物由上海生工合成,纯化方法为 ULTRAPAGE。
1.1.2 2 ×Taq MasterMix:购自康为世纪,Taq polymerase 0.25 U/μl,终浓度为 1 × Taq PCR Buffer,1.5 mmol/L MgCl2,200 μmol/L dNTPmix。
1.1.3 DNA模板提取:血液基因组提取试剂盒购自康为世纪,按说明提取DNA。
1.2 方法:多重PCR扩增,产物3%琼脂糖电泳,电压80V,EB染色,凝胶成像系统拍照并保存图像。
2 结果
2.1 反应条件优化
2.1.1 反应体积:目前常用的多重PCR反应体积有50、25、20、15、5 μl等。50 μl反应体积较大,但较浪费实验材料,5 μl反应体积虽然较小,但加样误差相对增大,我们认为20μl反应体积较合适。图1中1~4泳道为50μl反应体积,5~8泳道为20μl反应体积,两者扩增效果无明显差别。
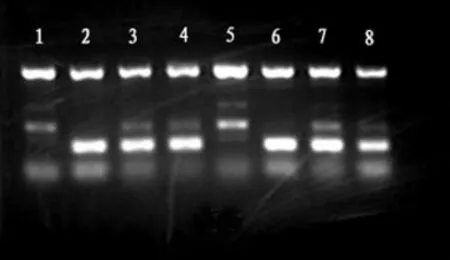
图1 不同反应体积及是否预混PCR电泳图
2.1.2 预混分装引物:20μl反应体积多重PCR每种引物只需加样0.25~1μl,加样误差相对较大,可通过预混引物以减小误差;一般临床检验可能一次检测标本量少,以及为了方便实验当天的操作,可预先预混、分装引物,于-20℃保存。图1中第4、8泳道为预混分装后经-20℃保存的引物,第3、7泳道为实验当天加入的引物,两者扩增效果无明显差别。
2.1.3 退火温度:首先对循环数、变性温度、变性时间、延伸时间进行了摸索(限于篇幅,不做详论),然后对退火温度进行了梯度摸索(图2),确定退火温度为58℃,各引物均能很好的扩增出目的片段。最后确定反应条件为95℃预变性3 min,95℃30 s,58℃ 30 s,72℃ 30 s,33 个循环,72℃延伸 10 min。

图2 退火温度梯度多重PCR电泳图
2.2 反应体系优化
2.2.1 引物浓度和模板量的正交实验:以模板和引物为实验因素,取A、B、C三种水平,见表1。9组结果中第6组较好(图3),为0.125μmol/L引物浓度和25 ng模板量。

图3 不同引物浓度和不同模板量多重PCR电泳图
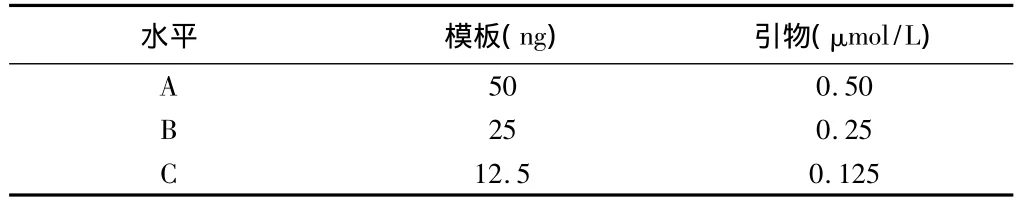
表1 正交实验因素-水平表
2.2.2 引物浓度的调整:首先进行等浓度引物的多重PCR扩增,各目的条带亮度不均(图4)。因此按倍比关系降低亮带引物浓度,增加暗带引物浓度,从0.03125~0.25μmol/L,相差8倍,从而使条带亮度趋于一致(图5)。

图4 等浓度引物多重PCR电泳图

图5 调整引物浓度多重PCR电泳图
3 讨论
自1988年Chamberlain等[1]首先使用多重PCR技术对人DMD进行检测以来,多重PCR技术已被成功地应用到了生物学的多个方面,如各类病原的检测与鉴别、遗传疾病诊断、以及基因缺失、突变和多态性分析、定量分析等。与常规PCR相比,多重PCR由于同时涉及到了多对引物,因而影响因素更多,可以分为反应体系和反应条件两大类,因此,必须对反应条件进行优化。随着多重PCR技术的进一步成熟及DNA提取试剂盒和混合Taq DNA聚合酶的商品化,操作变得更为简便,只需加入引物、混合Taq DNA聚合酶及DNA模板即可,使得多重PCR技术用于临床检测和科学研究简便易行。但与常规PCR相比,多重PCR由于同时涉及了多对引物,因而影响因素更多,如不同引物在反应体系中的热循环条件和退火温度及延伸温度、反应缓冲液终浓度等。虽然 Henegariu等[2]通过对多重PCR中各种因素的大量组合、调整和优化,以基因组DNA为模板,提出了一项较完整的多重PCR的操作方案和通用策略,但在实际应用中仍然要对反应体系和反应条件进行优化。
引物的优劣直接关系到PCR的特异性与灵敏度,可以检索NCBI的UniSTS获得引物序列或应用各种软件自行设计引物序列[3]。初次进行多重PCR反应时,各种引物按相等的摩尔数添加是很有必要的,结果将会揭示哪些引物的浓度需要调整。过高的引物浓度易引起错配,增加其非特异性扩增,还易形成引物二聚体,出现条带弥散或拖尾现象;过低的引物浓度易造成扩增产物太少而使条带过弱或消失。
目前多重PCR还存在一些普遍的问题,如某一特定片段的优先扩增及容易形成引物二聚体等。影响多重PCR扩增效果的因素为反应体系和反应条件。
在反应体系中主要影响因素有引物浓度、模板量、Taq酶用量、Mg2+浓度、dNTP浓度,可以用正交设计来优化[4]。本实验采用商品化的混合Taq酶(含Taq polymerase 0.25 U/μl,终浓度为1 × Taq PCR Buffer,1.5 mmol/L MgCl2,200 μmol/L dNTP mix),只需对引物浓度和模板量进行优化,采用三个水平,进行9次实验即可。按2×Taq MasterMix操作说明加等量浓度引物进行多重PCR,以0.125μmol/L浓度引物及25 ng模板量最优,但是扩增条带亮度并非均一,即使在优化了循环条件后,某些基因的扩增产物仍不明显。由于引物之间存在竞争性抑制,造成同一管内产物量不等,导致电泳条带亮度相差较大,因此按倍比关系进一步调整了引物的浓度,即亮带进一步降低引物浓度,暗带则增加引物浓度,从0.03125~0.25μmol/L,相差8倍,扩增条带亮度趋于一致。
反应条件的影响因素有退火温度、循环数、反应体积等,但最主要的是退火温度,退火温度决定PCR特异性与产量。温度高,特异性强,但过高则引物不能与模板牢固结合,DNA扩增效率下降;温度低,产量高,但过低可造成引物与模板错配,非特异性产物增加。一般可根据引物的(G+C)%含量进行推测,退火温度Ta(annealing temperature)比扩增引物的融解温度Tm(melting temperature)低5℃,可按公式进行计算:Ta=Tm-5℃ =4(G+C)+2(A+T)-5℃。但最好使用梯度PCR仪摸索最佳退火温度,更方便、快捷、准确。本实验经过梯度摸索,采用58℃30秒的退火温度和时间,得到了理想的目的片段。
总之,可用梯度PCR仪优化退火温度,用正交设计优化引物浓度和模板量,同时调整多重PCR反应中各对引物之间的浓度差异,以优化多重PCR的扩增效果。
1 Chamberlain JS,Gibbs RA,Ranier JE,et al.Deletion screening of the Duchennemuscular dystrophy locus viamultiplex DNA amplification.Nucleic Acids Res,1988,16:11141-11156.
2 Henegariu O,Heerema NA,Dlouhy SR,et al.Multiplex PCR:critical parameters and step-by-step protocol.Biotechniques,1997,23:504-511.
3 王稳,屈武斌,申志勇,等.利用 MPprimer设计引物并优化扩增条件以提高多重 PCR效率的实验研究.生物化学与生物物理进展,2010,37:342-346.
4 赵宏宇,蔡禄,赵秀娟,等.应用正交实验法优化DNA重复序列的PCR扩增体系.内蒙古科技大学学报,2008,27:346-350.
