一种新型IIa类细菌素的克隆表达和活性鉴定
2011-02-10谢燕陈海琴张秋香田丰伟陈永泉张灏陈卫
谢燕,陈海琴,张秋香,田丰伟,陈永泉,张灏,陈卫
江南大学食品学院,无锡 214122
一种新型IIa类细菌素的克隆表达和活性鉴定
谢燕,陈海琴,张秋香,田丰伟,陈永泉,张灏,陈卫
江南大学食品学院,无锡 214122
NB-C1为一种潜在的IIa类细菌素基因,为实现其在大肠杆菌中的高效可溶表达,首先构建了NB-C1蛋白与绿色荧光蛋白 (GFP) 的融合表达载体 pIVEX 2.4d-GFP-NB-C1,然后将构建的表达载体转化大肠杆菌 BL21(DE3) pLysS,经诱导表达后,重组蛋白GFP-NB-C1以可溶的形式存在于细胞内。经Ni-NTA亲和层析柱分离纯化后,重组融合蛋白的纯度大于95%,产量达36.1 mg/L。抑菌试验表明,纯化后的重组蛋白对单核细胞增生李斯特氏菌具有明显的抑制作用。
IIa类细菌素,融合表达,蛋白质纯化,活性鉴定
采用传统的菌种筛选法寻找新的细菌素,存在乳酸菌出发菌株细菌素产量低,分离纯化困难等问题[3]。我国有丰富的乳酸菌资源,随着乳酸菌基因组序列报道的日趋增多,利用基因搜索工具寻找新的细菌素已成为一条快速有效的途径。根据细菌素氨基酸的保守序列及其结构基因上下游的特征编码基因,如调节基因、转运基因、免疫基因等的特征,利用生物信息学工具设计 IIa类细菌素基因的搜索比对脚本,在已测序乳酸菌基因组数据库中搜索潜在的IIa类细菌素基因,然后通过比对分析,排除错误基因和已报道的乳酸菌细菌素基因,从而确定新的细菌素基因。目前已从乳酸菌基因组中鉴定出多种细菌素基因[4-6]。Diep等[7]从一株戊糖片球菌中得到一条新的类片球菌素基因,在沙克乳杆菌中表达并获得较高的产量和活性。国外已有关于细菌素异源表达的研究[8-10],其重组表达宿主以大肠杆菌居多,其中不乏理想的研究成果[11-14]。利用基因搜索工具筛选细菌素基因并结合基因工程重组表达,定能加强新型高效乳酸菌细菌素的开发和应用,这对食品安全和保藏具有重要意义。
IIa类细菌素通常含有37~48个氨基酸残基,并且拥有相似的序列,如表1所示,N端具有共同的YGNGVXaaC保守序列 (Xaa为出现频率高的残基),保守区含有2个半胱氨酸残基,可形成1个二硫键,研究表明此二硫键对抑制李斯特氏菌是必需的[15];序列的 C端只有 34%~80.5%的相似性。本研究中的NB-C1基因通过生物信息学方法从乳酸菌基因组数据库中筛选得到,与IIa类乳酸菌细菌素同源性较高,人工合成其成熟肽的全基因序列,并命名为NB-C1 (GenBank Accession No. HQ 015716)。NB-C1的成熟肽序列含有42个氨基酸残基,序列为KYYGNGVHCGKKTCYVDWGQATASIGKIIVNGW TQHGPWAHR。其N端保守区序列为YGNGVHC,且N端含有2个半胱氨酸,可形成1个二硫键,C端序列则与已知的 IIa类细菌素同源性较差。根据NB-C1氨基酸组成的特点,可推断其很可能为一种潜在的新型 IIa类细菌素基因。在抗菌肽重组表达研究中,为避免其对宿主的毒性作用,多采用融合表达方式[11-14,16-17]。我们曾将 NB-C1基因进行直接表达,但未能检测到目的蛋白及其活性,推测该细菌素对宿主可能具有一定的毒性作用,另外目的蛋白为约5 kDa的小肽,易被内源蛋白酶降解[18-19],稳定性较差,故本文尝试融合表达。本文以绿色荧光蛋白 (GFP) 作为融合载体蛋白,在大肠杆菌中进行融合表达并获得足够的活性重组蛋白GFP-NB-C1。这为 NB-C1生物学性质的进一步研究提供了物质基础,以及为新型 IIa类细菌素的发掘和研究提供了一种新的路径和方法。

表1 Ⅱa类乳酸菌细菌素的氨基酸序列分析[2]Table 1 Sequence alignment of class Ⅱ a bacteriocins[2]
1 材料与方法
1.1 菌株和质粒
T载体 pGM-T购自天根生化有限科技 (北京)公司;表达载体pIVEX 2.4d购自Roche公司;质粒pEGFP-C1由本实验室提供;表达菌株 Escherichia coli BL21(DE3) pLysS购自Stratagene公司;抑菌试验的指示菌单核细胞增生李斯特氏菌 Listeria monocytogenes,由江南大学食品学院姚卫蓉实验室提供。
1.2 主要试剂和仪器
DNA 聚合酶和 T4 DNA连接酶购自宝生物工程 (大连) 有限公司;限制性内切酶购自NEB公司;GeneRuler DNA Leader Mix Maker购自Fermentas公司;低分子量标准蛋白Marker购自国药集团化学试剂有限公司;三 (羟甲基) 氨基甲烷 (Tris)、N-[三(羟甲基) 甲基]甘氨酸 (Tricine)、质粒抽提试剂盒、氨苄青霉素以及氯霉素均购自上海生工生物工程有限公司;胶回收试剂盒购自北京索来宝科技有限公司;PCR仪购自Gene Technologies有限公司;电泳仪和凝胶成像系统购自BIO-RAD公司;引物由上海博尚公司合成;DNA测序由北京华大基因有限公司完成。
1.3 方法
常规分子生物学操作参照《分子克隆手册》[20]进行。
1.3.1 NB-C1的全基因合成
根据NB-C1基因序列设计寡核苷酸链,合成多条具有互补序列的引物 (表 2),然后通过重叠延伸PCR 技术反应合成其全基因序列 (GenBank Accession No. HQ 015716)。将NB-C1的成熟片段与pGM-T载体连接,构建克隆载体pGMT-NB-C1。

表2 NB-C1全基因合成的寡核苷酸片段引物Table 2 Primers of NB-C1 oligonucleotides for gene synthesis
1.3.2 融合表达载体的构建
根据pIVEX 2.4d质粒多克隆区的酶切位点进行引物设计,GFP和NB-C1的融合顺序为GFP-NB-C1,其N端为质粒自带的6×His标签编码序列。
以测序正确的pGMT-NB-C1为模板,利用表3中引物P1和P2进行PCR扩增,产物回收、纯化后进行 NcoⅠ/XmaⅠ双酶切,酶切产物连接至经同样酶切的pIVEX 2.4d载体,构建重组表达载体pIVEX 2.4d-NB-C1。同样,以pEGFP-C1为模板,利用P3和P4引物扩增GFP片段,经过NotⅠ/NcoⅠ酶切和连接反应,构建重组载体pIVEX 2.4d-GFP-NB-C1,转化E. coli DH5α感受态细胞,筛选阳性克隆,并进行PCR鉴定和酶切鉴定。将基因测序正确的重组质粒pIVEX 2.4d-GFP-NB-C1转化表达宿主E. coli BL21(DE3)pLysS,构建重组菌 BL21(DE3)pLysS/ pIVEX2.4d-GFP-NB-C1。

表3 NB-C1基因PCR扩增引物列表Table 3 PCR primers of NB-C1
1.3.3 重组蛋白的诱导表达和SDS-PAGE检测
将重组菌株 BL21(DE3)pLysS/pIVEX2.4d-GFPNB-C1划线培养,挑取单菌落接种于 LB (Luria-Bertani) 培养基中 (含100 mg/L氨苄青霉素和34 mg/L氯霉素),37 ℃振荡培养至OD600为0.6,加入IPTG至终浓度0.8 mmol/L,20 ℃、200 r/min诱导培养20 h。离心收集菌体并重悬于PBS缓冲液中 (0.1 mol/L,pH 8.0),在冰浴下进行超声破碎,离心得上清和沉淀。将全细胞、上清和沉淀样品进行SDS-PAGE检测,同时以质粒pIVEX2.4d转化的BL21(DE3)pLysS/pIVEX2.4d诱导表达产物作为空白对照。
1.3.4 融合蛋白GFP-NB-C1的纯化及鉴定
收集破碎上清液,通过0.45 μm滤膜过滤后,上样于5 mL的Ni-NTA亲和层析凝胶柱,首先采用10倍柱体积的清洗缓冲液 (20 mmol/L PBS,500 mmol/L NaCl,20 mmol/L咪唑,pH 8.0) 洗涤凝胶柱,再用洗脱缓冲液 (20 mmol/L PBS,500 mmol/L NaCl,150~300 mmol/L咪唑,pH 8.0) 梯度洗脱并收集,样品进行SDS-PAGE检测和Bradford法测定蛋白质浓度。
1.3.5 融合蛋白GFP-NB-C1的抑菌活性测定
采用固体平板扩散法测定融合蛋白GFP-NB-C1对单核细胞增生李斯特氏菌的抑菌活性。向培养皿中倒入约15 mL含有1.5%琼脂的FB (Fraser Broth Base) 培养基 (加有 1% 50 mg/mL柠檬酸铁铵溶液),将在FB液体培养基生长至对数中期的敏感菌按1%转接至5 mL 0.5%琼脂溶液中,迅速混匀,均匀铺在已凝固的平板培养基上,制备双层固体培养基,待凝固后小心放置5个牛津杯,然后分别加入100 μL PBS (pH 8.0) (阴性对照),以及不同浓度的GFP-NB-C1 (40、60、80、100 mg/L) 纯化样品。培养皿于4 ℃放置6 h后转移至37 ℃培养箱,培养12 h后观察抑菌圈情况。
2 结果
2.1 融合表达载体的构建和表达
将重组质粒 pIVEX 2.4d-GFP-NB-C1分别用NcoⅠ/XmaⅠ和 NotⅠ/NcoⅠ双酶切鉴定,得到150 bp和750 bp的目的条带,与预期结果一致 (图1)。DNA测序结果证明融合目标片段序列正确。重组菌BL21(DE3) pLysS/pIVEX2.4d-GFP-NB-C1进行IPTG诱导表达,表达产物进行SDS-PAGE分析,结果表明,在约32 kDa处有一条明显的目标蛋白条带 (图 2)。SDS-PAGE分析细胞破碎的上清和沉淀,表明 GFP-NB-C1融合蛋白主要以胞内可溶形式存在。
2.2 重组融合蛋白GFP-NB-C1的纯化和鉴定
SDS-PAGE分析蛋白质纯化样品,结果显示,目的条带大小为约32 kDa (图3)。Quantity one软件分析表明其纯度大于 95%。以 BSA为标准样品,Bradford法测定蛋白质浓度,结果表明经过一步纯化后,最终可获得36.1 mg/L纯化的GFP-NB-C1融合蛋白。

图1 质粒pIVEX 2.4d-GFP-NB-C1图示 (A) 及酶切鉴定电泳图 (B)Fig. 1 Schematic map of the recombinant plasmid pIVEX 2.4d-GFP-NB-C1 (A) and restriction analysis of the recombinant plasmid pIVEX 2.4d-GFP-NB-C1 (B). M: DNA marker; 1: pIVEX 2.4d-GFP-NB-C1 digested with Nco I/Xma I; 2: pIVEX 2.4d-GFP-NB-C1 digested with Not I/Nco I.

图2 GFP-NB-C1融合蛋白表达产物的SDS-PAGE分析Fig. 2 SDS-PAGE analysis of the fusion protein GFP-NB-C1. M: protein marker; 1: negative control; 2: whole proteins of cell lysate; 3: soluble fraction of cell lysate; 4: insoluble fraction of cell lysate.
2.3 重组融合蛋白GFP-NB-C1的活性鉴定
使用固体平板扩散法测定融合蛋白GFP-NB-C1对单核细胞增生李斯特氏菌的抑菌活性,结果如图4A所示,培养皿上出现明显的抑菌圈,表明GFP-NB-C1对敏感菌L. monocytogenes具有明显的抑制作用,并且抑菌圈直径与融合蛋白浓度具有一定的线性关系,如图4B。

图3 纯化后融合蛋白的SDS-PAGE分析Fig. 3 SDS-PAGE analysis of the purified GFP-NB-C1 fusion protein. M: protein marker; 1: purified GFP-NB-C1.
3 讨论
近年来虽然诸多学者通过融合方式表达了抗菌肽,但由于大多以包涵体形式存在[13,21],不利于后续的活性检测等工作。本文以 GFP为融合载体蛋白,在大肠杆菌中实现了重组蛋白的高效可溶表达,并且GFP的使用有助于对重组蛋白表达和纯化过程的实时监测。为了使融合蛋白以可溶的形式表达,本研究对表达条件进行了优化,最终确定表达条件为诱导前OD600为0.6,IPTG终浓度为0.8 mmol/L,20 ℃低温诱导20 h,目的蛋白以胞内可溶形式表达,避免了包涵体形成。
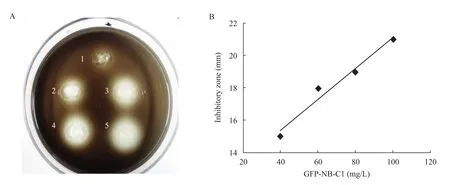
图4 不同浓度GFP-NB-C1融合蛋白对单核细胞增生李斯特菌的抑菌圈直径 (A) 及GFP-NB-C1浓度与抑菌圈直径曲线 (B)Fig. 4 Inhibitory zone evaluation of GFP-NB-C1 fusion protein at different concentration on the growth of L. monocytogenes (A) and the concentration-inhibitory zone curve (B). 1: negative control; 2: 40 mg/L GFP-NB-C1; 3: 60 mg/L GFP-NB-C1; 4: 80 mg/L GFP-NB-C1; 5: 100 mg/L GFP-NB-C1.
表达载体pIVEX 2.4d具有6个His组成的标签,所以重组蛋白可以通过Ni-NTA亲和层析凝胶柱纯化。为得到较纯的目的蛋白,洗脱时采用150~300 mmol/L咪唑梯度洗脱,当洗脱液中咪唑浓度为250 mmol/L和300 mmol/L时,目的蛋白被洗脱下,SDS-PAGE分析显示为单一条带。本研究中纯化条件温和,步骤简单,这均有利于蛋白活性的保持,并大大简化了纯化过程和降低了纯化难度,纯化后样品可直接用于活性检测。图 4表明目的蛋白对指示菌形成了明显的抑菌圈,而在其边界外还具有一层界限模糊的外圈,这可能是因为少量抑菌物质向平皿内部扩散后对边界周围的菌具有一定的抑制作用而形成,抑菌圈直径按照具有清晰边界的内圈进行计算。抑菌实验表明融合蛋白GFP-NB-C1对单核细胞增生李斯特氏菌具有较好的抑菌活性,说明经GFP融合后NB-C1保留了生物活性。
本文成功构建并表达了可溶性融合蛋白GFP-NB-C1,经一步纯化,可获得36.1 mg/L纯度大于95%的融合蛋白,为其生物学性质进行进一步的探讨奠定了基础。另外本研究建立了一条 IIa类细菌素从基因搜索、重组表达到获得活性蛋白的通路,这对新型细菌素的挖掘和研究提供了新的思路和借鉴。
[1] Jack RW, Tagg JR, Ray B. Bacteriocins of gram-positive bacteria. Microbiol Rev, 1995, 59(2): 171−200.
[2] Ennahar S, Sashihara T, Sonomoto K, et a1. Class IIa bacteriocins: biosynthesis, structure and activity. FEMS Microbiol Rev, 2000, 24(1): 85−106.
[3] Muriana PM, Klaenhammer TR. Purification and partial characterization of lactacin F, a bacteriocin produced by Lacobacillus acidophilus 11088. Appl Environ Microbiol, 1991, 57(1): 114−121.
[4] Hoskins J, Alborn Jr WE, Arnold J, et a1. Genome of the baeterium Streptococcus pneumoniaestrain R6. J Bacteriol, 2001, 183(19): 5709−5717.
[5] Saizieu AD, Gardes C, Flint N, et a1. Mieroarray-based identification of a novel Streptococcus pneumoniaeregulon controlled by an autoinduced peptide. Bacteriol, 2000, 182(17): 4696−4703.
[6] Nes IF, Johnsborg O. Exploration of antimicrobial potential in LAB by genomics. Curr Opin Biotechnol, 2004, 15(2): 100−104.
[7] Diep DB, Godager LD, Brede D, et al. Data mining and characterization of a novel pediocin-like bacteriocin system from the genome of Pediococcus pentosaceus ATCC 25745. Microbiology, 2006, 152: 1649−1659.
[8] Axelsson L, Katle T, Mslett MB, et al. A system for heterologous expression of bacteriocins in Lactobacillus sake. FEMS Microbiol Lett, 1998, l68(1): 137−143.
[9] Biet F, Berjeaud JM, Worobo RW, et a1. Heterologous expression of the baeteriocin mesentericin Y105 using the dedicated transport system and the general secretion pathway. Microbiology, 1998, 144(10): 2845−2854.
[10] Kawai Y, Arakawa K, Itoh A, et a1. Heterologous expression of gasserlcin A, a bacteriocin produced by Lactobacillus gasseri LA39. Anim Sci J, 2003, 74(1): 45−51.
[11] Moon GS, Pyun YR, Kim WJ. Expression and purification of a fusion-typed pediocin PA-1 in Escherichia coli and recovery of biologically active pediocin PA-1. Int J Food Microbiol, 2006, 108(1): 136−140.
[12] Beaulieu L, Tolkatchev D, Jetté JF, et a1. Production of active pediocin PA-1 in Escherichia coli using a thioredoxin gene fusion expression approach: cloning, expression, purification, and characterization. Can J Microbiol, 2007, 53(11): 1246−1258.
[13] Lu HR, Li GD, Wu HY, et al. Fusion expression of antimicrobial peptide GK1 in Escherichia coli. Chin J Biotech, 2008, 24(1): 21−26.陆海荣, 李国栋, 吴宏宇, 等. 抗菌肽GK1在大肠杆菌中的融合表达. 生物工程学报, 2008, 24(1): 21−26.
[14] Chen HQ, Fan LM, Xu ZN, et al. Efficient production of soluble human beta-defensin-3-4 fusion proteins in Escherichia coli cell-free system. Process Biochem, 2007, 42(3): 423−428.
[15] Drider D, Fimland G, Héchard Y, et al. The continuing story of class IIa bacteriocins. Microbiol Mol Biol Rev, 2006, 70(2): 564−582.
[16] Klocke M, Mundt K, Idler F, et a1. Heterologous expression of enterocin A, a bacteriocin from Enterococcus faecium, fused to a cellulose-binding domain in Escherichia coli results in a functional protein with inhibitory activity against Listeria. Appl Microbiol Biot, 2005, 67(4): 532−538.
[17] Chen HQ, Xu ZN, Xu NZ, et a1. Efficient production of a soluble fusion protein containing human beta-defensin-2 in E. coli cell-free system. J Biotechnol, 2005, 115(3): 307−315.
[18] Valore EV, Ganz T. Laboratory production of antimicrobial peptides in native conformation. Methods Mol Biol, 1997(78): 115−131.
[19] Piers KL, Brown MH, Hancock REW. Recombinant DNA procedures for producing small antimicrobial cationic peptides in bacteria. Gene, 1993, 134(1): 7−13.
[20] Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. 3rd ed. Beijing: Cold Spring Harbor Laboratory Press, 2001.
[21] Barrell PJ, Liew OW, Conner AJ. Expressing an antibacterial protein in bacteria for raising antibodies. Protein Expr Purif, 2004, 33(1): 153−159.
Expression and characterization of a new class IIa bacteriocin
Yan Xie, Haiqin Chen, Qiuxiang Zhang, Fengwei Tian, Yongquan Chen, Hao Zhang, and Wei Chen
School of Food Science and Technology, Jiangnan University, Wuxi 214122, China
NB-C1 gene is a potential class IIa bacteriocin gene. To obtain its soluble expression, NB-C1 was fused with the green fluorescent protein (GFP) gene and a recombinant expression vector pIVEX 2.4d-GFP-NB-C1 was constructed, which was transformed into Escherichia coli BL21(DE3) pLysS. The expressed fusion protein GFP-NB-C1 was purified by Ni-NTA affinity chromatography and the bioactivity was examined using Listeria monocytogenes as the indicator bacteria. The results showed that the expressed fusion protein GFP-NB-C1 was soluble and the final concentration of the purified fusion protein was 36.1 mg/L E. coli culture and had the purity above 95%. The antimicrobial assay of GFP-NB-C1 was analyzed and showed its high activity against Listeria monocytogenes.
class IIa bacteriocin, fusion expression, protein purification, activity identification
细菌素 (Bacteriocin) 是某些细菌产生的具有抗菌活性的多肽、蛋白质或蛋白质复合物,一般只对亲缘关系较近的细菌有毒害作用。产生菌对其产生的细菌素具自身免疫性[1]。很多微生物均可产生细菌素,其中乳酸菌细菌素研究得最为深入。IIa类细菌素是乳酸菌细菌素的一个亚类,为抗李斯特氏菌的多肽。近年来世界范围内发生多起由单核细胞增生李斯特氏菌引起的中毒事件,具有很大的危害性,预防和控制食品中的李斯特氏菌则成为了人们关注的热点,而IIa类细菌素对李斯特氏菌具有特异的抗菌活性,并且还具有安全性、酶稳定性、热稳定性、免疫性等优点[2],因此在食品领域具有很好的应用前景。但目前仅有几个细菌素在食品和生物药物领域中得到应用,因此从乳酸菌天然资源中挖掘更多高效的细菌素已成为研究热点。
September 6, 2010; Accepted: January 26, 2011
Supported by: National Natural Science Foundation of China (Nos. 20706023, 20836003).
Wei Chen. Tel/Fax: +86-510-85912155; E-mail: weichen@jiangnan.edu.cn
国家自然科学基金 (Nos. 20706023, 20836003) 资助。
