过量表达苹果酸脱氢酶对大肠杆菌NZN111产丁二酸的影响
2011-02-09梁丽亚马江锋刘嵘明王光明徐冰张敏姜岷
梁丽亚,马江锋,刘嵘明,王光明,徐冰,张敏,姜岷
南京工业大学 生物与制药工程学院 材料化学工程国家重点实验室,南京 210009
丁二酸 (又称琥珀酸),被广泛应用于医药、农药、染料、香料、油漆、食品和塑料等行业,作为C4平台化合物,可用于合成1,4-丁二醇、四氢呋喃、γ-丁内酯等有机化学品以及聚丁二酸丁二醇酯(PBS) 类生物可降解材料,被美国能源部认为是未来 12种最有价值的生物炼制产品之一[1-2]。利用微生物发酵法转化可再生资源生产丁二酸,价格低廉、污染小,且在发酵过程中可吸收固定 CO2,开辟了温室气体利用的新途径,近年来成为研究的热点。
丁二酸的生产菌株很多,目前研究的热点主要集中在产琥珀酸厌氧螺菌 Anaerobiospirillum succiniciproducens[3]、产琥珀酸放线杆菌Actinobacillus succinogenes[4]、产琥珀酸曼氏杆菌 Mannheimia succiniciproducens[5]和重组大肠杆菌 Escherichia coli[6-7]。利用野生菌株生产丁二酸虽然获得了较高的产物浓度,但培养基成本较高,且甲酸、乙酸等副产物积累较多,阻碍了其工业化进程。大肠杆菌由于遗传背景清楚、易操作、易调控、培养基要求简单和生长迅速等优点,近年来被广泛用于研究以获得产丁二酸优秀菌株。图1是大肠杆菌的厌氧混合酸发酵途径[8]。产丁二酸大肠杆菌基因改造策略主要有:增强代谢途径中的关键酶 (如PPC)、失活或敲除竞争途径中的酶 (如LDH、PFL)、引入新的代谢途径 (如乙醛酸循环) 等[9]。

图1 大肠杆菌厌氧混合酸发酵途径[8]Fig. 1 Pathways of anaerobic mixed acid fermentation for Escherichia coli[8].
大肠杆菌 NZN111由于缺乏了乳酸脱氢酶的编码基因 (ldhA) 和丙酮酸-甲酸裂解酶的编码基因(pflB) 而使副产物乳酸和甲酸的生产途径阻断,具有潜在生产丁二酸的能力。但同时由于NADH依赖的乳酸脱氢酶 (LDH) 无法合成而限制了糖酵解过程中形成的NADH再生为NAD+的过程,造成辅酶不平衡,导致该菌株厌氧条件下不能利用葡萄糖进行生长。其中 Stols和 Donnelly[10-11]将大肠杆菌中NAD+依赖的苹果酸酶过量表达于E. coli NZN111后可以进行丁二酸的厌氧发酵,初始20 g/L葡萄糖产生12.8 g/L丁二酸,转化率达到64%,本实验是通过过量表达另一个 NAD+依赖的苹果酸脱氢酶使重组菌恢复了厌氧条件下代谢葡萄糖的能力,且通过测定细胞干重及辅酶NAD(H) 的含量从而验证了辅酶不平衡导致E. coli NZN111无法代谢葡萄糖的假设。Hong和Lee选择还原性糖山梨醇作为碳源,当以CO2为气相时,20 g/L山梨醇发酵产生10 g/L丁二酸,转化率达到50%[12-13]。
苹果酸脱氢酶 (MDH) 在厌氧条件下主要催化草酰乙酸 (OAA) 到苹果酸 (Malate) 的反应过程,该过程伴随着 1分子的 NADH再生为一分子的NAD+,在E. coli NZN111中过量表达该基因将有利于NADH再生为NAD+,从而维持该菌株胞内的辅酶平衡,恢复其在厌氧条件下的生长及耗糖能力,促进丁二酸的合成。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌DH5α由本实验室保藏;质粒pTrc99a由南京师范大学邵蔚蓝教授惠赠;E. coli NZN111 (ldhA::Kan Pfl::cam) 由南伊利诺伊卡本代尔大学Clark教授惠赠,作为宿主菌和对照菌。
1.1.2 主要试剂
氨苄青霉素、氯霉素、硫酸卡那霉素,购自上海生工生物工程有限公司;基因组提取试剂盒和琼脂糖凝胶 DNA回收试剂盒购自北京天根生化科技有限公司;质粒小量快速提取试剂盒为上海申能博彩生物科技有限公司产品;DNA片段回收试剂盒、限制性内切酶、Pyrobest DNA聚合酶和T4 DNA连接酶为大连宝生物有限公司产品;酵母提取物和胰蛋白胨为 Oxoid公司产品;CO2气体购自南京上元工业气体厂;发酵罐购自美国NBS公司BIOFLO110系列7 L发酵罐。其他试剂为国产分析纯。
1.2 方法
1.2.1 mdh基因的克隆
引物设计:参照MDH基因序列 (来源于E. coli K12 基因组,Gene Accession No. ECK3225) 设计,由上海申能博彩生物科技有限公司合成。分别在上下游引物的 5′端引入了 EcoRⅠ和 HindⅢ限制性酶切位点 (下划线标示),引物序列如下:Forward (5′−3′):GGAATTC ACACATTCTTGAGATGTGGTC ATT;Reverse (5′−3′):CCCAAGCTT AATATCCGGC AACCAATTAAGTC。PCR反应体系:上下游引物(50 pmol/μL) 各1 μL;模板DNA (100 ng/μL) 0.5 μL;l0倍缓冲液5 μL;dNTPs (10 mmol/L) 1 μL;DNA聚合酶 (2.5 U/μL) 1 μL;ddH2O 38.5 μL,总体积50 μL。反应条件:94 ℃ 5 min ;94 ℃ 45 s,55 ℃45 s,72 ℃ 1 min ,35个循环;72 ℃ 10 min。
1.2.2 重组质粒的构建
将纯化后的mdh基因片段以及质粒pTrc99a进行EcoRⅠ和HindⅢ双酶切反应,把双酶切后得到的片段在T4 DNA连接酶的作用下16 ℃连接过夜,构建重组质粒pTrc99a-mdh并转化于E. coli NZN111中。涂布含氯霉素、硫酸卡那霉素和氨苄青霉素平板后挑选抗性克隆,提取质粒后进行HindⅢ单酶切及EcoRⅠ和HindⅢ的双酶切鉴定。
1.2.3 重组苹果酸脱氢酶的诱导表达
菌体转化:CaCl2法[14]。有氧诱导:37 ℃、200 r/min培养菌体到OD600约0.6左右,加入IPTG至终浓度为0.3 mmol/L,30 ℃、170 r/min诱导8 h。
1.2.4 酶活检测
样品处理:采取超3 s停5 s的策略共超声破碎3 min,4 ℃、12 000 r/min离心15 min,取上清即粗酶液,测定酶活并进行SDS-PAGE分析。
总蛋白浓度测定按照 Bradford法[15],以 BSA (牛血清白蛋白) 为标准。
标准反应体系如下[16]:0.1 mol/L Tris-HCl (pH 8.8),0.2 mmol/L的NADH,2 mmol/L的草酰乙酸。30 ℃连续监测340 nm处吸光值的变化,根据测定的标准曲线换算成底物浓度。
酶活定义为:30 ℃时1 min内催化1 μmol的草酰乙酸转化为苹果酸所需要的酶量,即1 U。比酶活定义为每毫克蛋白含有的酶活 (U/mg)。
1.2.5 辅酶NADH与NAD+浓度的测定
[17]方法:反应时依次添加 150 μL上述的细胞提取液、0.9 mL的纯水、1.8 mL的混合反应液 (等体积的1.0 mol/L Bicine buffer、纯乙醇、40 mmol/L EDTA、4.2 mmol/L MTT和双倍体积的16.6 mmol/L PES混合,30 ℃水浴10 min) 和150 μL的乙醇脱氢酶 (500 U/mL),迅速混匀后,测定波长570 nm处的吸光度值A570,将A570随时间变化曲线斜率带到标准曲线,得到待测样品中NADH与NAD+的浓度。
1.2.6 培养基及培养条件
LB培养基:酵母粉5 g/L,蛋白胨10 g/L,氯化钠5 g/L,pH 7.0,氯霉素、硫酸卡那霉素和氨苄青霉素的终浓度分别为25、30、100 μg/mL。
30 mL LB液体培养基,添加0.48 g碱式碳酸镁,20 g/L葡萄糖,抗生素添加同有氧培养,添加终浓度为0.3 mmol/L的诱导剂IPTG (异丙基-β-D-硫代半乳糖苷) 以诱导表达MDH。
3 L发酵液组成:LB培养基,好氧培养阶段添加抗生素浓度同上,5 mol/L NaOH外源流加调节pH值至7.0,根据需要补加葡萄糖。厌氧发酵阶段采用分批补料的方式补加葡萄糖,并加入灭过菌的碱式碳酸镁内源调节pH值为6.80。
1.2.7 培养方法
有氧摇瓶培养:将保存于−80 ℃的菌种在加有相应抗生素的平板上活化,挑单菌落到5 mL LB试管,37 ℃、200 r/min培养10 h,1%接种量接种到好氧培养基中,37 ℃、200 r/min培养6 h。
厌氧血清瓶发酵:转接 10%的菌液到血清瓶中,通入过滤除菌后的CO2气体2 min,保证血清瓶中为厌氧环境,厌氧发酵30 ℃、170 r/min,发酵周期48 h。
7 L发酵罐两阶段发酵:在发酵罐上采用的是先在有氧条件下通入无菌空气来培养菌体,37 ℃、500 r/min振荡培养,初始葡萄糖浓度为10 g/L,当葡萄糖几乎耗尽时开始以低流速2.0 g/(L·h) 流加600 g/L的葡萄糖,当OD600达到16左右时,以0.5 L/min的流速通入CO2气体,37 ℃,200 r/min,补加葡萄糖,使厌氧起始葡萄糖浓度为15 g/L左右,并加入48 g灭菌后的碱式碳酸镁。
1.2.8 发酵及代谢物分析
细胞生长是用紫外可见分光光度计于波长600 nm处测定吸光度值,细胞干重 (DCW) 是由DCW与OD600测定的标准曲线换算得到,换算公式为:DCW (g/L)=0.4×OD600。培养基中的葡萄糖用生物传感仪 (SBA40C) (生产厂家是山东省科学院生物研究所) 检测,有机酸用高效液相色谱法(HPLC) 检测,色谱柱为Prevail Organic Acid,流动相为25 mmol/L KH2PO4,pH 2.5,流速1.0 mL/min,紫外检测波长215 nm。
2 结果与分析
2.1 苹果酸脱氢酶 (MDH) 的克隆与表达
将 PCR扩增后的目的基因片段 mdh和载体pTrc99a分别进行EcoRⅠ/HindⅢ双酶切 (图2),酶切产物纯化后用T4 DNA连接酶连接,构建表达载体pTrc99a-mdh。

图2 质粒pTrc99a和mdh的双酶切鉴定Fig. 2 Identification of pTrc99a and mdh by restriction endonuclease digestion. M: DNA marker; 1: pTrc99a digested with EcoR I and Hind III (4 125 bp); 2: mdh digested with EcoR I and Hind III (939 bp).
重组质粒经单、双酶切鉴定 (图 3),结果与预期一致。进行测序后发现目的基因序列与公布的序列100%匹配。
2.2 MDH酶活测定
37 ℃、200 r/min培养菌体到OD600=0.6,加入IPTG至终浓度为0.3 mmol/L,30 ℃、170 r/min诱导 8 h后对出发菌株和构建的重组菌株进行粗酶液的相应酶活测定,计算出粗酶液的比酶活,结果如表1所示。
由表 1可知:重组菌苹果酸脱氢酶比酶活最高为39.84 U/mg,而对应的受体菌仅为3.112 U/mg,重组菌的比酶活提高了 11.8倍,E. coli NZN111/ pTrc99a的比酶活为3.074 U/mg,重组菌的比酶活提高了12倍,可见重组菌中的苹果酸脱氢酶基因得到了过量表达。

图3 重组质粒pTrc99a-mdh的酶切鉴定Fig. 3 Identification of pTrc99a-mdh by enzyme digestion. M: DNA marker; 1,2: pTrc99a-mdh digested with Hind III; 3,4: pTrc99a-mdh digested with EcoR I and Hind III.
2.3 厌氧摇瓶发酵
有氧培养菌液10%转接厌氧血清瓶,48 h后测定细胞干重、MDH的酶活及辅酶NAD+/NADH的量,并测定残糖及有机酸的含量。结果如表2所示。
由表 2可知,过量表达苹果酸脱氢酶恢复了厌氧条件下E. coli NZN111的生长,重组菌细胞干重是对照菌的 3.8倍,在一定程度上也恢复了出发菌株代谢葡萄糖的能力,48 h内可以消耗10 g/L的葡萄糖,产2.5 g/L的丁二酸,而对照菌几乎没有丁二酸生成。MDH比酶活提高了14.8倍。辅酶 NAD+与NADH的总量提高了2倍,NADH/NAD+的比例由0.64降低为0.30。

表1 对照菌与重组菌的蛋白浓度、MDH酶活及比酶活Table 1 Concentration of protein, enzyme activity and specific enzyme activity of MDH in the control strain and in the recombinant strain
厌氧摇瓶分别于18 h、28 h和48 h结束培养,分别测定细胞干重 (DCW)、耗糖及 NAD(H) 的含量,进而计算NADH/NAD+,结果如图4所示。
由图4可以看出18 h时重组菌E. coli NZN111/ pTrc99a-mdh与对照菌E. coli NZN111的DCW均未有所增加,两者均未耗糖,NADH/NAD+均为 0.65左右。发酵28 h和48 h后,E. coli NZN111/pTrc99amdh的DCW比对照菌分别提高了1.2倍和1.8倍,耗糖分别提高了2倍和7倍,说明过量表达苹果酸脱氢酶恢复了E. coli NZN111厌氧条件下的生长及耗糖能力。图 4C显示,28 h和 48 h时 E. coli NZN111/pTrc99a-mdh NADH/NAD+分别为 0.26和0.33,而对照菌NADH/NAD+均为0.76,说明过量表达苹果酸脱氢酶使NADH氧化为NAD+,恢复了氧化还原平衡,从而恢复了其厌氧条件下的生长及耗糖能力。

表2 厌氧血清瓶培养后各种参数的测定结果Table 2 Results of these parameters on anaerobic fermentation in sealed bottles

图4 不同时间E. coli NZN111/pTrc99a-mdh与E. coli NZN111细胞干重 (A)、耗糖 (B) 和NADH/NAD+ (C) 的比较Fig. 4 Comparision of DCW (A), consumed glucose (B) and NADH/NAD+ (C) between E. coli NZN111/pTrc99a-mdh and E. coli NZN111 at different time. DCW: dry cell weight.
2.4 两阶段发酵
有氧培养可快速提高菌体密度,从而提高发酵过程的生产强度,本研究将重组菌株先有氧培养至细胞干重达到6.4 g/L,然后通入CO2转成厌氧发酵状态,并加入终浓度为0.3 mmol/L的IPTG。每隔2小时取样测 OD600、残糖并留样测有机酸含量 (图5)。转厌氧后15 h,葡萄糖消耗为14.75 g/L,丁二酸浓度达到15.18 g/L,丁二酸的得率为1.03 g/g葡萄糖,丁二酸的生产强度为1.012 g/(L·h)。
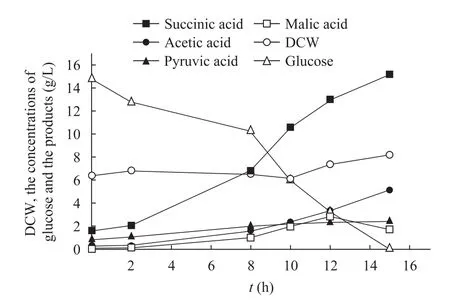
图5 E. coli NZN111/pTrc99a-mdh在7 L发酵罐中转厌氧发酵阶段的细胞干重 (DCW)、葡萄糖及产物浓度Fig. 5 DCW, the concentrations of glucose and the organic acids in E. coli NZN111/pTrc99a-mdh after transition to anaerobic-phase fermentation in a 7 L fermentor. DCW: dry cell weight.
3 讨论
本研究构建了重组大肠杆菌 NZN111/pTrc99amdh,有氧诱导时比酶活比对照菌提高了 11.8倍。厌氧摇瓶发酵过程中通过添加终浓度为0.3 mmol/L的 IPTG诱导使苹果酸脱氢酶在大肠杆菌 NZN111胞内得到过量表达,苹果酸脱氢酶 (MDH) 酶活较对照菌提高了14.8倍,NADH/NAD+的比例从0.64减少到0.26,同时NADH与NAD+的总量提高了2倍,恢复了厌氧条件下E. coli NZN111的生长及耗糖能力。通过两阶段发酵,厌氧发酵阶段,15 h内葡萄糖消耗为14.75 g/L,丁二酸浓度达到15.18 g/L,丁二酸的得率为1.03 g/g葡萄糖,丁二酸的生产强度为1.012 g/(L·h)。与国内外有关大肠杆菌NZN111研究报道的发酵结果相比,通过过量表达苹果酸脱氢酶后进行两阶段发酵,丁二酸的得率及丁二酸的生产强度都有很大提高,为丁二酸的工业化生产提供了一个新的平台。
REFERENCES
[1] Wang QZ, Wu W, Zhao XM. Market analysis for bioconversion of succinic acid and its derivatives. Chem Ind Eng Prog, 2004, 23(7): 794−798.王庆昭, 吴巍, 赵学明. 生物转化法制取琥珀酸及其衍生物的前景分析. 化工进展, 2004, 23(7): 794−798.
[2] Zhan XB, Zhun YH, Wang DH. Succinic acid production and potential market. Food Sci Technol, 2003, 2: 44−49.詹晓北, 朱一晖, 王东海. 琥珀酸发酵生产工艺及其产品市场. 食品科技, 2003(2): 44−49.
[3] Lee PC, Lee SY, Hong SH, et al. Biological conversion of wood hydrolysate to succinic acid by Anaerobiospirillum succiniciproducens. Biotechnol Lett, 2003, 25(2): 111−114.
[4] McKinlay JB, Zeikus JG, Vieille C. Insights into Actinobacillus succinogenes fermentative metabolism in a chemically defined growth medium. Appl Environ Microb, 2005, 71(11): 6651−6656.
[5] Lee JW, Lee SY, Song H, et al. The proteome of Mannheimia succiniciproducens, a capnophilic rumen bacterium. Proteomics, 2006, 6(12): 3550−3556.
[6] Jiang M, Liu SW, Ma JF, et al. Effect of growth phase feeding strategies on succinate production by metabolically engineered E. coli. Appl Environ Microb, 2010, 76(4): 1298−1300.
[7] Ma JF, Jiang M, Chen KQ, et al. Succinic acid production with metabolically engineered E. coli recovered from two-stage fermentation. Biotech Lett, 2010, 32(10): 1413−1418.
[8] Clark DP. The fermentation pathways of Escherichia coli. FEMS Microbiol Rev, 1989, 63(3): 223−234.
[9] Jiang M, Ma JF, Chen KQ, et al. The progress of recombinant Escherichia coli for production of succinic acid. Microbiol China, 2009, 36(1): 120−124.姜岷, 马江锋, 陈可泉, 等. 重组大肠杆菌产琥珀酸研究进展. 微生物学通报, 2009, 36(1): 120−124.
[10] Stols L, Donnelly MI. Expression of ascarissuum malic enzyme in a mutant Escherichia coli allows production of succinic acid from glucose. Appl Biochem Biotech, 1997, 65(1): 153−158.
[11] Stols L, Donnelly MI. Production of succinic acid through overexpression of NAD+- dependant malic enzyme in an Escherichia coli mutant. Appl Environ Microb, 1997, 63(7): 2695−2700.
[12] Hong SH, Lee SY. Metabolic flux analysis for succinic acid production by recombinant Escherichia coli with amplified malic enzyme activity. Biotechnol Bioeng, 2001, 74(2): 89−95.
[13] Hong S, Lee S. Importance of redox balance on the production of succinic acid by metabolically engineered Escherichia coli. Appl Microbiol Biotechnol, 2002, 58(3): 286−290.
[14] Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. 3rd ed. New York: Cold Spring Harbor Laboratory Press, 2001: 24−25.
[15] Ausubel FM, Brent R, Kingston RE, et al. Short Protocols in Molecular Biology. Beijing: Science Press, 1998: 240−251.
[16] Boernke WE, Millard CS, Stevens PW, et al. Stringency of substrate specificity of Escherichia coli malate dehydrogenase. Acta Biochim Biophy, 1995, 332(1): 43−52.
[17] Li J, Chen KQ, Huang XM, et al. Establishment of the determination of NAD+and NADH in the anaerobic fermentation of organic acids. Food Sci Technol, 2008, 33(12): 254−257.李建, 陈可泉, 黄秀梅, 等. 厌氧发酵有机酸体系中NAD+和 NADH 测定方法的建立. 食品科技, 2008, 33(12): 254−257.
