快速鉴定格尔德霉素产生菌——吸水链霉菌17997中的洋橄榄叶素
2011-02-09李书芬武临专陈菲菲王红远孙桂芝王以光
李书芬,武临专,陈菲菲,2,王红远,孙桂芝,王以光
1 中国医学科学院/北京协和医学院 医药生物技术研究所 卫生部抗生素生物工程重点实验室,北京 100050
2 中国医药集团四川抗菌素工业研究所,成都 610052
在对格尔德霉素 (Geldanamycin,GDM;一种苯醌型安莎类抗生素) 产生菌吸水链霉菌Streptomyces hygroscopicus 17997的次级代谢产物进行研究时,发现其发酵上清液具有抗革兰阳性菌活性[1]。格尔德霉素具有抗真菌活性,但不具有抗革兰阳性菌活性。萘安莎类抗生素如利福霉素(Rifamycin)、萘霉素 (Naphthomycin) 和红迪菌素(Rubradirin) 等,具有显著的抗革兰阳性菌活性。在吸水链霉菌17997的基因组DNA中存在可能负责萘安莎类抗生素生物合成的基因[1-3],因而曾经推测该菌株具有萘安莎类抗生素产生潜能,但是该推测始终没有得到证实。
本研究对吸水链霉菌 17997产生的一个具有抗革兰阳性菌活性化合物进行了快速鉴定,确证为洋橄榄叶素 (Elaiophylin;又称阿沙霉素B,azalomycin B;化学结构见图1),具体报道如下。

图1 洋橄榄叶素化学结构Fig. 1 Chemical structure of elaiophylin.
1 材料与方法
1.1 材料
菌种:吸水链霉菌17997,GDM产生菌;枯草芽胞杆菌 63501,革兰阳性检定菌;上述菌株均为本实验室保藏。
培养基:ISP2培养基:酵母提取物0.4%,麦芽提取物1.0%,葡萄糖0.4%,琼脂粉1.8%。液体发酵培养基:淀粉2%,棉子饼粉0.5%,葡萄糖0.5%,玉米浆1.0%,酵母粉0.5%,CaCO30.2%。生物检定培养基:蛋白胨0.6%,牛肉膏0.3%,酵母膏0.3%,葡萄糖0.1%,琼脂1.2%,pH 7.2。
试剂:酵母提取物 (Yeast extract)、麦芽提取物 (Malt extract),英国Oxoid公司产品,葡萄糖为国产分析纯试剂。TLC硅胶板 (GF254),山东烟台吉德精细化工有限公司或青岛海洋化工分厂产品。乙酸乙酯 (EtOAc)、甲醇、二氯甲烷、环己烷等有机溶剂为北京化工厂分析纯试剂。洋橄榄叶素对照品由中国科学院成都生物研究所李国友博士惠赠[4],以及澳大利亚 Bioaustralis 公司产品。PCR引物及相关试剂由宝生物工程 (大连) 有限公司合成或提供。
1.2 方法
吸水链霉菌 17997的培养与发酵:新鲜的吸水链霉菌 17997孢子斜面 (ISP2培养基,28 ℃培养7~10 d,挖块接种于液体发酵培养基,28 ℃振荡(200 r/min) 培养48~96 h。发酵液离心后,弃沉淀;发酵上清液用于乙酸乙酯 (EtOAc) 提取分析等。
EtOAc提取:取吸水链霉菌17997发酵上清液25 mL,用等体积EtOAc萃取,倾出EtOAc萃取液,室温吹干,复溶于约0.5 mL EtOAc中。
硅胶板TLC分离检测以及NaOH显色:取上述20 μL EtOAc提取物浓缩液,硅胶板TLC初步分离,在EtOAc∶二氯甲烷∶正己烷∶甲醇 (9∶6∶6∶2,V/V/V/V) 溶媒系统中展开后,用2.0 mol/L NaOH溶液喷涂 (一种针对格尔德霉素及其生物合成类似物的显色方法[5]),照相记录。
抗革兰阳性菌活性检测:将上述 TLC硅胶板(没有用NaOH溶液喷涂显色) 贴到含枯草芽胞杆菌63501的生物检定培养基平板上约1 min,揭去硅胶板,将平板置于37 ℃培养16 h,平板上透明带对应的硅胶板条带含有抗革兰阳性菌活性化合物。
HPLC和LC-MS:将硅胶板上含有抗菌活性化合物的条带用EtOAc洗脱下来后,吹干,复溶于少量甲醇中,进行HPLC和LC-MS分析。HPLC分析:Dikma Diamonsil C18反相色谱柱,(5 μm,150 mm× 4.6 mm);20%~100%甲醇梯度洗脱,30 min;流速1 mL/min;检测波长256 nm。LC-MS分析:Agilent 1200液相色谱系统与 Applied Biosystems/MSD SCIEX (Concord,Ont,Canada) 公司的Qstar LC-MS质谱仪联用,配有Turbo Ionspray离子化源。液相色谱条件同HPLC。质谱检测条件:喷雾电压5.5 kV;温度450 ℃;解簇电压80 V;雾化气40相对单位,辅助气30相对单位,均为氮气;全扫描监测,正离子方式,质荷比 (m/z) 范围为 100~1 300;采用信息依赖扫描模式获得二级质谱;碰撞压力设为高;碰撞能量为50eV。
dTDP-葡萄糖-4,6-脱水酶基因保守区的 PCR扩增:上游引物P1序列5′-GSGGSGSSGCSGGSTTC ATSGG-3′,下游引物P2序列5′-GGGWRCTGGYRS GGSCCGTAGTTG-3′[6];其中,R=A/G,W=A/T,Y=C/T,S=C/G。吸水链霉菌17997总DNA (PCR模板) 提取,微波法[7];使用宝生物工程 (大连) 有限公司Taq LA聚合酶、GC Buffer I进行PCR,PCR主要参数为:96 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1 min,30个循环。
2 结果与讨论
2.1 抗菌活性化合物的HPLC分析
在对吸水链霉菌 17997次级代谢产物分析时,发现一条在TLC硅胶板上用NaOH溶液喷涂显红色的条带 (图 2)。抗菌活性分析显示:该红色条带所对应的化合物 (未显色) 具有抗革兰阳性菌活性。将该条带所含化合物从硅胶板上洗脱下来后进行HPLC分析,出现一个显著的洗脱峰,其紫外吸收峰形与保留时间均与文献报道的洋橄榄叶素基本一致[8-9]。有报道在格尔德霉素产生菌的次级代谢产物中发现洋橄榄叶素[9-10]。
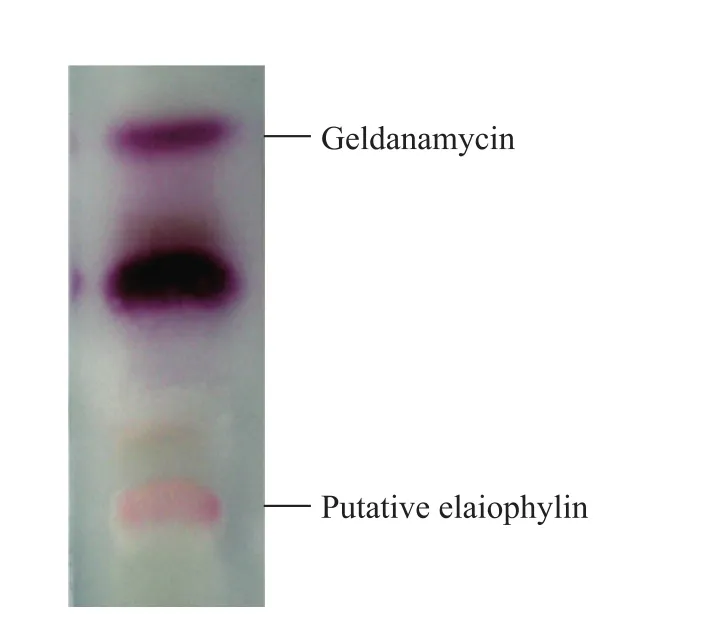
图2 吸水链霉菌 17997发酵液乙酸乙酯提取物经 TLC硅胶板分离后用2.0 mol/L NaOH溶液喷涂显色结果Fig. 2 Color reaction by spraying 2.0 mol/L NaOH onto the TLC silica gel of EtOAc extract of the fermentation supernatant of Streptomyces hygroscopicus 17997.
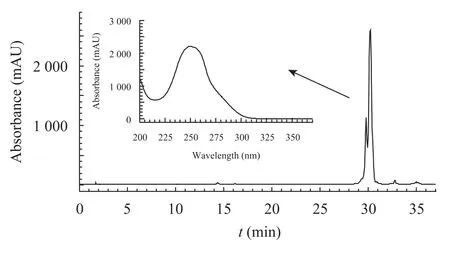
图3 吸水链霉菌17997所产生的抗革兰阳性菌活性化合物的HPLC谱图Fig. 3 HPLC profile of the compound with anti-Gram positive bacteria activity from Streptomyces hygroscopicus 17997.
对吸水链霉菌17997菌丝体用丙酮浸泡提取和分析后,发现更多的NaOH溶液喷涂显红色化合物,这与洋橄榄叶素作为次级代谢产物主要存在于菌丝体内的报道相符合[11]。将该化合物与洋橄榄叶素对照品混和后进行HPLC分析,二者的保留时间和紫外吸收峰形一致;洋橄榄叶素对照品在TLC硅胶板上用NaOH溶液喷涂显示相同的红色。因此,该化合物很可能是洋橄榄叶素。
2.2 吸水链霉菌17997基因组DNA含有洋橄榄叶素dTDP-葡萄糖-4,6-脱水酶 (Tgd) 基因
洋橄榄叶素化学结构中含有 2-脱氧-L-岩藻糖(2-deoxy-L-fucose) 组分。已知葡萄糖通过磷酸化、dTDP化、脱水、还原、差向异构化等反应生成 2-脱氧-L-岩藻糖,再经糖基转移酶催化进入到洋橄榄叶素分子中;2-脱氧-L-岩藻糖的生物合成需要Tgd[12]。采用tgd基因保守区设计的引物,以吸水链霉菌17997基因组DNA为模板,PCR得到一条预计大小 (约0.6 kb) 的特异性DNA条带 (图4)。对该 DNA条带进行测序 (GenBank Accession No. HQ260658),它所编码的氨基酸序列,与美国专利US 7595187报道的洋橄榄叶素生物合成基因簇中dTDP-葡萄糖-4,6-脱水酶基因 (EMBL Accession No. GP697132) 保守区编码氨基酸序列几乎完全相同 (Identities=154/158 (97%),Positives=156/158 (98%),Gaps=1/158 (0%))[13],从而确证PCR扩增的 DNA片段属于洋橄榄叶素生物合成基因簇中的tgd基因保守区。吸水链霉菌17997中存在洋橄榄叶素tgd基因,提示其具有产生洋橄榄叶素的遗传基础。
2.3 抗菌活性化合物与洋橄榄叶素具有相同的LC-MS谱
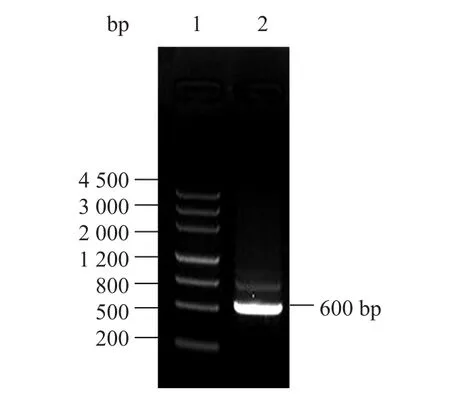
图4 PCR扩增吸水链霉菌17997中的tgd保守区Fig. 4 PCR amplification of the conserved region of tgd from Streptomyces hygroscopicus 17997. 1: DNA marker; 2: the conserved region of tgd (600 bp) from Streptomyces hygroscopicus 17997.
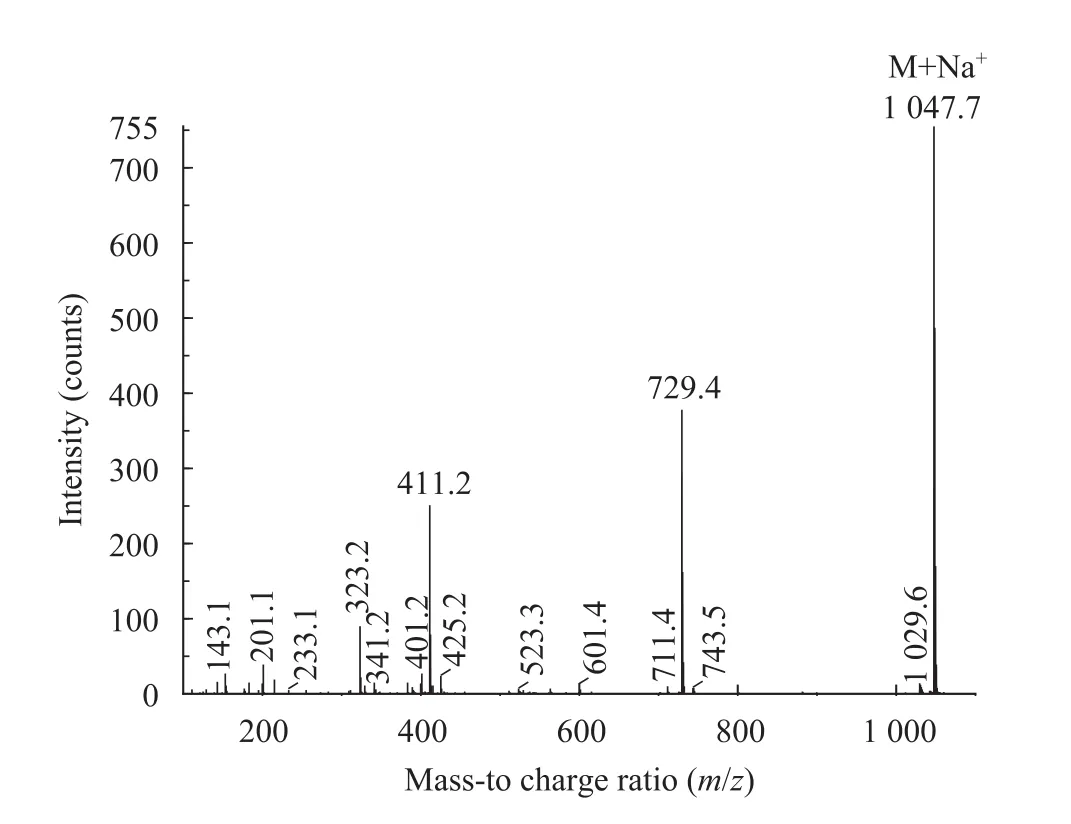
图5 吸水链霉菌17997中产生的抗菌活性化合物的二级MS谱图Fig. 5 The MS2 profile of the compound with antibacterial activity from Streptomyces hygroscopicus 17997.
为了确证吸水链霉菌 17997中的抗革兰阳性菌活性化合物为洋橄榄叶素,对其进行了LC-(+)-ESIMS分析 (图5):MS1显示一个m/z=1 047.7的加合离子 ([M+Na]+),其MS2主要碎片离子为m/z=729.4和 411.2。已知洋橄榄叶素的分子式为 C54H88O18,精确分子质量 1 024.60。该化合物与文献所述的洋橄榄叶素MS1和MS2结果一致[14]。其中,m/z=729.4碎片离子系分子丢失两个 2-脱氧-L-岩藻糖组分形成,m/z=411.2碎片离子系分子的内酯环组分进一步脱水形成。因此,该抗菌活性化合物被证实为洋橄榄叶素。
3 讨论
吸水链霉菌是链霉菌属中的一个比较常见种。据不完全统计,吸水链霉菌能够产生100多种不同的次级代谢产物;此外,同一菌株产生一种以上不同化学结构的抗生素并不少见。洋橄榄叶素是一种大环二内酯类抗生素,在雷帕霉素 (Rapamycin)、尼日利亚菌素 (Nigericin) 和除莠霉素 (Herbimycin) 等抗生素产生菌 (属于吸水链霉菌) 的次级代谢产物中均发现了洋橄榄叶素[15-16]。
近年来,对微生物次级代谢产物、特别是抗生素的生物合成机制有了越来越多的研究和认识,并积累了大量的抗生素生物合成基因 (簇) 序列信息。基于特定生物合成必需基因的保守序列设计寡核苷酸引物,通过PCR可以快速筛选潜在的具有特定化学结构特点的抗生素产生菌[17-19];再通过序列分析与比对,可以为推测菌株可能产生的抗生素化学结构或类型提供重要的提示或参考。本文通过证实吸水链霉菌17997含有dTDP-葡萄糖-4,6-脱水酶基因,并通过序列分析表明它属于洋橄榄叶素生物合成基因簇中与2-脱氧-L-岩藻糖生物合成相关的dTDP-葡萄糖-4,6-脱水酶基因,提示该菌株具有产生洋橄榄叶素的遗传基础,为推测抗革兰阳性菌活性化合物为洋橄榄叶素提供了重要的参考。
洋橄榄叶素具有抗革兰阳性菌、抗线虫、抗原生动物、免疫抑制和抗哺乳动物肿瘤细胞等多种生物学活性;在基于单纯的生物活性筛选模式的微生物次级代谢产物研究中,被重复发现 (分离纯化和化学结构解析) 多次。本文报道了洋橄榄叶素及其产生菌的一种快速、简易鉴定方法;其中,洋橄榄叶素在TLC硅胶板上用NaOH溶液喷涂显红色的特性属于首次报道,其ESI(+)-MS2谱图是首次公开给出,适用于洋橄榄叶素类化合物及其产生菌的早期快速鉴别和排重。洋橄榄叶素用NaOH溶液处理显红色的原理,推测是由于分子中的内酯键在碱性条件下发生水解后分子再脱水增加一个共轭双键,以及分子生成钠盐所致。
致谢:中国科学院成都生物研究所李国友博士惠赠洋橄榄叶素对照品。中国医学科学院药物研究所分析中心完成LC-MS分析。
REFERENCES
[1] He WQ. The studies on geldanamycin biosynthetic gene cluster in Streptomyces hygroscopicus 17997[D]. Beijing: Peking Union Medical College & Chinese Academy of Medical Sciences, 2006.赫卫清. 吸水链霉菌17997中格尔德霉素生物合成基因簇的研究[D]. 北京: 北京协和医学院/中国医学科学院, 2006.
[2] He WQ, Wu LZ, Gao QJ, et al. Identification of AHBA biosynthetic genes related to geldanamycin biosynthesis in Streptomyces hygroscopicus 17997. Curr Microbiol, 2006, 52(3):197−203.
[3] Gao QJ. Cloning and molecular analysis of ansamycins antibiotics biosynthetic gene cluster from Streptomyces hygroscopicus 17997, a geldanamycin producer[D]. Beijing: Peking Union Medical College & Chinese Academy of Medical Sciences, 2002.高群杰. Geldanamycin产生菌吸水链霉菌17997中安莎类抗生素生物合成基因簇的克隆与研究[D]. 北京: 北京协和医学院/中国医学科学院, 2002.
[4] Gong YM, Chen J, Yang T, et al. Secondary metabolites with anti-Staphylococcus aureus activity from Streptomyces hygroscopicus. Chin J Appl Environ Biol, 2010, 16(2): 261−263.龚雨梅, 陈军, 杨涛, 等. 吸水链霉菌抗金黄色葡萄球菌代谢产物. 应用与环境生物学报, 2010, 16(2): 261−263.
[5] Liu AM, Wu LZ, Zhang HT, et al. A color reaction method for early preliminary discrimination of benzenic ansamycins. Chin J Antibiotics, 2008, 33(7): 403−406.刘爱明, 武临专, 张会图, 等. 苯安莎类抗生素的一种早期鉴别方法. 中国抗生素杂志, 2008, 33(7): 403−406.
[6] Du Y, Li TB, Wang YG, et al. Identification and functional analysis of dTDP-glucose-4,6-dehydratase gene and its linked gene cluster in an aminoglycoside antibiotics producer of Streptomyces tenebrarius H6. Curr Microbiol, 2004, 49(2): 99−107.
[7] Xu P, Li WJ, Xu LH, et al. A microwave-based method for genomic DNA extraction from actinomycetes. Microbiol China, 2003, 30(4): 82−84.徐平, 李文均, 徐丽华, 等. 微波法快速提取放线菌基因组DNA. 微生物学通报, 2003, 30(4): 82−84.
[8] Antibiotics, Its Physiological and Biochemical Properties: Volume 1. Beijing: People’s Medical Publishing House. 1977: 526−527.抗菌素——生理生化特性: 第一分册. 北京: 人民卫生出版社, 1977: 526−527.
[9] Alvi KA, Peterson J, Hofmann B. Rapid identification of elaiophylin and geldanamycin in Streptomyces fermentation broths using CPC coupled with a photodiode array detector and LC-MS methodologies. J Ind Microbiol, 1995, 15(2): 80−84.
[10] Wang H, Cui CB, Han B, et al. Elaiophylins, new cell cycle inhibitors and apoptosis inducers, produced by Streptomyces pseudoverticillus I. Taxonomy, production and isolation. Chin J Antibiotics, 2001, 26(1): 19−24.王浩, 崔承彬, 韩冰, 等. 假轮枝链霉菌 Streptomyces pseudoverticillus产生的 elaiophylin类新细胞周期抑制剂及细胞凋亡诱导剂 I. 菌种鉴定、发酵生产及提取分离. 中国抗生素杂志, 2001, 26(1): 19−24.
[11] Yan SL, Huang WY. Research progress on azalomycin B. Microbiol China, 2002, 29(5): 103−107.严淑玲, 黄为一. 阿扎霉素 B (Azalomycin B) 研究进展. 微生物学通报, 2002, 29(5): 103−107.
[12] Haydock SF, Mironenko T, Ghoorahoo HI, et al. The putative elaiophylin biosynthetic gene cluster in Streptomyces sp. DSM4137 is adjacent to genes encoding adenosylcobalamin-dependent methylmalonyl CoA mutase and to genes for synthesis of cobalamin. J Biotechnol, 2004, 113(1/3): 55−68.
[13] Haltli BA. Elaiophylin biosynthetic gene cluster: US Patent, 7595187. 2009-09-29.
[14] Ritzau M, Heinze S, Fleck WF, et al. New macrodiolide antibiotics, 11-O-monomethyl- and 11, 11'-O-dimethylelaiophylins, from Streptomyces sp. HKI-0113 and HKI-0114. J Nat Prod, 1998, 61(11): 1337−1339.
[15] Fang A, Wong GK, Demain AL. Enhancement of the antifungal activity of rapamycin by the coproduced elaiophylin and nigericin. J Antibiot, 2000, 53(2): 158−162.
[16] Yan SL, Huang WY, Wang SM, et al. Extraction, purification and structure elucidation of antibiotic M1 in mycelia of Streptomyces hygroscopicus NND-52. Chin J Antibiotics, 2001, 26(3): 161−164.严淑玲, 黄为一, 王世梅, 等. 吸水链霉菌 NND-52菌株胞内抗生素M1分离、纯化及结构确定. 中国抗生素杂志, 2001, 26(3): 161−164.
[17] Zhang HT, Wu LZ, Liu AM, et al. PCR screening of 3-amino-5-hydroxybenzoic acid synthase gene leads to identification of ansamycins and AHBA related antibiotic producers in actinomycetes. J Appl Microbiol, 2009, 106(3): 755−763.
[18] Hornung A, Bertazzo M, Dziarnowski A, et al. A genomic screening approach to the structure-guided identification of drug candidates from natural sources. ChemBioChem, 2007, 8(7): 757−766.
[19] Liu W, Ahlert J, Gao QJ, et al. Rapid PCR amplification of minimal enediyne polyketide synthase cassettes leads to a predictive familial classification model. Proc Natl Acad Sci USA, 2003, 100(21): 11959−11963.
