人参Rb组皂苷对大鼠实验性脑缺血的影响
2011-02-01张涵亮于晓风曲绍春徐华丽睢大筼吉林大学药学院药理教研室吉林长春3002
张涵亮 于晓风 曲绍春 徐华丽 睢大筼 (吉林大学药学院药理教研室,吉林 长春 3002)
人参Rb组皂苷对大鼠实验性脑缺血的影响
张涵亮1于晓风 曲绍春 徐华丽 睢大筼 (吉林大学药学院药理教研室,吉林 长春 130021)
目的 探讨人参Rb组皂苷(G-Rb)对大鼠实验性脑缺血的保护作用及其作用机制。方法 将Wistar大鼠随机分为假手术组、脑缺血模型组、G-Rb低、中、高剂量组及步长脑心通胶囊组。假手术组及脑缺血模型组灌胃0.5%羧甲基纤维素钠2 ml·kg-1·d-1,G-Rb三个剂量组分别灌胃25、50、100 mg·kg-1·d-1,步长脑心通胶囊组灌胃2 g·kg-1·d-1,连续7 d,末次给药50 min结扎大鼠双侧颈总动脉伴低血压建立不完全性脑缺血模型,3 h后测定大鼠脑含水量和脑指数、脑组织丙二醛(MDA)含量及超氧化物歧化酶(SOD)活性以及血液流变学等指标。结果 G-Rb能明显降低实验性脑缺血大鼠的脑含水量、脑指数及脑组织MDA含量,可使SOD活性明显提高,亦能明显降低大鼠全血黏度、血浆黏度、血浆纤维蛋白原浓度、红细胞沉降率、红细胞比容、红细胞聚集指数及红细胞刚性指数。结论 G-Rb对大鼠实验性脑缺血具有明显保护作用,可能是通过提高体内抗氧化酶活性,抑制自由基的氧化损伤以及改善异常的血液流变学变化实现的。
G-Rb;实验性脑缺血;丙二醛;超氧化物歧化酶;血液流变学
人参Rb组皂苷(Ginsenoside-Rb,G-Rb)系从五加科人参属植物西洋参(Panax Quinquefolium Linn)茎叶及根提取的总皂苷中分离得到的有效部位群,保证了人参皂苷Rb在组分(包括Rb1、Rb2和Rb3)及含量上的完整性。本课题组前期研究表明,G-Rb能明显缩小急性心肌梗死犬心肌梗死面积,降低血清磷酸肌酸激酶及乳酸脱氢酶活性,并明显降低血清LPO含量,提高SOD活性〔1〕;可明显降低实验性心肌梗死大鼠血液黏度和游离脂肪酸水平〔2〕;亦能通过降低心肌耗氧量,改善冠脉循环,抗自由基氧化损伤及增加心肌营养性血流量等环节对缺血心肌产生保护作用〔3~5〕;对结扎大鼠腹主动脉所致压力超负荷性心室重构具有保护作用,可改善心室重构大鼠的左心收缩和舒张功能,增强抗氧化酶活性,减少自由基及缩血管活性物质对心肌的损伤,纠正PGI2/TXA2失衡〔6〕。但G-Rb是否也具有抗脑缺血损伤的作用值得进一步研究,目前尚未见报道。本文采用大鼠结扎双侧颈总动脉伴低血压模型,探讨G-Rb对实验性脑缺血的影响,为扩大其治疗缺血性脑血管病的适应证提供科学依据。
1 材料与方法
1.1 动物 清洁级Wistar大鼠,雌雄各半,体重260~300 g,合格证号SCXK-(吉)2007-0003,吉林大学实验动物中心提供。
1.2 实验药品和试剂 G-Rb由吉林人参研究院提供,批号:20101220,人参皂苷Rb组分含量86.5%,实验时以0.5%羧甲基纤维素钠配制成所需浓度使用;步长脑心通胶囊,咸阳步长制药有限公司生产,批号:20100403,每粒 0.4 g,4粒/次,3次/d;丙二醛(MDA)及超氧化物歧化酶(SOD)试剂盒,均购于南京建成生物技术研究所。
1.3 动物分组与给药 取72只Wistar大鼠,雌雄各半,按体重随机分成6组:假手术组、脑缺血模型组、G-Rb低、中、高剂量组及阳性药步长脑心通胶囊组,每组12只。G-Rb组大鼠灌胃G-Rb 25、50、100 mg/kg,阳性药组大鼠灌胃步长脑心通胶囊2 g/kg,假手术组及脑缺血模型组灌胃0.5%羧甲基纤维素钠,各组灌胃体积均为2 m l/kg,1次/d,连续7 d。
1.4 脑缺血模型建立〔6〕末次给药后 50 min,氯醛糖0.3 g/kg腹腔注射麻醉,灯照保温(使肛温维持 37℃ ~37.5℃),股动脉插管监测血压,股静脉插管用于再灌注。塑料管从颈外静脉插入右心房供放血用。连续记录脑电图,用抽血的方法放血,当血压达到80 mmHg时分离双侧颈总动脉并结扎,再继续抽血,当血压下降到50 mmHg时,脑电图呈一直线,此时即造成不完全性脑缺血模型,维持15 min。假手术组只插管,不放血及结扎。抽出的血放入肝素化试管中37℃水浴保存,以备血压过低时回输。180 min后,每组动物均以戊巴比妥钠30 mg/kg腹腔注射麻醉,腹主动脉取血,肝素抗凝。从加有抗凝剂的3 m l全血中取出1 m l加入LBY-N6A旋转式血液黏度计,分别测定全血低切(10/s)、中切(80/s)及高切(160/s)黏度。余下2 m l全血以3 000 r/min离心10 min,取上层血浆1 ml加入黏度计测定120/s切变率下血浆黏度〔7〕;按文献方法〔8〕测定红细胞比容、血浆纤维蛋白原浓度及红细胞沉降率(ESR),进一步推算出红细胞聚集指数及红细胞刚性指数。然后断头处死大鼠,开颅取脑,去除嗅脑、小脑、脑干后称重,计算脑指数〔脑指数 =(脑重×100)/体重〕。取大脑左侧半球称湿重,然后放入110℃烤箱中烤至恒重,称其干重,计算脑含水量〔脑含水量 =(脑湿重-脑干重)/脑湿重×100%〕;将大脑右侧半球放置冰盆上,用冰生理盐水冲去残血,按质量∶体积比为1∶9比例以冰生理盐水为匀浆介质在冰浴下制备10%脑组织匀浆,分装于1.5 m l Eppendorf管中,4℃以3 000 r/min离心10 min,取上清采用721紫外分光光度计分别测定脑组织MDA含量及SOD活性。
2 结果
2.1 G-Rb对实验性脑缺血大鼠脑含水量及脑指数的影响与假手术组比较,脑缺血模型组大鼠脑含水量及脑指数均明显增加(P<0.01)。与脑缺血模型组比较,G-Rb 50、100 mg/kg均能明显减少实验性脑缺血大鼠脑含水量及脑指数(P<0.05或P<0.01),其作用效果与阳性药步长脑心通胶囊2 g/kg相当,G-Rb 25 mg/kg对脑含水量及脑指数均无明显影响(P>0.05)。见表1。
2.2 G-Rb对实验性脑缺血大鼠脑组织MDA含量及SOD活性的影响 与假手术组比较,脑缺血模型组脑组织MDA含量明显增高,SOD活性明显降低(P<0.05或P<0.01)。与脑缺血模型组比较,G-Rb 50、100 mg/kg均能明显降低脑组织MDA含量,升高SOD活性(P<0.05或P<0.01),其作用效果与步长脑心通胶囊2 g/kg相当,G-Rb 25mg/kg对MDA含量及SOD活性均无明显影响(P>0.05)。见表2。
2.3 G-Rb对实验性脑缺血大鼠全血黏度及血浆黏度的影响与假手术组比较,脑缺血模型组3个切变率下的全血黏度及血浆黏度均明显增高(P<0.05或P<0.01)。与脑缺血模型组比较,G-Rb 50、100 mg/kg均能明显地降低3个切变率下全血黏度及血浆黏度(P<0.05或P<0.01),其作用效果与步长脑心通胶囊2 g/kg相当,G-Rb 25 mg/kg对全血黏度及血浆黏度均无明显影响(P>0.05)。见表3。
2.4 G-Rb对实验性脑缺血大鼠血液流变学的影响 见表4。与假手术组比较,脑缺血模型组的血浆纤维蛋白原浓度、红细
表1 G-Rb对实验性脑缺血大鼠脑组织含水量及脑指数的影响(±s,n=10)
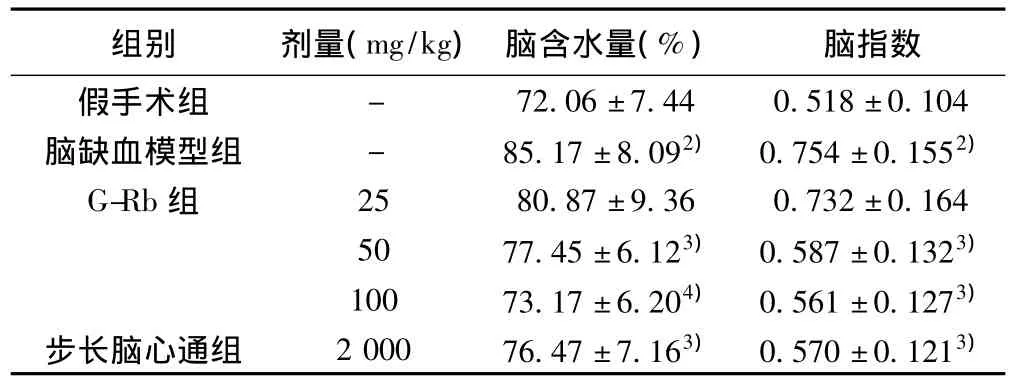
表1 G-Rb对实验性脑缺血大鼠脑组织含水量及脑指数的影响(±s,n=10)
组别 剂量(mg/kg) 脑含水量(%)- 72.06±7.44 0.518±0.104脑缺血模型组 - 85.17±8.092) 0.754±0.1552)G-Rb组 25 80.87±9.36 0.732±0.164 50 77.45±6.123) 0.587±0.1323)100 73.17±6.204) 0.561±0.1273)步长脑心通组 2 000 76.47±7.163) 0.570±0.1213)脑指数假手术组
与假手术组比较:1)P<0.05,2)P<0.01;与脑缺血模型组比较:3)P <0.05,4)P <0.01;下表同胞比容、ESR、红细胞聚集指数及红细胞刚性指数均明显增加(P<0.05或 P<0.01)。与脑缺血模型组比较,G-Rb 50、100 mg/kg对上述血液流变学变化有明显改善作用(P<0.05或P<0.01),其作用效果与步长脑心通胶囊2 g/kg相当,G-Rb 25 mg/kg对上述血液流变学变化无明显影响(P>0.05)。
表2 G-Rb对实验性脑缺血大鼠脑组织MDA含量及SOD活性的影响(±s,n=10)
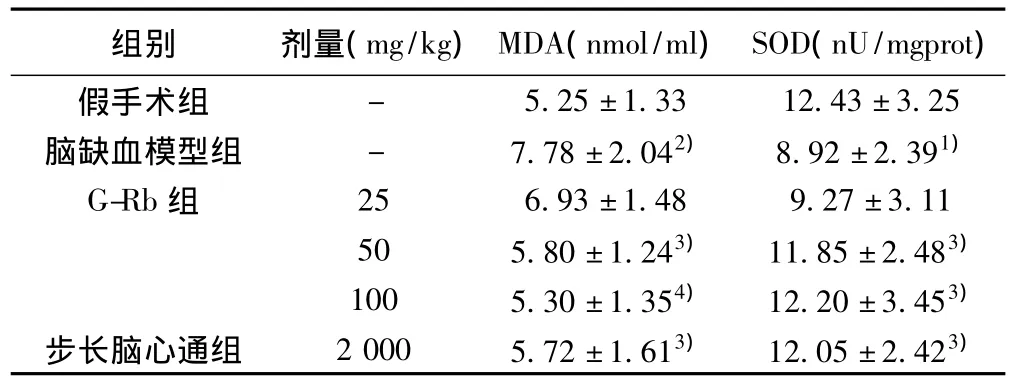
表2 G-Rb对实验性脑缺血大鼠脑组织MDA含量及SOD活性的影响(±s,n=10)
组别 剂量(mg/kg)MDA(nmol/ml)SOD(nU/mgprot)- 5.25±1.33 12.43±3.25脑缺血模型组 - 7.78±2.042) 8.92±2.391)G-Rb组 25 6.93±1.48 9.27±3.11 50 5.80±1.243) 11.85±2.483)100 5.30±1.354) 12.20±3.453)步长脑心通组 2 000 5.72±1.613) 12.05±2.423)假手术组
表3 G-Rb对实验性脑缺血大鼠全血黏度及血浆黏度的影响(±s,n=10)
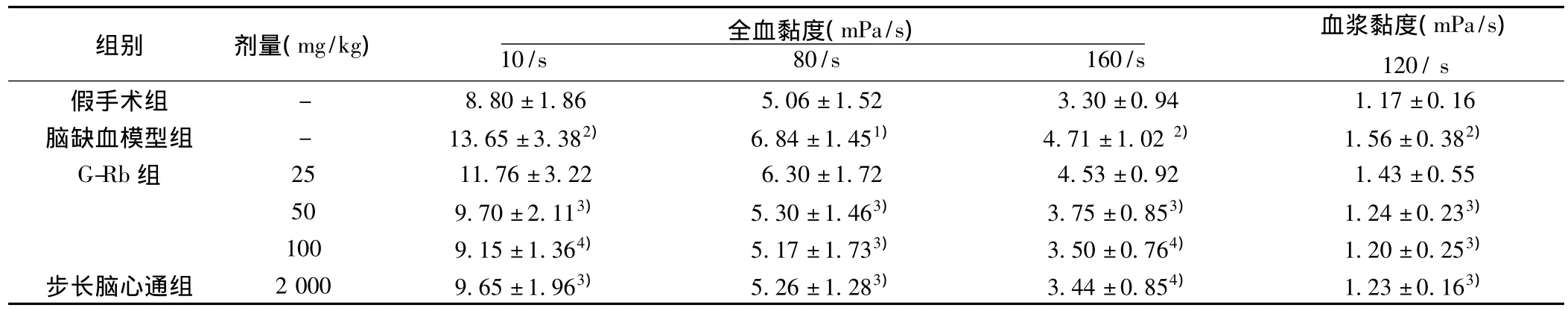
表3 G-Rb对实验性脑缺血大鼠全血黏度及血浆黏度的影响(±s,n=10)
血浆黏度(mPa/s)组别 剂量(mg/kg) 全血黏度(mPa/s)8.80±1.86 5.06±1.52 3.30±0.94 1.17±0.16脑缺血模型组 - 13.65±3.382) 6.84±1.451) 4.71±1.02 2) 1.56±0.382)G-Rb组 25 11.76±3.22 6.30±1.72 4.53±0.92 1.43±0.55 50 9.70±2.113) 5.30±1.463) 3.75±0.853) 1.24±0.233)100 9.15±1.364) 5.17±1.733) 3.50±0.764) 1.20±0.253)步长脑心通组 2 000 9.65±1.963) 5.26±1.283) 3.44±0.854) 1.23±0.163)120/s假手术组10/s 80/s 160/s-
表4 G-Rb对实验性脑缺血大鼠血液流变学的影响(±s,n=10)
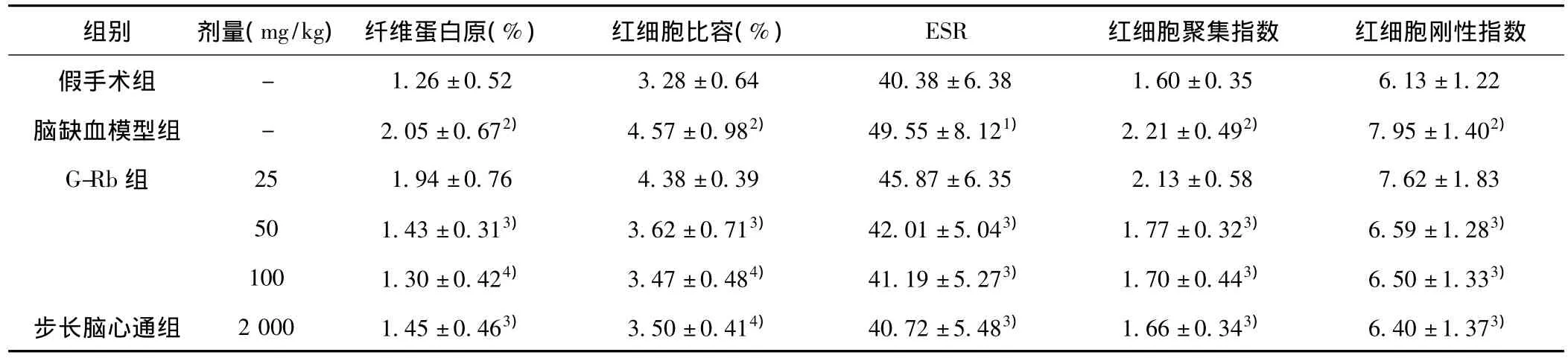
表4 G-Rb对实验性脑缺血大鼠血液流变学的影响(±s,n=10)
.13±1.22脑缺血模型组 - 2.05±0.672) 4.57±0.982) 49.55±8.121) 2.21±0.492) 7.95±1.402)G-Rb组 25 1.94±0.76 4.38±0.39 45.87±6.35 2.13±0.58 7.62±1.83 50 1.43±0.313) 3.62±0.713) 42.01±5.043) 1.77±0.323) 6.59±1.283)100 1.30±0.424) 3.47±0.484) 41.19±5.273) 1.70±0.443) 6.50±1.333)步长脑心通组 2 000 1.45±0.463) 3.50±0.414) 40.72±5.483) 1.66±0.343) 6.40±1.373)红细胞聚集指数 红细胞刚性指数假手术组 - 1.26±0.52 3.28±0.64 40.38±6.38 1.60±0.35 6组别 剂量(mg/kg) 纤维蛋白原(%) 红细胞比容(%) ESR
3 讨论
脑水肿是大脑受到缺血打击后的一种脑组织病理反应,氧自由基、钙超载、兴奋性氨基酸损害等因素是形成脑水肿的主要机制〔9〕。脑缺血后脑含水量及脑指数等指标的观察可直接反映药物对脑缺血导致脑水肿的保护作用〔10〕。本实验结果表明:G-Rb能明显降低大鼠脑含水量及脑指数,提示其可减轻脑水肿,对缺血性脑损伤具有保护作用。
脑缺血导致细胞内Ca2+超载,进一步激活依赖Ca2+蛋白水解酶,使黄嘌呤脱氢酶变成黄嘌呤氧化酶。次黄嘌呤在黄嘌呤氧化酶作用下生成黄嘌呤,后者在黄嘌呤脱氢酶作用下生成尿酸,这两个过程均产生大量氧自由基,可攻击生物膜中多聚不饱和脂肪酸引起脂质过氧化作用,形成脂质过氧化物(如MDA),使膜的通透性增加,导致线粒体及细胞肿胀,抑制电子传递和氧化磷酸化,进一步使能量代谢障碍加重,溶酶体酶释放引起细胞自身消化,最终导致细胞死亡〔11,12〕。G-Rb可使实验性脑缺血大鼠脑组织中MDA含量明显降低,并同时提高SOD活性,提示其可能通过提高抗氧化酶活性,清除氧自由基对脑组织产生保护作用。
血液黏度主要由红细胞比容、血浆黏度、红细胞聚集性、红细胞变形性等内在因素决定,在低切变率下,血液黏度受红细胞压积和红细胞聚集性等因素的影响;红细胞聚集性决定于红细胞表面电荷量和血浆纤维蛋白原的浓度,红细胞压积升高,红细胞聚集性增强,血浆黏度增高,红细胞电泳时间则延长;高切变率下全血黏度主要决定于纤维蛋白原浓度,含量多则血液黏度高〔13〕。红细胞是影响血液流变学指标的主要因素。红细胞变形性主要影响高切变黏度、红细胞良好的血液变形性,使之在流场中能随流线取向,也使细胞膜能围绕胞质内容物以“坦克履带”样作缓慢旋转运动,减少了血液内摩擦力,降低了黏度。红细胞变形指数升高表明红细胞变形性改善。而红细胞聚集性增高,使其呈“串珠样”排列,不利于血液运行,主要影响低切变下黏度〔14〕。本实验结果显示,G-Rb能明显地降低实验性脑缺血大鼠的全血黏度、血浆黏度、红细胞压积及纤维蛋白原浓度,说明其不仅能抑制红细胞聚集,而且能降低红细胞的脆性,增强其变形性。这可能是其对实验性脑缺血产生保护作用的机制之一。
1 睢大员,陈满秋,于晓风,等.人参Rb组皂苷对犬实验性心肌梗死的保护作用〔J〕.中草药,2001;32(2):136-9.
2 覃秀川,睢大员,杨景文,等.人参Rb组皂苷对实验性心梗大鼠血液黏度和游离脂肪酸水平的影响〔J〕.中草药,2002;32(6):540-4.
3 孙 乾,睢大员,于晓风,等.人参Rb组皂苷对实验性心肌梗死犬心脏血流动力学和氧化谢的影响〔J〕.中草药,2002;33(8):718-22.
4 徐华丽,翟玉荣,曲绍春,等.人参Rb组皂苷对小鼠心肌营养性血流量的影响〔J〕.人参研究,2003;15(3):2-4.
5 王天晓,于晓风,曲绍春,等.人参Rb组皂苷对压力负荷性心肌肥厚大鼠心室重构的影响及其作用机制〔J〕.时珍国医国药,2008;19(7):1615-7.
6 Smith ML,Bendek G.Models for studying long-term recovery following forebrain ischemia in the rat〔J〕.Acta Neurol Sci,1984;69:385-401.
7 尹一子,李子健,睢大员,等.碟脉灵注射液对大鼠急性心肌梗死面积及血液流变学影响〔J〕.中成药,1999;21(4):191-3.
8 刘宏雁,李吉平,王秋静,等.刺五加叶皂苷对实验性高脂血症大鼠血液流变学的影响〔J〕.白求恩医科大学学报,1995;21(4):339-40.
9 Lipton SA,Choi YB,Pan ZI,et al.A redox-based mechanism for the neuroprotective and neurodestructive effects of nitric oxide and related nitroso compounds〔J〕.Nature,1993;364:26.
10 张天锡.急性脑外伤,脑缺血脑水肿的发病机制,分类及其防治〔J〕.急诊医学,1996;5(1):53-5.
11 Slater TF.Free-radicalmechanism in tissue injury〔J〕.Biochem J,1984;222:1-3.
12 睢大员,于晓风,曲绍春,等.刺五加叶皂苷对大鼠实验性脑缺血的保护作用〔J〕.中草药,2005;36(4):561-3.
13 郑德先,吴克复,楮建新,等.现代实验血液学研究方法与技术〔M〕.北京:北京医科大学 中国协和医科大学联合出版社,1999:223-6.
14 王 宏,曲绍春,于晓风,等.血栓心脉宁片对急性血瘀模型大鼠血小板功能及血液流变学的影响〔J〕.中国老年学杂志,2010;30(22):3335-7.
R-322
A
1005-9202(2011)12-2247-03
1 武警吉林省总队医院药剂科
睢大筼(1957-),男,教授,博士生导师,主要从事心脑血管药理学研究。
张涵亮(1976-),男,主管药师,主要从事药理学研究。
〔2011-03-10收稿 2011-05-20修回〕
(编辑 曲 莉)
