利莫那班对局灶性脑缺血/再灌注损伤大鼠的保护作用
2011-02-01乐乐乐
乐乐乐 董 志
(重庆医科大学药学院药理教研室 重庆市生物化学与分子药理学重点实验室,重庆 400016)
利莫那班对局灶性脑缺血/再灌注损伤大鼠的保护作用
乐乐乐 董 志
(重庆医科大学药学院药理教研室 重庆市生物化学与分子药理学重点实验室,重庆 400016)
目的 探讨大麻素1(CB1)受体拮抗剂利莫那班对大鼠局灶性脑缺血/再灌注损伤的保护作用。方法 线栓法制备大鼠局灶性脑缺血/再灌注模型。36只雄性大鼠随机分为假手术组、手术组、尼莫地平对照组、利莫那班低剂量组、中剂量组和高剂量组。再灌注24 h后进行神经功能评分(NFS),TTC染色测定梗死面积,HE染色检测脑组织病理变化,免疫组化染色观察P-erk1/2和caspase-3免疫阳性表达,并检测大鼠脑组织匀浆中超氧化物歧化酶(SOD)和丙二醛(MDA)变化。结果 利莫那班能明显改善大鼠的神经行为,缩小梗死面积,并使脑组织病理改变减轻,SOD活性明显升高,MDA含量明显降低,下调caspase-3的表达,上调P-erk1/2的表达。结论 利莫那班对局灶性脑缺血/再灌注大鼠有明显的保护作用,其机制可能与拮抗大麻素受体、抑制细胞凋亡有关。
利莫那班;局灶性脑缺血/再灌注超氧化物歧化酶;丙二醛;半胱氨酸酶-3
缺血性脑血管疾病是严重的神经疾病,常见于中年以上的人群,严重者可发生意识障碍和肢体障碍。寻找有效的治疗药物,促进中枢神经系统功能恢复,一直是相关学科研究的重点。选择性大麻素1(CB1)受体拮抗剂利莫那班直接作用于中枢神经系统,临床上用于改善超重或肥胖者心血管病代谢危险因素〔1〕。但是对于利莫那班其他可能潜在的疗效,国内外的文献报道不多,其机制的研究更少。本实验通过模拟局灶性脑缺血再灌注损伤模型,研究利莫那班对脑缺血损伤的保护作用并初步探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级Sprague-Dawley雄性大鼠,体重200~240 g,鼠龄3~4个月,由重庆医科大学实验动物中心提供,动物合格证号:SCXK(渝)2009-0001。
1.1.2 药品与试剂盒 利莫那班,郑州荔诸生物科技有限公司;红四氮唑(TTC),中国医药上海化学试剂总厂;超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒,南京建成试剂公司;半胱氨酸酶-3(caspase-3)、P-erk多克隆抗体,Bioworld Technoiogy;其余试剂均为国产分析纯。
1.2 方法
1.2.1 分组与给药 成年健康雄性SD大鼠36只,随机分为6组(n=6),饲养于实验室内,自由进食及饮水,让其适应环境3 d。手术前1 d禁食禁水。①假手术组:分离颈总动脉(CCA)、颈内动脉(ICA)和颈外动脉(ECA),线栓插入约10 mm;②局灶性脑缺血/再灌注组:线栓法制备;③药物组:局灶性脑缺血/再灌注 +利莫那班(5、10、20 mg/kg)组;④对照组:局灶性脑缺血/再灌注+尼莫地平(1 mg/kg)。药物利莫那班用二甲基亚砜配置,于手术前30 min腹腔注射,假手术组及手术组于手术前30 min腹腔注射二甲基亚砜。
1.2.2 脑缺血/再灌注模型的制备 采用Longa等〔2〕的方法制备局灶性脑缺血/再灌注模型。给药30 min后,腹腔注射3.5%水合氯醛(0.1 ml/kg)麻醉。仰卧位固定在手术板上,颈正中切口,钝性分离皮下组织和肌肉,暴露左侧的血管和神经,分离出CCA、ICA和ECA。结扎CCA的近心端和ECA,用动脉夹夹闭ICA,并在CCA上剪开一小口,插入线栓,松开夹住ICA的动脉夹,将线栓缓缓向颅内推进,约18 mm处感觉到轻微阻力即可。将线栓和ICA结扎固定,逐层缝合肌肉和皮肤。2 h后拔出线栓造成血流再灌注模型。假手术组分离CCA、ICA和ECA,线栓插入约10 mm,其余同上。
1.2.3 神经功能缺损评分 大鼠缺血/再灌注24 h后,按照Zea-longa系统进行神经功能缺损评分。标准如下:0分,无神经功能缺损症状;1分,不能完全伸展左侧前爪,轻度神经功能损伤;2分,向左侧转圈,中度局灶性神经功能缺损;3分,行走时向左侧倾倒,重度局灶性神经功能缺损;4分,不能自发行走,意识昏迷。
1.2.4 脑梗死容积百分比 神经功能缺损评分后,立即将大鼠断头取脑,取出小脑、嗅球。于-20℃冰箱中速冻20 min,冠状切面,第一刀在脑前极与视交叉连线中点处;第二刀在视交叉部位;第三刀在漏斗柄部位;第四刀在漏斗柄与后叶尾极之间。将五片切片置于2%TTC溶液中,用锡箔纸盖住避光,放入37℃温箱15~30 min,不时翻动脑片,均匀接触到染色液。取出观察并拍照,采用图像处理软件(ADOBEPHOTOSHOP 7.0)计算梗死面积(粉红色区为正常脑组织,白色区为梗死区)。脑梗死容积百分比=梗死面积之和×2/正常大脑半球容积。
1.2.5 SOD活性和MDA含量变化 神经功能损伤评分后,断头取脑,切取左侧大脑,称重,用0.9%生理盐水制成1%的脑组织匀浆液,离心3 500 r/min×15min,取上清液,-20℃保存。根据试剂盒说明书测定SOD活性及MDA含量。
1.2.6 苏木素-伊红(HE)染色 神经功能损伤评分后,经左心室缓慢注入生理盐水100 m l,血液和灌注液从右心耳流出,再缓慢注入4 g/L多聚甲醛的磷酸盐缓冲液200 ml进行固定。断头取脑,冠状位切取前囟及其后约4 mm处的脑组织放于4%多聚甲醛溶液中固定过夜,石蜡包埋,切片,染色,观察基底节和海马神经元形态变化。
1.2.7 免疫组织化学染色 神经功能损伤评分后,载体灌流,断头取脑,冠状位切取前囟及其后约4 mm处的脑组织放于4%多聚甲醛溶液中固定过夜,石蜡包埋,切片,按试剂盒说明书采用SABC法进行免疫组化染色。
1.3 统计学分析 应用SPSS11.5统计软件进行分析,数据以±s表示,组间比较采用T检验。
2 结果
2.1 神经功能缺损评分 经利莫那班处理的大鼠神经行为学明显改善,且呈剂量依赖性。与假手术组比较,手术组大鼠神经功能评分(3.68±0.17)明显升高(P<0.001),说明大鼠出现脑损伤,模型建立成功;与手术组比较,利莫那班高剂量组神经功能评分(2.45±0.10)明显降低(P<0.05),而利莫那班中、低剂量组大鼠神经功能评分与手术组比较无显著差异(P>0.05),分别为(3.57±0.08,3.65±0.11);与尼莫地平对照组(2.38±0.09)相比,利莫那班高剂量组无显著差异(P>0.05)。
2.2 脑梗死容积百分比 大鼠脑缺血/再灌注24 h后均出现不同程度的缺血梗死。脑梗死容积百分比利莫那班高剂量组为34.76%,明显小于中剂量组(41.85%)和低剂量组(57.96%)(P<0.05),大于对照组(32.37%)(P<0.05)。给药组的脑梗死面积百分比均显著小于手术组(70.45%)(均P<0.05)。
2.3 脑组织SOD活性及MDA含量 手术组与假手术组相比,脑组织中SOD活性降低,MDA含量增加(P<0.01)。与手术组相比,利莫那班处理组升高了局灶性脑缺血/再灌注脑组织SOD活性(P<0.05),降低MDA含量(P<0.01)。见表1。
表1 利莫那班对脑缺血/再灌注大鼠脑组织匀浆中SOD活性及MDA含量的影响(±s,n=6)
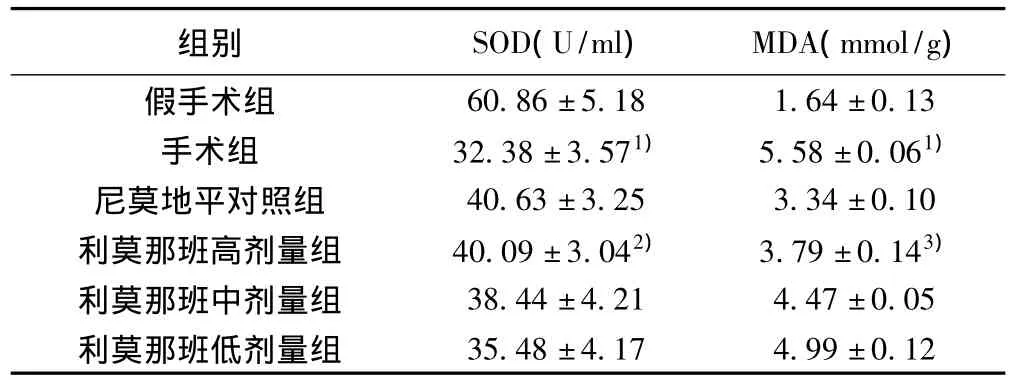
表1 利莫那班对脑缺血/再灌注大鼠脑组织匀浆中SOD活性及MDA含量的影响(±s,n=6)
与假手术组比较:1)P<0.01;与手术组比较:2)P<0.05,3)P<0.01
组别 SOD(U/ml) MDA(mmol/g)60.86±5.18 1.64±0.13手术组 32.38±3.571) 5.58±0.061)尼莫地平对照组 40.63±3.25 3.34±0.10利莫那班高剂量组 40.09±3.042) 3.79±0.143)利莫那班中剂量组 38.44±4.21 4.47±0.05利莫那班低剂量组假手术组35.48±4.17 4.99±0.12
2.4 病理学改变 假手术组大鼠缺血侧脑组织神经元胞体密度大,呈圆形,胞核规整,染色质分布均匀,胞膜完整。手术组脑组织神经元胞体水肿、疏松,可见大量神经元胞体为三角形,梗死灶周围出现部分细胞核固缩,核溶解,核仁模糊或消失,水肿空泡形成,神经元间隙扩大;利莫那班高剂量组可见少量神经元胞体呈三角形;利莫那班中、低剂量组较多神经元胞体呈三角形。见图1。

图1 利莫那班对脑组织病变的影响(×400)
2.5 缺血区caspase-3、P-erk的表达 见图2、图3。假手术组大鼠脑组织caspase-3呈弱性表达。手术组大鼠皮层和海马caspase-3主要在胞核表达,部分细胞也可见胞质表达。给药后,利莫那班能下调caspase-3的表达。假手术组有极少数的P-erk阳性细胞。手术组皮层和海马可见较多阳性细胞,主要在胞质表达。给药后,利莫那班能上调P-erk的表达。

图2 capase-3在大脑皮层的表达(×400)

图3 P-erk在大脑皮层的表达(×400)
3 讨论
实验结果显示,利莫那班能明显改善脑缺血/再灌注大鼠的神经功能损伤,明显减小左侧大脑的梗死面积,明显减轻脑缺血/再灌注大鼠皮层区域神经元的核固缩和细胞数目的减少,结果证实利莫那班对脑缺血/再灌注大鼠脑损伤有保护作用。有研究表明,脑缺血/再灌注损伤与细胞凋亡有密切关系〔2,3〕。本文结果提示,在缺血区域凋亡细胞数目明显增加,凋亡在脑缺血损伤中具有重要的作用。因此,减少细胞凋亡,阻断细胞凋亡通路是改善脑组织缺血的一个重要的治疗方向。
神经元凋亡与缺血周边组织复杂的信号转导通路激活有密切关系,其中起重要作用的是丝裂原活化蛋白激酶(MAPK)家族中的细胞外调节激酶通路。缺血后活化的细胞外信号调节激酶(ERK)1/2通路可调控某些凋亡因子,如caspase-3,从而调控细胞凋亡。caspases依赖的凋亡途径是细胞程序性死亡的一种重要方式,caspase-3是caspase级联瀑布下游最关键的凋亡蛋白酶,抑制DNA修复并启动DNA降解。caspase-3可以被多种因素活化,大鼠脑缺血/再灌注损伤后,Fas与配体结合而活化,其中caspase-8是这一凋亡过程中首先被活化的白细胞介素转化酶(ICE)家族蛋白酶,caspase-8活化后引起caspase-3和caspase-7活化,这两种酶都可以剪切多聚ADP核糖聚合酶(PARP),引起DNA的降解。另外,caspase-3还可以活化caspase-6,后者可以降解层蛋白 B〔4,5〕。经利莫那班处理过的大鼠基底节和海马caspase-3的表达明显减少,从而推测利莫那班通过对caspase-3的抑制作用,保护脑缺血引起的细胞损伤。
MAPK信号传递途径是大麻素1受体(CB1R)介导的经典信号通路之一。胞外信号调节激酶(extracellular signal-regulated kinase,ERK)是MAPK家族的一员,它的信号传递途径是涉及调节细胞生长、发育及分裂的信号网络的核心〔6,7〕。利莫那班治疗组P-erk的表达水平明显高于手术组,提示利莫那班通过调节P-erk的活化水平而调控凋亡的进程。利莫那班拮抗CB1R,刺激erk磷酸化,调节凋亡因子,同时激活转录因子刺激片段基因产生抗凋亡的作用〔8〕。但是有研究发现,激活CB1R同样也可以对脑缺血的大鼠产生保护作用〔9〕。造成这些实验结果不一致的原因可能是多方面的,也许与实验条件、病变程度和给药时间有关,或者只有在早期当脑损伤程度较轻的时候给予大麻素才有保护作用,而在进展期给予则无效〔10〕。
1 Pertwee RG.Pharmacology of cannabinoid receptor ligands〔J〕.Curr Med Chem,1999;6(8):635-64.
2 Wakade C,Khan MM,De Sevilla LM,et al.Tamoxifen neuroprotection in cerebral ischemia involves attenuation of kinase activation and superoxide production and potentiation ofmitochondrial superoxide dismutase〔J〕.Endocrinology,2008;149(1):367-79.
3 Cho BB,Toledo-Pereyra LH.Caspase-independent programmed cell death following ischemic stroke〔J〕.J Invest Surg,2008;21(3):141-7.
4 Barone FC,Irving EA,Ray AM,et al.SB 239063,a second-generation p38 mitogen-activated protein kinase inhibitor,reduces brain injury and neurological deficits in cerebral focal ischemia〔J〕.J Pharmacol Exp Ther,2001;296(2):312-21.
5 朱 丽,董 志,张国栋,等.大麻素对脑出血大鼠皮层内PKAC-β、c-fos及BDNF表达量的影响〔J〕.中国药理学通报,2010;26(4):535-8.
6 Kim R,EmiM,Tanabe K,etal.Regulation and interplay of apoptotic and non-apoptotic cell death〔J〕.JPathol,2006;208(3):319-26.
7 Gong N,Li G,Xiao J,et al.Impact of MAPK cascade pathway and P53 pathway upon liver transplant〔J〕.JHuazhong Univ Sci Technolog Med Sci,2005;25(5):555-7.
8 Hill M,Wernig A,Goldspink G.Muscle satellite(stem)cell activation during local tissue injury and repair〔J〕.JAnat,2003;203(1):89-99.
9 Demuth DG,Molleman A.Cannabinoid signaling〔J〕.Life Sci,2006;78(6):549-63.
10 Ryberg E,Vu HK,Larsson N,etal.Identification and characterisation of a novel splice variantof the human CB1 receptor〔J〕.FEBSLett,2005;579(1):259-64.
Protective effect of rimonabant on cerebral ischem ia reperfusion in jury in rats
YUE Le-Le,DONG Zhi.
Department of Pharmacology,Key Laboratory of Biochem istry and Molecular Pharmacology,Chongqing M edical University,Chongqing 400016,China
Objective To investigate the protective effects of rimonabant on cerebral ischemia reperfusion(CIR)injury in rats.M ethods The CIR model was built through thread block.36 male rats were random ly divided into sham operation,operation,nimodipine,low,middle and high dose rimonabant groups.24 h later,the neurologic deficit score and infarction area weremeasured.Then pathological change in injury brain tissue was detected by HE stain.The caspase-3 and P-erk protein expressions were detected by immunohistochemistry.At the same time,the levels of superoxide dismutase(SOD)and malondialdehyde(MDA)in brain tissue were observed.Results Rimonabant reduced cerebral infarction area,and relieved the injury of brain tissue.It increased the activity of SOD and decreased the contents of MDA.It also reduced the expression of caspase-3,and increased the expression of P-erk.Conclusions Rimonabant has an obviously neuroprotective effecton ischemic cellular injury by antagonising CB1.The Neuronal apoptosismay be involved in the protectivemechanism.
Rimonabant;Cerebral ischemia reperfusion;SOD;MDA;Caspase-3
R-33
A
1005-9202(2011)12-2226-03
重庆市自然科学基金资助(CSTC2009BA5086)
董 志(1960-),男,博士,教授,博士生导师,主要从事神经药理学研究。
乐乐乐(1986-),女,在读硕士,主要从事神经药理学研究。
〔2010-10-12收稿 2010-12-12修回〕
(编辑 袁左鸣/徐 杰)
