内耳结构异常患者的人工耳蜗植入术
2011-01-23张宏征钱宇虹陈浩郭梦和
张宏征 钱宇虹 陈浩 郭梦和
人工耳蜗植入是目前治疗深度聋和全聋的首选方法,但伴有内耳结构异常的患者行人工耳蜗植入的手术难度大、风险高。南方医科大学珠江医院耳鼻咽喉科于2000年1月~2010年5月对24例伴有严重内耳结构异常的极重度聋患者进行了人工耳蜗植入术,现将有关临床资料、手术要点及术后听觉言语康复情况报道如下。
1 资料与方法
1.1临床资料 2000年1月~2010年5月共为665例极重度感音性聋患者行人工耳蜗植入,经CT和MRI检查发现存在严重内耳结构异常24例,其中男15例,女9例,年龄18个月~14岁,均为语前聋;全部患者均有配戴助听器史。其中,耳蜗骨化2例(图1),Waardenburg综合征(Waardenburg syndrome,WS)Ⅱ型8例,Mondini畸形12例(图2),共同腔畸形1例(图3),半规管缺如(耳蜗无异常)1例。随机选择内耳结构正常的相同年龄段接受人工耳蜗植入的极重度感音性语前聋患者30例作为对照组。内耳结构异常组植入Nucleus 24M型人工耳蜗2例、Nucleus 24R(ST)型9例、Nucleus 24R弯电极(Contour或 CA)12例、Med-El C40+型人工耳蜗1例;对照组植入Nucleus 24R(ST)型8例、Nucleus 24R(CA)型22例。
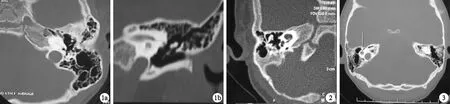
图1耳蜗骨化患者颞骨CT图像(左侧) 患者男性,8岁,a.水平位显示耳蜗底回骨化;b.冠状位显示耳蜗底回骨化,第二回与顶回管腔存在
图2 Mondini畸形患者颞骨CT图像(右侧) 患者男性,18月龄,显示耳蜗底回形态正常,第二回与顶回间隔发育不全
图3共同腔畸形患者颞骨CT图像患者男性,4岁,显示右侧耳蜗形态呈泡状,骨性间隔缺失
1.2术前评估 术前采用ABR、DPOAE及声导抗、镫骨肌反射等检查对患者进行听力学评估,对于能合作的患者同时行纯音测听或儿童声场测听。内耳结构异常组患者ABR反应阈均大于90 dB nHL;对照组除1例患者的较好耳ABR反应阈为75 dB nHL外,其余患者ABR反应阈均在90 dB nHL以上;两组所有患者DPOAE双侧均未引出;鼓室导抗图均为A型,镫骨肌反射均未引出。术前影像学评估采用PHILIPS 64排或GE 4排螺旋CT行颞骨高分辨率扫描及三维重建,并采用1.5T或3.0T 磁共振仪行颅脑、内耳MRI检查。结合CT和MRI影像对患者内耳结构进行评估,确定耳蜗和半规管的形态是否异常,耳蜗有无骨化、纤维化,前庭水管开口有无扩大,内淋巴囊是否增大,以及有无脑白质和大脑皮层发育异常等。对于有自闭症表现、脑皮质发育不良、脑白质发育异常的患者,由儿童神经系统疾病专家协助评估。
1.3手术方法 采用气管插管全麻,经耳后弧形切口(Nucleus 24R系列设计切口长约5 cm,Med-El C40+型切口长约10 cm),切开皮肤及皮下组织。皮下分离后做蒂在前方的耳后骨膜瓣,剥离子骨膜下分离,显露筛区、乳突区和部分枕骨骨质,均在乳突后方磨出固定安放植入体的骨槽。自筛区径路[1]行乳突切开,显微镜下轮廓化乳突腔,显露砧骨窝和垂直段面神经骨管及鼓索神经,在后两者之间磨骨进入面隐窝。12例Mondini畸形者中5例畸形程度较轻者选用 Nucleus 24R弯电极植入体,另7例和1例共同腔畸形患者在鼓岬钻孔后插入直的环形电极阵列(Nucleus 24M);2例耳蜗骨化病例术中发现骨化范围限于耳蜗底回,用0.6 mm直径金刚钻顺鼓阶方向潜行磨开底回并以小钩针钩出骨化灶使鼓阶通畅后植入电极,1例选择Nucleus 24R(ST)型,仅插入8个作用电极,另1例采用了Nucleus 24R(CA)型耳蜗植入体,插入12个电极;Waardenburg综合征Ⅱ型、Mondini畸形和半规管缺如畸形(耳蜗无异常)的病例和对照组病例均采用常规方法,经圆窗前下用0.8 mm金刚钻钻孔后植入电极,将参考电极安放至同侧颞肌下,逐层关闭术腔。术前半小时及术后6天静脉注射抗生素预防感染,术后应用地塞米松3天以减轻内耳反应。术后7天拆线出院(部分患者采取可吸收缝线则无需拆线,术后4~5天即出院),出院前摄耳蜗位片了解植入物位置。
1.4编程调试及术后言语测听 全部患者均在术后1个月左右开机调试,通过对每个植入电极配置适宜的刺激电流水平并将其编排成图形(又称Mapping),最终获得一个比较理想的舒适阈(C-Level)、听阈(T-Level)和动态范围。Nucleus 24型产品采用ACE编码策略,Med-El C40+产品采用CIS编码策略。
采用香港中文大学的言语识别记分材料在开机6个月后对所有患者行闭合式和开放式词表的言语分辨率测试。
1.5统计学方法 采用SPSS16.0软件对两组术后听力和言语康复情况的差异进行t检验。
2 结果
2.1手术所见及处理 1例共同腔畸形和2例Mondini畸形术中出现井喷,另有10例Mondini畸形、2例Waardenburg综合征Ⅱ型病例在耳蜗钻孔后见外淋巴液明显搏动性涌出。术中升高患者头位,待液体压力稍降低后,采取吸除外淋巴液同时插入耳蜗电极并用筋膜组织牢固封堵开窗口的方法完成植入,未使用甘露醇脱水。
全部病例术后生命体征正常,无面瘫、切口感染、眩晕等并发症,出院前行X线耳蜗位片检查显示耳蜗内电极形态良好。两组病例术后均未发现外淋巴漏或脑膜炎等并发症。
2.2术后听力情况 术后1个月开机后,全部病例均对声音有反应,经3~4次调试后C-Level和T-Level Mapping值达到较稳定状态。术后6个月采用啭音行声场测听,两组病例言语频率听阈均可达30~45 dB HL,其中内耳结构异常组平均听阈35.4±4.9 dB HL,对照组平均听阈31.4±5.5 dB HL,两组比较差异无统计学意义(P>0.05)。
2.3术后言语康复情况 全部患者均参加聋康机构的言语康复训练,开机6个月后患者均掌握了一定的语言能力,说话均较术前清晰。言语识别率测试结果显示:内耳结构异常组闭合式词表言语识别率平均为75.18%±3.1%,开放式词表言语识别率平均为70.32%±2.5%;对照组分别为81.63%±3.7%、76.77%±5.4%,两组比较差异无统计学意义(P>0.05)。
3 讨论
内耳结构异常是导致极重度感音神经性聋的常见病因[2]。先天性内耳畸形(包括耳蜗缺失或畸形、前庭或前庭水管畸形)在重度感音神经性聋患者中的发生率约为20%,后天性内耳结构异常主要为脑膜炎导致的耳蜗骨化或纤维化[3]。由于内耳结构异常(尤其是严重的耳蜗畸形如Mondini畸形或共同腔畸形)患者的螺旋神经节细胞和蜗神经细胞数量减少,对于这部分患者能否从人工耳蜗植入中获益一直存在争议。但近年来随着人工耳蜗植入技术的成熟和对内耳结构异常认识的深入,国内外许多学者进行了有益的尝试并取得了满意的效果[4, 5]。
Waardenburg综合征临床上主要表现为感音神经性聋、白额发或早白发、虹膜异色等一组综合征[4]。根据Farrer等制定的标准将WS共分为4型: I型以额面部表现异常多见,有听力损失者约占25%~58%;Ⅱ型患者无内眦间距离宽等颅面发育异常表现,听力损失者约占50%~87%,Ⅱ型患病率比I型高20~50倍;Ⅲ型为I型伴上臂骨骼发育缺陷;Ⅳ型:Ⅱ型伴Hirschsprtmg病。本组8例WS患者均为Ⅱ型,其内耳高分辨率CT扫描主要提示为半规管发育不良或前庭扩大,1例有耳蜗发育不全(仅见2回)。由于WS表现为先天性极重度感音神经性聋,助听器对听力的补偿效果差,目前认为人工耳蜗植入是最佳的治疗方法。对于耳蜗无明显畸形的患者可采用常规植入方法,从文中结果看,本组中2例WSⅡ型病例术中出现外淋巴液搏动性涌出,可能与前庭扩大导致外淋巴压力增高有关。由于这类患者中有的病例耳蜗发育不全,插入电极时应避免深插。
Mondini畸形早期泛指所有耳蜗畸形,包括轻微的隔板发育不全和共同腔畸形,之后Jackler等依据胚胎的发生学将耳蜗的缺失或畸形进行了进一步的分类[6],鼓阶间隔发育不全(incomplete partition)是最接近经典Mondini畸形的一类。Mondini畸形和共同腔畸形可以行人工耳蜗植入术。本组病例中有12例Mondini畸形和1例共同腔畸形的极重度感音神经性聋患者接受了人工耳蜗植入,其中5例程度较轻病例选择Nucleus 24R弯电极植入体,另7例和1例共同腔畸形采用了Nucleus 24R(ST)和Nucleus 24M型植入体(环形电极)。原因在于严重的耳蜗畸形(如共同腔畸形)无蜗轴结构,残余的螺旋神经节细胞散在分布于耳蜗壁上,因此应该选择环形电极的植入体[7]。这部分耳蜗畸形病例由于脑脊液压力经内听道等直接传入蜗内,术中易出现脑脊液“井喷”现象,本组即有3例(1例共腔畸形和2例Mondini畸形)术中出现井喷,其余的Mondini畸形病例术中均有不同程度的外淋巴液搏动溢出。处理井喷时,一方面可以将手术床摇成头高脚低位,一方面可以用吸引器吸除喷出的脑脊液,待脑脊液压力减低后一般都能从容插入电极。本组1例术中井喷严重,术中将吸引器插在上鼓室砧骨头附近持续吸引,同时将电极插入鼓阶,然后用筋膜严密封堵,术后已4年未发生不良反应。插入电极后用浅筋膜组织呈哑铃型妥善封堵鼓阶开窗口,可以预防术后外淋巴液漏或内耳感染以及脑膜炎等并发症。
耳蜗骨化是较为常见的内耳结构异常,通常可按照病变的范围分为圆窗龛骨化、耳蜗底回骨化和超出底回范围的骨化,还可根据骨化的程度分为完全骨化和纤维化。术中根据耳蜗骨化的程度应采取相应的植入方式:圆窗龛骨化对手术影响较小,采用圆窗龛前下方鼓阶钻孔可避开骨化的区域;耳蜗底回骨化则需要用电钻及显微钩针将耳蜗管腔内骨质清除至骨管通畅,然后植入电极至中回和顶回;若骨化超出底回范围则沿着蜗轴将骨化部位磨出细槽后将电极嵌入骨槽中并用颞肌筋膜覆盖[8]。后一种方法需磨除的范围和深度不易掌握,存在损伤前下方鼓阶与颈内动脉管之间骨壁以及磨穿内听道底而发生井喷的风险,并且目前的观点认为此法术后效果并不理想,因此文中2例耳蜗底回骨化的患者术中扩大鼓阶开窗口,用0.6 mm金刚钻潜行磨除鼓阶内骨化组织,用微型钩针挑除底回骨化区域后向前进入鼓阶第2回,分别植入了8个和12个电极。这两例患者术后啭音声场测听结果显示500 Hz听阈为57.5 dB HL,差于本组其他患者,其原因与植入电极数量较少,对蜗顶螺旋神经刺激较弱有关,但术后言语康复效果无明显差异,可能该区域听力对听声响影响较大,对言语识别率影响较小。因此,对于耳蜗骨化的患者,术前的影像学评估尤为重要,一方面要仔细了解骨化的范围和程度,另一方面应注意在颞骨CT上难以判断耳蜗纤维化的情况下,需要结合薄层MR成像加以辨别9]。术前严格选择病例,仍可获得满意的言语康复效果。
人工耳蜗植入术后听觉反应基于包括蜗轴在内的螺旋神经节细胞的兴奋。目前已知耳蜗底回和1.5回存在神经节细胞, 蜗尖无神经节细胞, 耳蜗发育畸形患者的神经节细胞数少于或等于33 000个, Mondini 畸形者神经节细胞数约为7 677~16 110 个;一般认为神经节细胞数达到约3 300 个时耳蜗植入即可产生效应[7]。本组24例内耳结构异常患者行人工耳蜗植入术后听声效果较对照组无明显差异,推测其原因可能与该组患者耳蜗残留了足够数量的螺旋神经节细胞有关。本研究结果说明,只要术前进行详细的影像学、听力学等评估并合理地筛选病例进行人工耳蜗植入,可以帮助内耳结构异常的极重度聋患者获得听力。
4 参考文献
1 郭梦和, 陈浩, 钱宇虹.柔手术技巧在人工耳蜗植入术中的应用经验[J]. 临床耳鼻咽喉头颈外科杂志, 2009,23:1 045.
2 Kral A,O'Donoghue GM. Profound deafness in childhood[J]. N Engl J Med, 2010,363:1 438.
3 Van Wermeskerken GK, Dunnebier EA, Van Olphen AF, et al. Audiological performance after cochlear implantation: A 2-year follow-up in children with inner ear malformations[J]. Acta Otolaryngol, 2007,127:252.
4 Deka RC, Sikka K,Chaturvedy G, et al.Cochlear implantation in Waardenburg syndrome: The Indian scenario[J]. Acta Otolaryngol, 2010,130:1 097.
5 Loundon N, Leboulanger N,Maillet J, et al.Cochlear implant and inner ear malformation. Proposal for an hyperosmolar therapy at surgery[J]. Int J Pediatr Otorhinolaryngol, 2008,72:541.
6 李永新, 韩德民, 赵啸天, 等.Mondini畸形多道人工耳蜗植入的效果分析[J]. 中华耳鼻咽喉科杂志, 2004,39:89.
7 王林娥, 曹克利, 郑振宇. Mondini内耳畸形患者的多通道人工耳蜗植入[J]. 听力学及言语疾病杂志, 2005,13:83.
8 殷善开, 易红良, 张胜兰,等. 内耳畸形与耳蜗骨化患者的耳蜗植入[J]. 中华耳科学杂志, 2004,3:179.
9 张宏征, 周晓琴, 陈浩, 等.重度听力障碍婴幼儿影像学评估[J]. 实用医学杂志, 2008,24:3 499.
