猪流行性腹泻病毒基因及其疫苗的研究
2010-11-22汤德元李春燕张晓杰甘振磊刘志杰
王 凤,汤德元,李春燕,王 彬,张晓杰,甘振磊,刘志杰
(贵州大学动物科学学院,贵州 贵阳 550025)
猪流行性腹泻(PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起猪的一种急性肠道传染病。猪流行性腹泻病毒属于冠状病毒科(coronaviridae)冠状病毒属(coronavirus)的成员。主要引起猪流行性腹泻。各种年龄、各个品种猪均可感染发病,哺乳仔猪、架子猪、育肥猪的发病率可达100%,成年母猪发病率为15%~90%。其发病特点是:日龄小,症状重,日龄大,症状轻。1 周龄哺乳仔猪常在腹泻3~4 d 后脱水死亡,病死率达50%。断奶猪、育肥猪症状较轻,腹泻可持续4~7 d,成年猪仅发生呕吐和厌食。PEDV 与猪传染性胃肠炎病毒(TGEV)同属于尼多病毒目冠状病毒科冠状病毒属,2 种病毒感染后所引起发病猪的临床症状、流行特点和病理变化都极其相似,均给养猪业带来严重危害。当前PED 发生率居高不下,发病情况也越来越复杂,出现混合感染的现象时有发生,目前倍受广大研究者的重视。本文主要针对PEDV 的基因组结构、功能和PED 疫苗的研究进展进行了综述,为猪流行性腹泻基因的深入研究及对PED的预防提供参考。

1 PEDV的基因结构及功能
PEDV 基因组是单股正链具有感染性的RNA,与其他冠状病毒相似,其基因组5′端有一个帽子结 构(cap),3 ′ 端 有 一 个Poly(A)尾,基因组全长为28 033 nt(PEDV CV777 毒株)。基因组5′端非翻译区(5′UTR)位于复制酶多聚蛋白基因上游,长296 nt;5′UTR 内含有长为65~98 nt 的前导序列(L)和一个AUG 为起始密码子并拥有Kozak 序列(GUUCaugC)和编码12 个氨基酸的开放阅读框架(ORF)。目前,除人冠状病毒HCV229E 外,已知的其他冠状病毒成员都有Kozak 序列,但序列有所差异。基因组3′端非翻译区(3′UTR)长度为334 nt,末端连有Poly(A)序列,3′UTR 内含有由8 个碱基(GGAAGAGC)组成的保守序列,起始于poly(A)上游的73 nt处,所有冠状病毒成员都包含这个序列,只是在基 因组中位置不同。剩余基因组序列包括6 个ORFs(见图1),从5′→3′端依次为编码复制酶多聚蛋白lab(pplab)、纤突蛋白(S)、ORF3 蛋白、小膜蛋白(E)、膜糖蛋白(M)和核衣壳蛋白(N)的基因。复制酶多聚蛋白基因占全基因组2/3,长20 346 nt,包括ORFIa(12 354 nt)和ORFIb(8 037 nt)2 个开放阅读框架,二者之间有46 nt 的重叠序列,重叠处有滑动序列(UUUAAAC)和假结节结构,它们能使核糖体进行移码阅读(frameshifting)从而保证基因l 的正确翻译。S 基因、E 基因、M 基因和N 基因分别编码病毒的结构蛋白,长度分别为4 152 nt、231 nt、681 nt、1 326 nt。ORF3 基因长675 nt,编码非结构蛋白,在每两个相邻基因之间有基因间隔序列(interval sequence,IS),它与基因组和亚基因组mRNA 的L 序列3′端有7~18 nt 相同,在病毒基因组复制和翻译过程中发挥重要作用。
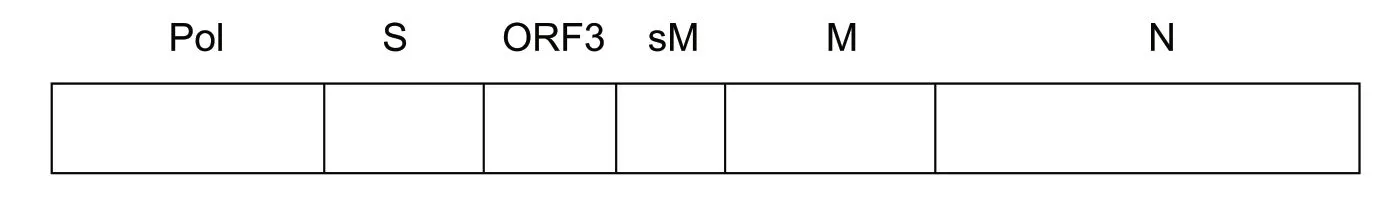
图1 PEDV 基因组结构
1.1 Pol 基因
Pol 基因编码依赖于RNA 的非结构蛋白,即复制酶多聚蛋白1ab(pp1ab),为RNA 多聚酶。复制酶多聚蛋白分子质量约为753 ku,有13 个预测蛋白酶切割位点。PEDV 基因组中S 基因上游除编码多聚酶的基因外并无其它基因。这同缺乏PEDV 相关的血细胞凝集酶活性结果一致。因为,如果冠状病毒基因组存在这样一种基因,它必定总是存在于S 和多聚酶基因之间。多聚酶基因由2 个大的重叠的开放性阅读框架ORF1a(12 354 nt)和ORF1b(8 037 nt) 组 成, 其 中ORF1a 和ORF1b 共有46 个核苷酸 的重叠,重叠区有一特异性7 核苷酸序列(UUUAAAC)和一假结节结构。多聚酶基因翻译成2 个多蛋白前体,即pp1a和pp1ab,较大的蛋白pp1ab 则是通过核糖体移码机制合成,并需要特异性7核苷酸序列和假结节结构。ORFla 主要编码蛋白水解酶,包括分别切割复制酶多聚蛋白N 端和C 端的类木瓜蛋白酶(PL-PRO)和类脊髓灰质炎病毒3C 蛋白酶(3CL-PRO)。PL-PRO 的切割活性对锌具有强依赖性。3CL-PRO 识别底物的核心序列是(ILMF)-Q-I-(SAGC)。另外,ORF1a 编码蛋白还含有3 个转膜域(TM)。ORFlb 主要编码RNA 依赖性RNA 聚合酶(RdRp),同时有3 个蛋白结构域分别是锌指蛋白域(Z)也称金属结合域、螺旋酶域(He1)和保守序列域(C)。
复制酶多聚蛋白经共转译处理后产生与病毒基因组复制相关的一系列蛋白质,主要功能包括负链RNA、前导RNA、sgmRNA( 亚基因组RNA)和子代病RNA 的转录作用以及对多聚蛋白切割产生具有功能产物的蛋白酶切割作用。因此,在病毒感染早期发挥重要作用[2]。
1.2 S(Spike)基因
PEDV S 基因的启动密码子通常并不是用于启动蛋白质的合成,而是翻译分子量为180~220 ku 的1 383 个氨基酸的多肽,即S 蛋白,该多肽含有29个潜在的N-连接的糖基化位点,是PEDV 的1 个重要的结构蛋白,是位于病毒粒子表面的纤突糖蛋白,并有与其他冠状病毒纤突蛋白相似的结构特点。序列同一性比较表明,PEDVS 基因与HCV229E(人冠状病毒)的序列分别有60%(S2 区)和37.0%(S1 区)的同源性;与FIPV(猫传染性腹膜炎病毒)、TGEV、和CCV( 犬冠状病毒)的S 序列分别有59.%~60.0%(S1 区)和35.5%~35.9%(S2 区)的同源性。PEDV 和HCV229E 旁侧序列在迄今所测定的所有S 蛋白基因中都显示了保守性。
S 蛋白在免疫反应中起重要作用,在病毒感染宿主机体后介导中和抗体产生的过程中发挥重要生物学作用,如识别靶细胞、促进病毒和细胞膜融合的作用[3],故S 蛋白被认为是发展有效抵抗冠状病毒的主要靶抗原。
此外,S 蛋白有27~29 个潜在的糖基化位点,在低渗非离子溶剂中溶解度最大。当pH 值为4 时,S 蛋白溶解度最大,而N 蛋白则要求pH 为9。制备的S 蛋白和N 蛋白可用作ELISA 抗原,分别命名为S-ELISA 和N-ELISA。S-ELISA 比N-ELISA 更 为 有 效。感染PEDV 猪血清中的抗S 蛋白抗体比抗N 蛋白抗体更为持久,即可在更长的时间中检测到抗S 蛋白的抗体。
1.3 ORF3 基因
ORF3 基 因 能 编 码ORF3 蛋 白。ORF3 蛋白为223 个氨基酸的多肽,分子质量为25.3 ku,是一种非结构蛋白,其位置在116~784 个核苷酸之间。ORF3 基因编码的产物存在一个含6 个His 的尾。ORF3 基因至少存在3 个可变区,有短的核苷酸缺失(2~7 nt)。对PEDV 的2 个不同分离株CV777 和Br1/87 的测序后发现,这些核苷酸缺失2 个分离株都有。ORF3 序列中还发现了两个功能基序(Motif):精氨酸酶信号肽和ATP/GTP 结合位点。由于ORF3 基因中核苷酸缺失的存在,所以不能通过细胞培养复制ORF3 基因产物。对PEDV CV777 和Br1/87 两个不同分离株的研究发现,虽然有时核苷酸缺失是在相同的位置,但缺失并不总是相同。可以认为,CV777 和Br1/87 起源于相同的病毒群,但以后各自进化了。
Park 等(2007)对PEDV DRl3 强、弱毒的ORF3 序列进行了分析,发现致弱的DRl3 在ORF3 有17 个氨基酸的缺失,为强、弱毒鉴别诊断方法的建立提供了依据。说明ORF3 基因与病毒毒力有关[4]。
1.4 sM(small membrane)基因
sM 基 因 编 码E 蛋 白,E 蛋 白 是PEDV 最小的结构蛋白,由76 个氨基酸组成,预测分子量为8.8 ku,其散在分布于病毒囊膜上,在病毒的自我组装和出芽过程中起至关重要的作用。PEDV 的sM 基因序列与HCV229E 和TGEV 的相比,分别有54%和29%的同源性。PEDV 2 个病毒分离株 CV777和Brl/87 的sM 基 因 严 格 保 守。Northern 杂交分析PEDV 亚基因组RNA 时发现,编码sM 多肽的mRNA同预测的RNA5(成熟的病毒粒子中的第5 个RNA 组分)电泳迁移率相同。目前,研究者将PEDV 的sM 基因和M 基因导入甲病毒载体(pS~FV),在BHK-21 细胞中得到了成功的表达,为进一步探讨E 蛋白和M 蛋白在抗病毒中的作用奠定了基础。
1.5 M(Membrane)基因
M 基 因 编 码M 蛋 白,M 蛋 白 是一种穿膜蛋白,由226 个氨基酸组成,分子量介于27~32 ku 之间。对M基因的序列比较分析表明,PEDV 与HCV229E 和TGEV 的同源性分别为57%和53%。CV777 和Br1/87 核苷酸序列比较分析表明,在M 基因上仅有2 个核苷酸的差异。M 基因非常保守,PCR 检测时PEDV 的引物一般都是针对M 基因而设计的。
M 蛋白在病毒粒子的组装和出芽过程中具有重要作用,同时也是病毒刺激机体产生免疫保护的重要结构蛋白。另外,M 蛋白能介导机体产生干扰素,所以M 蛋白可以作为PEDV 基因工程疫苗的候选基因[5]。因此获得M 基因在体外有效的蛋白表达产物,无论是对PEDV 感染增殖的基础性研究,还是利用M 蛋白进行病原鉴定或疾病免疫预防,均具有重要的理论和实践意义。现已用兔抗肽血清鉴定PEDV M 蛋白,并用杆状病毒进行了表达。
活性的M 蛋白为N-糖基化,分子量约为27 ku,而重组体杆状病毒合成的M 蛋白(相对分子质量)Mr 为23ku,且与未糖基化的M 蛋白有着相同的电泳迁移率。
1.6 N(nucleocapsid)基因
PEDV N 基 因 编 码N 蛋 白。N 蛋白是PEDV 的主要结构蛋白之一,主要作用是形成核衣壳,相对分子量为大小为55~58 ku,由441 个氨基酸组成。对PEDV CV777 和Brl/87 2 个分离株N 基因序列分析发现仅有2 个碱基的差异,用套式PCR 扩增4 个分离株PEDV N 基因540 nt 的片段后发现,其核苷酸序列基本相同。N 基因1 323个核苷酸的序列表明,PEDV 与其他冠状病毒N 基因序列有相当部分相同。但PEDV N 基因明显比HCV229E 和TGEV 大,其中有一段大约135 nt 的潜在插入存在,其可能位于N 基因中央。PEDV 与TGEV、HCV229E 的N 蛋 白的明显不同之处就是在PEDV N 蛋白中央部分有一段接近40 个氨基酸的特别残基,其中富含天门冬酰胺,丝氨酸和精氨酸。N 基因在氨基酸和核苷酸水平上与HCV229E 有很大的同源性,其序列与MHV、IBV、HCV 的同源性为12%~19%,与FIPV、CCV、PRCV、TGEV、HCV229E 的同源性较高,为32%~37%。N 蛋白氨基酸序列比较,PEDV 和HCV229E 有63 个 相 同 的 残基,而和TGEV 有49 个相同的残基。PEDV、TGEV、HCV229E 的N 端 序列的一致性比C 端高。
N 基因处于PEDV 基因组3′端,N 基因的3′端和poly(A)尾之间有一个11 个核苷酸的保守序列,这一序列是病毒复制过程中RNA 负链合成的识别位点。N 基因的5′端也存在一个类似于内部保守基因为7 nt 的序列。N基因还有一个336 个核苷酸的ORF,编码富含Leu 的蛋白。适应细胞生长的PEDV N 基因含有3 个内部开放阅读 框(internal open reading frames,I ORF),分别命名为I-1(113 个密码子),I-2(63 个密码子)和I-3(72个密码子),3 个I ORF 均绝对保守。而牛的冠状病毒(BCV)I ORF (208 个密码子)表达一个与膜有关的23 Ku的蛋白,但其生物学作用仍有待测定。MHV(鼠肝炎病毒)的I ORF (207 个密码子)编码一结构蛋白,该蛋白与病毒复制无关。PEDV 所有3 个I ORF 的共同编码作用与BCV 或MHV 大约相当。野生型PEDV CV777 分离株3′端整个N 基因和非编译区的1 800 个核苷酸序列分析表明,野生型PEDV 同适应细胞生长的PEDV 相似,N 基因下游未发现其他基因。病毒的细胞培养不会导致该基因组区任何核苷酸的变化,然而,适应细胞生长的PEDV 对新生仔猪的致病力是明显减弱了,这证明了该段基因及其基因产物对PED 病毒致弱无关。
不同冠状病毒N 蛋白比较显示:在PEDV N 蛋白中央有相当长的亲水区域。另外N 蛋白除和基因组RNA 缠绕形成核糖核蛋白(Ribonucleoprotein,RNP)复合体外,还参与病毒的复制和转录[6]。N 蛋白等电点高,缺少糖基化和RNA 结合位点,PEDV 完整的N 蛋白等电点为10.5,但C 端50 个残基的等电点很低,仅为3.4,这是由于其C端残基通常是带负电荷或呈中性。病毒感染细胞中N 蛋白较丰富,N 蛋白能与病毒多聚酶作用,或许还有可能同细胞因子作用,从而改变宿主细胞的转录。N 蛋白有6~7 个潜在的磷酸化位点,在pH 9.0 低渗非离子溶剂中溶解度最大。N 蛋白有3 个相对保守的结构域,位于中间的是一个能与病毒RNA 前导列结合的RNA 结合域。
此外,在对冠状病毒一些成员N 蛋白亚细胞定位的研究中表明N 蛋白在细胞核(或核仁)中定位的特征,进而也阐明了N 蛋白的一些功能,N 蛋白作为一个调节蛋白起作用,能够干扰宿主细胞周期,参与细胞通信,N 蛋白还可以抑制干扰素的产生,诱导细胞调亡。而对PEDV N 蛋白亚细胞定位特征的研究还没有报道。N 蛋白在PEDV 的结构蛋白中所占比例最大,在感染的细胞中能得到大量表达。猪在感染PEDV 的早期,体内就能产生抗N 蛋白的高水平抗体。又鉴于其冠状病毒N 蛋白保守性强,所以利用N 蛋白来建立PEDV 分子生物学诊断技术具有很好的应用前景[7]。
2 PED疫苗的研究
对PED 的预防和控制应以接种疫苗为主,国内外的研究者在PED 疫苗的研究方面已经做了大量的工作,但到目前为止还没有研制出特别有效的疫苗可以控制PED 疾病的发生。下面仅就猪流行性腹泻各类疫苗的研究应用现状及前景进行概述。
2.1 灭活疫苗
灭活疫苗包括组织灭活疫苗和细胞灭活疫苗。由于组织灭活苗效果很好,目前应用最为广泛。哈尔滨兽医研究所、上海农科院牧医所和江苏农科院牧医所等单位试生产。王明等[8]用PED沪株研制氢氧化铝灭活苗接种后海穴,以0.1mL/头主动免疫3 日龄仔猪,保护率为77.28%;以0.5mL/头主动免疫接种3~22 日龄猪,保护率为85%;以5mL/ 头被动接种妊娠母猪,其所产3 日龄仔猪的保护率为97.06%。接种疫苗后14d 开始产生免疫力,免疫期可达6 个月。
细胞灭活苗制备方便,应用也越来越广泛。马思奇等[9](1994)研制的氢氧化铝细胞灭活疫苗的主动免疫试验和被动免疫试验的保护率分别为88.89%及90.7%,并研制了猪传染性胃肠炎与猪流行性腹泻病毒二联氢氧化铝细胞灭活疫苗,灭活前毒价均为107.0~107.5TCID50/0.3 mL, 主动免疫保护率:TGE 为100%、PED为92%,被动免疫保护率:TGE 为87.9%、PED 为 82.4%,免疫期均为6个月。疫苗保存期1 年,田间试验保护率92%~96.35%。
2.2 细胞弱毒苗
由于灭活苗产生完全免疫力需要2周时间,且剂量偏大,不利于紧急预防与降低疫苗费用,所以又研制了细胞弱毒苗。国外Park 等[10]将PEDV经 Vero 细胞致弱后的毒株DR13,通过口服和肌肉注射两种途径免疫晚期妊娠母猪,观察所产仔猪的发病率。结果口服免疫组的发病率(13%)远低于肌肉注射免疫组(60%),且口服免疫组仔猪抗PEDV 的SIgA 含量明显高于肌肉注射免疫组。研究表明,可应用PEDV 细胞弱毒苗经口免疫晚期妊娠母猪,从而有效预防PEDV 感染。Kweon 等[11]用分离到的野毒株(命名为KPEDV-9),使之适应Vero 细胞并连续传代至93 代,进行主动免疫试验、被动免疫试验以及安全性试验,结果都证实可作为弱毒苗使用。适应Vero 细胞并连续传代至93 代的KPEDV-9,接种妊娠母猪,ELISA 检测结果表明,母猪免疫应答水平大幅度提高,且新生仔猪可抵抗PEDV 野毒感染。国内佟有恩等[12]用CV777 株强毒株适应Vero细胞系,并在83 代后适应了仔猪肾原代细胞。以104~124 代细胞适应毒制备5 批疫苗,主动免疫试验的总保护率为95.92%;以106~139 代细胞适应毒制备的8 批疫苗,主动免疫试验的总保护率为96.2%。在与TGEV 弱毒组合制备的二联弱毒苗的初步田间试验中取得良好效果。
2.3 乳酸杆菌疫苗
乳酸杆菌作为微生态制剂中的主要益生菌,广泛应用于食品、饲料加工业。构建乳酸杆菌质粒载体,表达在黏膜系统中增殖的病原微生物的保护性抗原基因,制备绿色环保、可食用的多功能黏膜免疫的微生态制剂疫苗应用前景广阔。而黏膜免疫恰恰是防治TGE 和PED 的主要途径。因此,研制刺激肠道黏膜免疫系统的TGE 和PED 基因工程乳酸杆菌疫苗有重要意义。目前,有的实验室正在开展乳酸杆菌表达TGEV、PEDV 主要保护性抗原基因的研究。此研究拟从健康猪体内分离鉴定出乳酸杆菌,并进一步筛选出thyA 基因缺陷型乳酸杆菌,构建含有TGEV 或PEDV主要保护性抗原基因的以thyA 基因为选择压力的非抗性乳酸杆菌表达载体,转化乳酸杆菌,制备基因工程乳酸杆菌疫苗。目前已筛选出2 株thyA 基因缺陷型乳酸杆菌,并已初步鉴定。TGEV、PEDV 的S 基因的克隆扩增工作亦已结束[13]。
2.4 转基因植物疫苗
Yang 等[14](2003)将PEDV 的S基因转入烟草中,提取转基因植物蛋白给小鼠注射,进行血清蚀斑减数中和测定,证明其具有免疫原性。给小鼠饲喂这种转基因植物可诱导小鼠产生全身免疫和黏膜免疫。Yang 等[15](2005)相继应用农杆菌介导的蛋白转入法将PEDV 的S 基因的主要抗原位点(命名为K-COE)和合成的PEDV 中和抗原表位在烟草中表达,前者重组体蛋白占转基因烟草叶片总可溶性植物蛋白含量的0.1%,后者含量则为2.1%。这些研究为研制PEDV 口服转基因植物疫苗提供了新的思路。目前,在以烟草花叶病毒为载体的无烟碱烟草植物中PEDV 的S 蛋白中和表位得到了成功表达,用表达蛋白免疫接种后,对仔猪具有良好的保护作用,为PEDV 转基因植物疫苗的研究奠定了基础。一些研究者将PEDV的E 基因和M 基因导入甲病毒载体中,在BHK-21 细胞中得到了成功表达,这为进一步探讨E 蛋白和M 蛋白在抗病毒中的作用奠定了基础。植物的多种优越性均可被用于研究转基因疫苗,并且已经取得了很大的进展。但仍有一些障碍必须克服,如蛋白在植物中的表达水平低、表达产物在植物中的稳定性差、转基因口服疫苗在产生免疫反应之前在胃肠道内有时被消化等,科学家就这些问题进行了研究并正在加以解决。
2.5 核酸疫苗
核酸疫苗又称为基因疫苗、DNA疫苗,是20 世纪90 年代初从基因治疗研究领域发展起来的一种全新疫苗,与传统的弱毒或灭活疫苗相比,DNA 疫苗具有不散毒、不返强的优点。DNA疫苗还具有可以制成标记性疫苗,便于临床诊断监测;疫苗性质稳定,便于储存和运输;应用范围广,不仅可用于传染病和寄生虫病的免疫预防,而且还能够用于肿瘤、自身免疫、过敏反应等疾病的治疗等优点。另外,与亚单位疫苗相比,具有能长期激发机体体液和细胞免疫反应、制备工艺简单和费用低廉(不用纯化蛋白)的优点。虽然核酸疫苗兼具亚单位疫苗的安全性及减毒活疫苗的有效性,但核酸疫苗也存在整合到宿主染色体、致突变、产生抗菌素DNA 抗体等危险性,其安全性还有待于进一步观察。猪流行性腹泻核酸疫苗的研究还处于起步阶段,是今后研究的热点之一。
2.6 多价联合疫苗
TGEV 和PEDV 均属冠状病毒,致病机理相似,组织嗜性相同。因此,研制联苗亦是可行的。尤其在我国猪病毒性腹泻广泛流行,研制多联苗更是十分必要的。
2.6.1 TGEV 与PEDV 二联疫苗
该系列产品包括猪传染性胃肠炎(TGE)和猪流行性腹泻(PED)二联灭活苗、二联活疫苗和弱毒二联疫苗,二联灭活苗和二联活疫苗是由中国农业科学院哈尔滨兽医研究所的马思奇、佟有恩共同主持完成的。该二联疫苗的特点是:毒价高,后海穴接种(是对常规免疫途径的突破),增强了免疫保护力,一次接种即可,省时、省力。经国内外联机检索查新证明,该二联苗是国际领先研制成功的,并在技术上有原始创新。两种疫苗可用于主动免疫保护不同年龄的猪只,但主要用于妊娠母猪的被动免疫以保护仔猪。其中二联灭活苗主动免疫保护率为96%,被动免疫保护率为85.1%;二联活疫苗主动免疫保护率为97.7%,被动免疫保护率为98%。2种二联疫苗的免疫期均为6 个月,仔猪被动免疫期是哺乳期至断奶后1 周。二联灭活疫苗在免疫后14 d 产生免疫力;二联活疫苗免疫后7 d 产生坚强的保护。PED 和TGE 弱毒二联疫苗是用猪流行性腹泻弱毒疫苗株PEDV-G1P83 和猪传染性胃肠炎弱毒疫苗株TGEV-AG1制成。用该弱毒二联疫苗进行了保存期试验、安全效力、免疫期试验和区域试验。结果表明,试验疫苗在-20 ℃保存4 个月,经4 个月保存的疫苗免疫效力未见下降。4 ℃保存48 h 对疫苗病毒的毒价没有明显影响。用该弱毒二联疫苗按程序免疫妊娠母猪,对妊娠母猪安全,其仔猪获得了良好的被动免疫。其对PEDV 强毒、TGEV 强毒和2 种 强毒混合攻击的免疫效力分别达90.48%、93.75%和87.5%。用二联弱毒疫苗免疫8~10 日龄的哺乳仔猪证明安全,28 日龄时(25 日龄断奶)分别用PEDV强毒、TGEV 强毒和2 种混合强毒攻击,免疫效力分别为100%、99.9%和73.3%。结果表明,该弱毒二联疫苗能够安全地对妊娠母猪和哺乳仔猪进行免疫,免疫后能有效地保护初生仔猪、断奶猪和肥育猪抵抗TGEV 和PEDV 强毒的攻击。该弱毒二联疫苗在区域试验中能显著降低猪病毒性腹泻的发病率和死亡率。
2.6.2 PEDV、TGEV、RV 三 联灭活苗
上海农科院畜牧兽医研究所钱永清等[17]采用猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)和猪轮状病毒(RV)细胞培养物制备了三联灭活疫苗。实验室免疫结果表明,妊娠母猪和育肥猪免疫后15 d 达到较高的免疫水平,免疫有效期超过6 个月,妊娠母猪所产仔猪可获得高水平的被动免疫保护。试验场应用结果表明,母猪保护率达98%,仔猪被动免疫保护率达93%。
综上所述,PEDV 的基因组为不分节段的单股正链RNA。其中Pol 基因在病毒感染早期发挥重要作用,S 基因被认为是发展有效抵抗冠状病毒的主要靶抗原ORF3 基因与病毒毒力有关,sM 基因在病毒的自我组装和出芽过程中起至关重要的作用,M 基因编码的M 蛋白可以作为PEDV 基因工程疫苗的候选抗原,又鉴于冠状病毒N 蛋白保守性强,所以利用N 基因编码的N蛋白来建立PEDV 分子生物学诊断技术具有很好的应用前景。但猪流行性腹泻病毒全基因组结构还需要深入研究。疫苗研制的最佳构想应该包括安全、有效果、多价、成本低及保存和使用方便等,但要达到上述目标还需要一个漫长的过程。PED 疫苗的研究已经取得了一些可喜的进展,随着人们对病毒致病原认识的不断深入,研制的PED 疫苗也在不断完善,相信不久的将来科学家们会研制出特别有效的疫苗来控制PED 疾病的发生。
[1] Brian D A,Baric R S.Corona virus genome structure and replication[J].Curr Top Microbiol Immunol,2005,287:1-30.
[2] Knipe D M,Howley P M,Griffin D E,et a l.Fields virology(5thed)[M].Phi-ladelphia: Lippincott Williams﹠Wilkins,2007:707-736.
[3] Kang T J,Seo J E,Kim D H,et a1.Cloning and sequence analysis of the Korean strain of spike gene of Porcine epidemic diarrhea virus and expression of its neutralizing epitope in plants[J].Protein Expr Purif,2005,41(2):378-383.
[4] H.F.Egberink,J. Ederveen,P.Callebaut,et a1.Characterization of the structural proteins of porcine epizootic diarrhea virus, strain CV777,Am.J. Vet.Res.49(1988):1320-1324.
[5] Fan J H,Li Y J.Cloning and sequence analysis of the M gene of Porcine epidemic diarrhea virus LJB/03[J].Virus Genes.2005,30(1):69-73.
[6] Lee H K,Yeo S G.Cloning and sequence analysis of the nu cleocapsid gene of Porcine epidemic diarrhea virus Chinju99[J].Virus Genes,2003,26(2):207-212.
[7] 余丽芸,侯喜林.流行性腹泻病毒M 基因与甲病毒载体重组RNA 的构建[J].动物医学进展,2005,26(5):73-76.
[8] 王明,马思奇,等.猪流行性腹泻灭活疫苗的研究[J].中国畜禽传染病,1993,(5):17-19.
[9] 马思奇,王明,冯力,等.猪流行性腹泻病毒适应vero 细胞培养及以传代细胞毒制备氢氧化铝灭活疫苗免疫效力试验[J].中国畜禽传染病,1994(2):15-18.
[10] Song DS,Park BK, et al.Oral efficacy of Vero Cell Attenuated Porcine Epidemic Diarrhea Virus DR13 Strain[J].Res Vet Sci,2007,82(1):134-140.
[11] Kweon C H,Kang Y B,Kwon B J,et al.Derivation of Attenuated Porcine Epidemic Diarrhea Virus(PEDV) as Vaccine Candidate[J].Vaccine,1999,17(20/21):2546-2553.
[12] 佟有恩,冯力,马思奇,等.猪流行性腹泻弱毒株的培育[J].中国畜禽传染病,1998,209(6):329-332.
[13] 刘岩,柏亚铎,鲁娜,等.猪传染性胃肠炎和猪流行性腹泻疫苗研究进展[J].2007,41(2):44-45.
[14] Bae J L,Jang YS,Yang MS,et al.Induction of Antigen-specific Systemic and Mucosal Immune Responses by Feeding Animals Transgenic Plants Expressing the Antigen[J].Vaccine,2003,21(25/26):4052-4058.
[15] Kang T J,Jang Y S,Yang M S,et al.Expression of the Synthetic Neutralizing Epitope Gene of Porcine Epidemic Diarrhea Virus in Tobacco Plants without Nicotine[J].Vaccine,2005,23(17/18):2294-2297.
[16] 钱永清,邹勇,唐永兰,等.猪流行性腹泻、猪传染性胃肠炎和猪轮状病毒三联苗免疫试验[J].江西农业大学学报,2005,27(10):107-109.
