猪流行性腹泻诊断方法的研究进展
2010-11-22喻明成甘振磊汤德元李春燕张晓杰刘志杰
喻明成,甘振磊,汤德元,李春燕,王 彬,张晓杰,王 凤,刘志杰
(1.贵州省贵阳市草地生态畜牧发展中心,贵州 贵阳 550330;2.贵州大学动物科学学院,贵州 贵阳 550025)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由套式病毒目冠状病毒科冠状病毒属的猪流行性腹泻病毒(PEDV)引起的猪的一种高度接触性肠道传染病,以水样腹泻、呕吐、脱水和食欲下降为主要特征的传染病。本病有一定的季节性,多发生于冬季12 月至第2 年2 月寒冬季节,但在夏季也可发生。PED 在各年龄的猪均可感染,传播迅速,仔猪死亡率高,给养猪生产造成巨大的经济损失。临床上由于PED 与猪传染性胃肠炎(TGE)的临床症状极其相似,再加上PED 经常与其他腹泻类疾病混合感染,所以仅凭临床症状来确诊PED 较为困难,还需进行实验室诊断。本文主要针对猪的流行性腹泻的流行病学诊断、临床及病理诊断、病原学诊断、血清学诊断和分子生物学诊断等进行阐述,为该病的确诊提供参考。
1 流行病学诊断
猪流行性腹泻发病有一定的季节性,多发生于冬季12 月至第2 年2 月寒冬季节,但在夏季也可发生。该病自1971 年首次在英国暴发以来,相继在比利时、德国、匈牙利、瑞士等许多欧洲国家也都暴发了PED。在1978 年英国和比利时首次报道分离得到该病的病毒,确诊了PEDV 的感染。随后,20世纪80 年代,日本、韩国、中国等一些亚洲国家暴发了猪腹泻病,经荧光抗体试验和血清中和试验诊断为PEDV 感染而导致的猪腹泻。我国于1980 年首次成功分离到PEDV,以后许多地区均有本病发生的报道。各种年龄的猪都能感染发病,哺乳仔猪、断奶仔猪和育肥猪感染发病率达100%,成年母猪为15%~90%,其中,1 周龄哺乳仔猪受害最严重,病死率平均50%,但有时高达90%,但4~5 周龄的哺乳仔猪病死率不高,尤其是无母源抗体的哺乳仔猪不发生或仅发生轻微腹泻,发病率和死亡率都很低。另外,症状的轻重程度会随年龄的大小而有差异,年龄越小的,其症状表现的越重[1]。1 周龄的哺乳仔猪腹泻在2~4 d 内因脱水而死亡,日龄较大的仔猪约1 周后可康复。断奶猪、肥育猪以及母猪常呈现沉郁和厌食症状,持续腹泻4~7 d,逐渐恢复正常。成年猪可能只表现沉郁、厌食和呕吐,一般经4~5 d 即可好转。
2 临床及病理诊断
该病的临床症状主要是发病猪群都呈黄色水样腹泻,体温基本正常,少数病猪出现体温升高l~2 ℃,并带有恶臭气味的稀便等特征。本病的潜伏期长短不一,哺乳仔猪8~36 h,育肥猪1~3 d 或可能潜伏时间更长。其临床症状的严重程度变化较大,主要取决于猪群免疫力及地方流行性。一般猪通常由拉水样粪便、严重脱水和代谢性酸中毒而引起死亡。哺乳仔猪和育肥猪还表现为呕吐、精神沉郁、发病率较高但死亡率低等特点,尤其在育肥后期,大多猪群在7~10 d 后康复,死亡率只有1%~3%,而这种死亡经常在腹泻的早期,剖检病死猪常见背部肌肉坏死。应激敏感性高的猪群发生PED 时死亡率更高。该病的临诊症状与猪传染性胃肠炎(TGE)十分相似,但程度较TGE 轻,在同窝猪群中传播的速度也比TGE 慢得多。解剖猪的腹腔可以观察到小肠内充满了液体,肠道内呈现大量黏样或水样粪便,肠体膨胀,小肠壁变薄,肠系膜充血、水肿,淋巴结水肿,心脏扩张,内脏器官淤血。病猪的组织学变化主要为空肠中后部的小肠绒毛上皮细胞脱落、绒毛变短,但在结肠,未能观察到组织病理学变化。
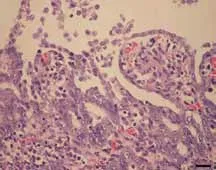
图1 小肠绒毛显著缩短,变得钝圆。
3 实验室诊断
猪流行性腹泻的实验室诊断方法主要包括病原学诊断、血清学诊断和分子生物学诊断法。近几年来,随着分子生物学技术的不断发展,原位杂交技术和聚合酶链式反应诊断技术因其快速、方便、特异性强、敏感和准确等优点已成为实验室最常用的检测方法。同时,病原学诊断和血清学诊断方法也有了很大的发展,经过不断的改进和完善,其诊断方法具备了简单、快速、可重复性强等特点而被广泛应用于实验室诊断。现就以上诊断方法分别叙述如下:
3.1 病原学诊断
3.1.1 病毒的分离与鉴定
通过采集仔猪空肠及肠内容物或刮取空肠及肠内容物在青霉素和链霉素PBS 液中制成5 倍悬液,然后通过离心取上清液经220 nm 微孔滤膜过滤,将滤液接种于Vero 细胞单层上,放在37 ℃培养箱中培养3~4 d,观察细胞有无病变。有病变的细胞可见细胞面粗糙,颗粒增多,有多核细胞,细胞逐渐脱落;或将滤液感染试验仔猪,观察仔猪的病理变化和临床症状,进行回归动物试验。如武三孝[2]将试验仔猪分为A、B、C、D 4 组,A 组是口服加双抗的肠液(剪右耳做标记);B 组口服未加双抗肠液(剪左耳做标记);C 组口服肠管磨碎物(剪双耳做标记);D 组作空白对照组。口服剂量每组均为50 mL 和30 mL 各1 头,48 h 后观察临床症状。回归动物试验可验证所分离的病毒。
3.1.2 免疫电镜法
一般来说,电镜法可以有效的作出病原的诊断,可以通过电镜来观察病毒的结构、形态特征及立体构型等特点。如将感染猪小肠或病毒细胞培养物制成超薄切片在电镜下观察,则可从平面上观察到病毒的内部结构,形态大小,复制方式等。由于TGEV 与PEDV 同属冠状病毒,形状非常相似,在普通电镜下无法区别,为此需要用免疫电镜法(IEM)。IEM 法既可用已知的PEDV 高免血清检测未知抗原,又可用已知的PEDV 抗原检测未知抗体。王继科等[3]把抗原和抗体分别经10 000 g/min 离心,免疫复合物又经12 000 g/min 离心,最后在电镜下直接观察到典型的病毒粒子形成的免疫复合物,建立了具有3 次筛选作用的改良的IEM 法,具有简便、直观、快速和定性正确等优点。但由于需用电镜设备,其价格十分的昂贵,一般的实验室及猪场没有这样的条件,不适合于大规模诊断和临床诊断。
3.2 血清学诊断
3.2.1 免疫荧光法
免疫荧光法(IF)一般分为直接免疫荧光法(FAT)、间接免疫荧光法(IFAT)和免疫过氧化物酶技术,3 种方法都可应用于实验室诊断,但前者较为常用。若IF 或免疫过氧化物酶试验呈阳性,并伴有腹泻症状,则几乎肯定为PEDV、。较常用的是直接免疫荧光法(FAT)检测,是一种比较可靠的特异性诊断方法。在1990 年,崔现兰等应用FAT 检查病猪小肠的冷冻切片或小肠抹片,对PEDV 人工感染仔猪检出率为91.4%,电镜观察阳性率为47.8%。应用间接免疫荧光法(IFAT)对PED 阳性猪血清的检出阳性率为89%[4]。后来,在1997 年,林志雄等用适用于Vero、PK-15 等传代细胞株生长繁殖的PEDV-G1 株直接免疫免疫荧光法,用该方法检测来自有严重腹泻、呕吐和死亡症状的6 个猪场155 份仔猪肠黏膜样品,检出率为52%,并用血清中和试验检测该6 个猪场的PEDV抗体,证实被PEDV 感染过。同时,应用哈尔滨兽研所的荧光抗体方法比较,阳性符合率达95%,阴性符合率90%。并不与猪传染性胃肠炎病毒、猪细小病毒、轮状病毒和大肠杆菌等发生交叉反应。证明该方法具有较高的准确性和特异性、。而朱维正等用间接血凝试验与间接免疫荧光法(IFAT)比较后认为IFAT 法更敏感。
3.2.2 微量血清中和试验
病毒活毒素与相应的抗体结合后,失去对易感动物群的致病力,称之为中和试验。中和试验还可以分为兔体中和试验、荧光抗体病毒中和试验、过氧化物酶联中和试验等。中和试验主要用于:1)从待检血清中检出抗体,或从病料中检出病毒,用于诊断病毒性传染病;2)用抗毒素血清检查材料中的毒素或鉴定细菌的毒素类型;3)测定抗病毒血清或抗毒素效价;4)新分离病毒的鉴定和分型,中和试验不仅可在易感的实验动物体内进行,亦可在细胞或鸡胚上进行。在1994 年,我国的研究工作者林志雄等[5]建立了PEDV 微量中和试验。采用适应于传代细胞生长的PEDV-GI株,以PK-l5(猪肾细胞)作为指示细胞,48 h 判定。研究证实本方法检验准确、可靠、具有较高的敏感性、可用于流行病学调查。
3.2.3 酶联免疫吸附试验(ELISA法)
目前,ELISA 法最大的优点就是可从粪便中直接检查PEDV 抗原,应用较为广泛。但在ELISA 方法出现之前,国外许多学者都是利用培养病毒的方法直接对PEDV 抗体进行检测。如1988年Hofmann 等[6]首次报道将PEDV 适应于Vero 传代细胞培养后,对PED 诊断学方面的研究迅速地有了较大进展,应用于PED 及其抗体检测的诊断试剂制备和检测方法的建立,但由于PEDV适应细胞培养难度大及制备全病毒抗原存在潜在排毒的危险,致使现有的诊断方法仅限于实验室应用阶段尚未能大量应用于临床实践,因而急需一种安全、稳定、快速、易于制备且特异性和重复性均高的新型诊断方法的建立以适用于大批次试样的检测。用ELISA 方法检测PEDV 被大量应用于临床实践中,该法既可用于测定抗原,也可用于测定抗体,是国际贸易指定标准诊断方法之一。根据ELISA 的基本原理,发展出了双抗体夹心法ELISA、竞争阻断ELISA、间接ELISA 以及斑点酶联免疫吸附试验法(Dot-ELISA 法)等诊断方法。
3.2.3.1 双抗体夹心法ELISA
该法属于非竞争结合测定。它是检测抗原最常用的ELISA,适用于检测分子中具有至少两个抗原决定簇的多价抗原,而不能用于小分子半抗原的检测。朱维正(1988)应用双抗体ELISA 法从腹泻病猪粪便中直接检测病毒抗原,首先将特异性抗体包被固相载体上,其次加待检标本,然后加酶标抗体,使形成固相抗体—待测抗原—酶标抗体夹心复合物,最后加底物显色,从而检测标本中抗原的量。其检测结果与电镜检查的阳性符合率为97.37%,阴性符合率为100%。
3.2.3.2 竞争阻断ELISA
该法可用于抗原和半抗原的定量测定,也可对抗体进行检测。在国外,如Rodak L 等[7]利 用PEDV M 蛋 白的单克隆抗体建立了敏感性强、特异性高的竞争阻断ELISA 诊断方法,适于PEDV 流行病学调查;Hou 等[8]利用PEDV 重组N 蛋白抗原建立了检测PEDV 血清的ELISA 方法,为PEDV血清学监测提供手段。Kim O 等[9]建立了单克隆抗体基础上的免疫组化法,该方法可在福尔马林固定、石蜡包埋的肠组织中准确而特异的检出PEDV,可用于鉴别诊断PEDV 与TGEV。
3.2.3.3 间接ELISA
此法是测定抗体最常用的方法,属非竞争结合试验。在国外,Oh 等[10]建立了间接ELISA 诊断方法,与病毒血清中和试验对比证明,该ELISA 方法具有较高的敏感性和特异性,能用于PEDV 的检测。国内对PEDV 的诊断主要代表有于强等[11]在1987 年用PEDV吉毒株猪胎肠单层细胞培养物,以冻融法制备抗原,建立了间接ELISA 法检测PED 抗体的方法。对30 份直接免疫荧光证实的PED 病猪群血清测定,97%为阳性,并证实包被板在-20 ℃可保存2 个月。
3.2.3.4 斑点酶联免疫吸附试验(Dot-ELISA)
该方法是在常规ELISA 方法的使用中不断进行改进和衍化而来的一种新方法。新测定方法的问世,不仅进一步提高了测定灵敏度、特异性,而且使ELISA 技术提高了自动化程度,使其应用更加简便、快速。陈茹等[12]在1997年用分离纯化的PEDV 抗原,建立斑点酶联免疫吸附试验(Dot-ELISA)检测猪流行性腹泻(PED)抗体。采用此方法分别对来自加拿大、中国台湾省进口的种猪和海南省、广东省种猪群的血清样本共834 份进行了检测,检测的抗体阳性率达21%。用琼扩试验与Dot-ELISA 比较,阴性血清样品检测符合率为100%,而阳性血清样品检测符合率为31.8%。说明后者更敏感,且该试验重复性较好。检测试剂在4 ℃保存60 d 以及室温保存30 d,其检测效果基本一致。
3.3 分子生物学诊断
随着科学技术的不断进步,在分子生物学研究领域为猪的流行性腹泻的诊断提供了基因分析的多种方法,很多病毒性疾病都可以通过分子生物学进行有效的诊断,分子生物学诊断技术具有简单方便、准确性高、特异性强、敏感度高、检测速度较快等优点。目前,许多实验室诊断都普遍采用是原位杂交技术(ISH)和聚合酶链式反应(PCR)2 种方法来检测PEDV。ISH 是分子生物学、组织化学及细胞学相结合一种诊断技术;PCR 是一种分子生物学技术,用于放大特定的DNA 片段,还有限制性内切酶谱对病毒特定基因阶段及相对应的蛋白质进行分析,可作出确定的被检病毒在冠状病毒属中的位置。
3.3.1 原位杂交技术(ISH)
原 位 杂 交 技 术(in situ hybridization,ISH)是分子生物学、组织化学及细胞学相结合而产生的一门新兴技术,始于20 世纪60 年代。在20 世纪60 末至70 年代初,美国一些专家Gall 和Buongiorno-Nardelli 等 利用同位素标记的核酸基因探针进行了与细胞或组织基因定位,从而创造了原位杂交技术。原位杂交技术的基本原理是利用核酸分子单链之间有互补的碱基序列,将有放射性或非放射性的外源核酸(即探针)与组织、细胞或染色体上待测DNA 或RNA 互补配对,结合成专一的核酸杂交分子,经一定的检测手段将待测核酸在组织、细胞或染色体上的位置显示出来。为显示特定的核酸序列必须具备3 个重要条件:组织、细胞或染色体的固定、具有能与特定片段互补的核苷酸序列(即探针)、有与探针结合的标记物。Okjin Kim 等[13]利用标记地高辛的核酸探针(0.1 ng/μL)加入的300μL 的标准杂交缓冲液中,在加热板上95 ℃加热10 min 后把组织切片放到冰上淬火。大约有50 ng 的地高辛的核酸探针添插到标准杂交缓冲液中(50 μL)。通过一系列的处理后,标记地高辛的核酸探针可以与人工感染仔猪的PEDV 的核衣壳蛋白基因进行碱基互补配对,通过透射电镜下观察到仔猪的空肠和结肠的上皮细胞的胞质呈黑色。从而可以证明是PEDV 感染的仔猪腹泻。该试验在79 个阳性样本中检测出71 个是阳性的,检出率为91%。另外,该试验还证明,原位杂交技术对于检测福尔马林溶液固定的组织样本较为敏感,其检测效果较好。
3.3.2 PCR 技术诊断
3.3.2.1 反转录多聚酶链式反应法(RT-PCR)
在国外比较有代表性的研究工作者有Ishikawa 等[14]根据S 基因序列设计了一对可扩增目的片段854 bp 的引物,成功的建立了诊断PEDV 的RT-PCR法,可进行细胞毒和粪便毒的检测,灵敏度可达100 TCID50/mL,并可在8 h内测出。尽管此法敏感性和特异性都很好,但由于对仪器设备等要求很高,只能适合于实验室诊断,不能广泛应用于临床诊断。Kim O 等对免疫组化、原位杂交、RT-PCR 3 种方法进行了比较,认为RT-PCR 法检测结果的重复性最好。如Kubota 等[15]以M 基因和N 基因为靶基因建立了RT-PCR 方法来检测PEDV,在粪便样品中能检测到PEDV 的最低含量为100 TCID50;Song 等建立了鉴别诊断PEDV、猪传染性胃肠炎病毒(TGEV)和猪轮状病毒(PORV)的多重反转录PCR(Multi-RT-PCR)为鉴别3 种病毒性腹泻病原的混合感染提供了技术支持,同时又建立了检测PEDV 的实时荧光定量PCR,对仔猪体内PEDV 的病毒载量进行了定量;在韩国Kim O 等已建立了TGEV 和PEDV 的二联RT-PCR诊断方法,可同时检测出10TCID50/mL 的TGEV 和PEDV。但当被检样品为福尔马林固定时,采用免疫组化和原位杂交这2 种方法更适合。在国内,杨群[16]等根据GenBank 上发表的猪流行性腹泻(PEDV)和猪传染性胃肠炎(TGEV)基因序列,针对其PEDV的M(膜蛋白)基因保守区及TGEV的S 基因(纤突蛋白基因)5′端保守区,各设计一对引物,建立了一种用来检测PEDV 和TGEV 的多重RT-PCR的方法,同韩国引进的PEDV 和TGEV病毒抗原快速诊断试剂盒检测结果相比较,该法具有更好的特异性和敏感性。
3.3.2.2 荧光定量PCR
荧 光 定 量PCR(fluorescence quantitative polymerase chain reaction,FQ-PCR)技术是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR 进程,最后通过标准曲线对未知模板进行定量分析的方法。人们主要就是利用PCR 扩增在某一特定扩增时期,扩增产物是指数增长的,那么最终PCR 产物与模板量直接相关的这种特点来进行模板定量。PCR 定量关键是选择好扩增呈指数增长的最佳时机和内部设置扩增模板对照。由于PCR 定量方法是不断放大的过程,使原有模板DNA 细小差异也随之放大。因此PCR 定量技术与常规的Southern、Northern 和点印迹杂交定量相比非常敏感。同时要求反应条件异常严格。该法克服了传统PCR 易污染、后处理步骤繁杂冗长、缺乏准确定量等缺点,具有特异性强、灵敏度高、重复性好、定量准确、速度快、全封闭反应等优点,在PEDV 诊断方面也取得了进展。Kim,S-H 等[17]根据Taq Man 探针荧光定量分析原理,FAM 作为荧光报告基团,Cy5 作为淬灭基团,建立了多重实时荧光定量PCR,为PEDV 和TGEV 病毒载量的检测提供了技术手段,其最低检出量分别为9×101 拷贝/μL 和7×101 拷贝/μL。
3.3.2.3 原位PCR 法(in situ-PCR)原 位PCR 是Hasse 等 于1990 年建立的技术,原位PCR 技术是常规的原位杂交技术与PCR 技术的有机结合,即通过PCR 技术对靶核酸序列在染色体上或组织细胞内进行原位扩增使其拷贝数增加,然后通过原位杂交技术进行检测,从而对靶核酸序列进行定性、定位和定量分析。原位PCR 技术大大提高了原位杂交技术的灵敏度和专一性,可用于低拷贝甚至单拷贝的基因定位,是细胞学科研与临床诊断领域里的一项有较大潜力的新技术。原位PCR 既能分辨鉴定带有靶序列的细胞,又能标出靶序列在细胞内的位置,对于在分子和细胞水平上研究疾病的发病机理和临床过程及病理的转归有重大的实用价值。自建立以来发展快速,将PCR 技术与原位杂交技术结合起来,既可以检测低拷贝的DNA 或RNA,又可特异的确定细胞来源和细胞内定位。
3.3.2.4 巢式PCR 法(nested-PCR)巢式PCR 是1 种变异的聚合酶链反应(PCR),使用2 对PCR 引物扩增完整的片段。第1 对PCR 引物扩增片段和普通PCR 相似。第2 对引物称为巢式引物(因为他们在第1 次PCR 扩增片段的内部)结合在第1 次PCR 产物内部,使得第2 次PCR 扩增片断短于第1 次扩增。巢式PCR 的好处在于:如果第1 次扩增产生了错误片断,则第2 次能在错误片段上进行引物配对并扩增的概率极低。因此,巢式PCR 的扩增非常特异。该法由国外学者Kim L和Chang K O[18]所发明设计,此种方法是针对二者S 基因部分序列的差异性而设计出来的。反转录体系引物是针对于PRCV 的S 基因缺失区而设计,上游引物和下游引物恰好位于PRCV S 基因缺失区两端。这样对样品进行RTPCR反应结果是:如果有PEDV的存在,那么产物应为阳性,在电泳的泳道上可观察到与预先设计一样大小的DNA 片段:反之,则为阴性。此外,Kim O 等还建立了鉴别TGEV 和PEDV 的多重巢式RT-PCR 法。此方法适用于检测福尔马林固定的组织,以原位杂交法作对照,结果显示二者检出率完全一致。
在研究猪流行性腹泻的疾病诊断中,近几年来研究的侧重点主要是ELISA 法和PCR 法,这两种方法以其实用性强、高效、快速、准确而被广泛应用。尤其是PCR 诊断技术,比ELISA 法更加敏感,特异性也较强。不过,由于受到仪器设备的限制,分子生物学的诊断方法目前还不能适合用于临床诊断,此法不能得到有效的推广。但随着研究的不断深入,分子生物学诊断技术具有广阔的应用前景。总之,建立一种对传染病高效、敏感、特异、快速、简单易用而且廉价的诊断方法有待进一步的研究。
[1] 殷震,刘景华主编.动物病毒学(第二版)[M].北京:科学出版社,1997,681-688.
[2] 武三孝.猪流行性腹泻的病原学诊断[J].畜牧与兽医,1998(4):170.
[3] 王继科,刘长明,马思奇,等.猪传染性胃肠炎和猪流行性腹泻病毒的免疫电镜诊断的研究[J].中国畜禽传染病,1991(2):22-26.
[4] C. Chae,O. Kim,C. Choi,[J].Prevalence of porcine epidemic diarrhea virus and transmissible gastroenteritis virus infection in Korean pigs[J].Vet. Rec. 147 (2000)606-608.
[5] 林志雄,李树根,李力复,等.猪流行性腹泻微血清中和试验的建立和应用[J].中国兽医科技,1994,24(11):3-4.
[6] Hofmann M, Wyler R: 1988,Propagation of the virus of porcine epidemic diarrhea in cell culture. J Clin Microbiol 26: 2235-2239.
[7] Rodak L,Valicek L,Smid B,et al.An ELISA optimized for porcine epidemic diarrhea virus detection in faeces. Vet Microbiol[J].2005,105(1):9-17.
[8] H o u X. L,Y u L.Y,L i u J.Development and evaluation of enzyme-linked immunosorbent assay based on recombinant nucleocapsid protein for detection of porcine epidemic diarrhea(PEDV)antibodies.Vet Microbiol[J].2007,123(1-3):86-92.
[9] Kim O,Chae C.Comparison of Reverse Transcription Polymerase Chain Reaction Immunohistochemistry and in situ Hybridization for the Detection of Porcine Epidemic Diarrhea Virus in Pigs [J]Can J Vet Res,2002,66(2):112-116.
[10] Oh J. S,Song D. S,Yang J. S,et al.Comparison of an enzyme-linked immunosorbent assay with serum neutralization test for serodiagnosis of porcine epidemic diarrhea virus infection[J].J Vet Sci. 2005,6(4):349-352.
[11] 于强,王殿瀛,宝华,等.应用ELISA间接检测猪流行性腹泻抗体的研究[J].中国兽医学报.1987,(2):149-154.
[12] 陈茹,罗琼,李树根,等.间接法Do t-EL ISA 检测猪流行性腹泻抗体的研究[J].中国兽医杂志,1997,23(8):11-13.
[13] Okjin Kim,Chanhee Chae.Comparison of reverse transcription polymerase chain reaction,immunohistochemistry,and in situ hybridization for the detection of porcine epidemic diarrhea virus in pigs [J].Can J Vet Res,2002(66):112-116.
[14] Ishikawa K,Sekiguchi H,Ogino T,et al.Direct and rapid detection of porcine epidemic diarrhea virus by RT-PCR[J].J Virol Method,1997(69):191-195.
[15] KDabota S,Sasaki O,Okada N,et al.Detection of porcine epidemic diarrhea virus using polymerase chain reaction and comparison of the nucleocapsid protein genes among strains of the nucleocapsid genes among strains of the virus[J].J Vet Med Sci,1999,61(7):827-830.
[16] 杨群,何孔旺,陆承平.应用多重RTPCR 方法检测158 例猪粪样中的两种冠状病毒[J].中国预防兽医学报,2006(4):431-435.
[17] Seong-Hee Kim,ln-Joong Kim,Hyun-Mi Pyo,et a1.Multiplex realtime RT-PCR for the simultaneous detection and quantification of transmissible gastroenteritis virus and porcine epidemic diarrhea virus[J].Virol Methods,2007,doi: 10. 1016/j, viromet. 2007. 06. 021.
[18] Kim L,Chang K O,Sestak K.Development of a reverse transcription nested polymerase chain reaction assay for differential diagnosis of transmissible gastroenteritis virus and porcine respiratory coronavirus form feces and nasal swabs of infected pigs[J].J Vet Diagn Invest,2000,12(4):385-388.图片摘自:Emerging Infectious Diseases www.cdc.gov/eid 菾 Vol. 15, No. 7,July 2009
