例析离子方程式正误及应试策略
2010-07-19洪建林
洪建林
(姜堰市娄庄中学 江苏 姜堰 225500)
“离子方程式正误判断”是高考热点题型之一,常常在选择题中出现。虽然每年考查的情境不同,但对基本知识和判别的基本功能考查基本没有改变,可谓是“换汤不换药”。所以这类题要熟练把握好有关概念的内涵和外延,要能识破“陷阱”,我们从六个“不清”来归纳总结,便于同学们的复习。
一、客观事实记不清
例1:稀盐酸中加入铁片的离子方程式为:2Fe+6H+=2Fe3++3H2↑
分析:稀盐酸是非氧化性酸,稀盐酸的氧化性是由H+引起的,只能将Fe氧化为Fe2+而不是Fe3+,因此这个离子方程式不符和客观事实,所以正确的离子方程式为:Fe+2H+=Fe2++H2↑
例2:硫化氢通入硫酸亚铁溶液中:H2S+Fe2+=FeS↓+2H+
分析:FeS能溶于稀硫酸,因此这个离子方程式不符和客观事实,不能发生,如果将硫化氢通入硫酸铜溶液中则可发生反应:H2S+Cu2+=CuS↓+2H+,从而得到一个由弱酸制强酸的反例。
对策:这类错误不太常见,遇到这类错误应及时摘录到错题集上的专题处,以便查找和记忆。
二、符号及必要条件分不清
例 3:Na2CO3溶液的显碱性:CO32-+2H2O=H2CO3+2OH-
分析:CO32-水解是分两步进行的,且符号用“⇌”,所以正确的离子方程式为:CO32-+H2O⇌HCO3-+OH-
例4:用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓
分析:可以看出该离子反应前后原子守恒,而且该离子反应前后电荷也守恒,但Fe(SCN)3不是沉淀而是配合物,所以正确的离子方程式为:Fe3++3SCN-=Fe(SCN)3
对策:
1.多元弱酸和强碱组成的正盐,如:Na2CO3、Na2S等,其水解离子方程式一定要分步写,一般只写一级水解即可。
2.一般的离子方程式和制备胶体的反应都用“=”号,发生单水解的盐,加热能促进水解则用“=”,产物要标“↑”或“↓”号,常温下,由于反应较微弱且可逆,离子方程式应用“⇌”号,产物不标“↑”或“↓”号。
3.能发生强烈双水解反应的盐,如:Al3+与HCO3-、CO32-、S2-、HS-、AlO2-;Fe3+与 HCO3-、CO32-组成的盐,其水解程度大,能发生完全水解,应写“=”,产物应标“↑”或“↓”号,需注意的是 Fe3+与S2-发生氧化还原反应,而不是双水解。
三、化学式拆分搞不清
例5:饱和碳酸钠溶液中通入过量 CO2:CO32-+CO2+H2O=2HCO3-
分析:可以看出该离子反应前后原子守恒,而且该离子反应前后电荷也守恒,但生成的NaHCO3以晶体形式析出,不能拆写,同时标上“↓” 号, 所以正确的离子方程式为:2Na++CO32-+CO2+H2O=2NaHCO3↓
对策:离子方程式正误判断最基本的前提是不能违背客观事实,应先判断发生的反应是否是离子反应,再弄清楚各物质是否该拆写。因此,一定要注意:
1.五“不拆”:单质、氧化物、难溶物、难电离物(弱酸、弱碱、水、配离子)、挥发性物质(气体)。
2.非水溶液中进行的反应及某些需加热进行的反应一般不能写成离子方程式。比如:Ca(OH)2与NH4Cl制取NH3的反应、Cu和浓H2SO4加热进行的反应、NaCl固体和浓H2SO4制取HCl的反应等均不能写成离子方程式。
3.氨水作反应物时写成NH3·H2O;作生成物时,若反应条件为加热或反应物是浓溶液的则写为 NH3并标“↑”符号,否则一律写 NH3·H2O。
4.弱酸的酸式酸根, 如:HCO3-、HSO3-、HS-、HPO42-等一般不能拆写,只有强酸的酸式酸根HSO4-在水溶液中才能拆写为 H+和 SO42-形式,在熔融状态不拆。
5.对于微溶物,如 Ca(OH)2等,作为反应物时,若为稀溶液则拆写为离子,若为悬浊液或固体则一律写化学式;作为生成物时不拆写,用化学式表示并标“↓”符号。
6.对于晶体析出,如侯氏制碱法及向饱和的Na2CO3溶液中通入足量CO2的所得NaHCO3晶体应不拆写,并标“↓”符号。
四、守恒原则记不清
例6:氯化亚铁溶液中通入溴水反应的离子方程式为:Fe2++Br2=Fe3++2Br-
分析:Fe2+被 Br2氧化为 Fe3+,Br2自身被还原为Br-,看反应前后原子守恒,但是电荷及得失电子不守恒,所以正确的离子方程式为:2Fe2++Br2=2Fe3++2Br-
对策:离子方程式一定要同时遵循“三守恒”原则:质量守恒、电荷守恒、得失电子守恒(氧化-还原反应)。因此,我们在做题时一定要有守衡的思想,做题时应先判断该反应是否同时遵循了“三守恒”。
五、反应先后分不清
例7:往FeI2溶液中通入少量的Cl2的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
分析:可以看出该离子反应遵循“三守恒”原则,但Fe2+的还原性要比I-弱,所以氯气先氧化还原性强的I-离子,又因为氯气是少量的,Fe2+就不能在被氧化,所以正确的离子方程式为:2I-+Cl2=I2+2Cl-
对策:1.中和反应一般优先发生。如:在NH4HSO4溶液中逐滴加入NaOH溶液时,先发生中和反应,即离子方程式为:H++OH-=H2O;达到中性时,继续滴入NaOH溶液时,则发生NH4++OH-=NH3·H2O 反应 。
2.氧化还原反应中氧化性(还原性)强的微粒先反应。如:在FeBr2和KI的混合溶液中通入Cl2,由参加反应的离子的还原性顺序:I->Fe2+>Br-得到它们的反应顺序为I-最先反应,其次为Fe2+,最后轮到 Br-参与反应。
六、量的问题分不清
例8:往Ca(HCO3)2溶液中滴入几滴NaOH溶液的离子方程式为:

分析:可以看出该离子反应遵循“三守恒”原则,但没有注意到反应物的用量问题,由于NaOH溶液只有几滴,所以相当于NaOH溶液的用量为少量,所以应该以NaOH溶液的用量来写离子方程式及正确的离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O
对策:它包括过量、少量、等物质的量、适量、任意量以及滴加顺序等对离子方程式的影响。
反应物物质的量的关系问题主要包括两个方面的问题。
1.反应物和产物的配比是否正确。
例9:稀硫酸与氢氧化钡溶液反应的离子方程式为:Ba2++SO42-+H++OH-=BaSO4↓+H2O
分析:可以看出该离子反应遵循“三守恒”原则,但稀硫酸是二元强酸,氢氧化钡是二元强碱,反应前后H+、OH-、H2O的配比错误,它们的系数应该的为2。所以正确的离子方程式为:

2.注意过量与不过量中的系数比,反应物之间的互滴是其中的一种形式。书写这类反应的离子方程式时一般以不过量物质电离出的离子的系数比来确定,即“以少定多”。
如有常见这样一些情况下的离子方程式值得注意。
(1)NaHSO4溶液和 Ba (OH)2溶液反应至沉淀完全 1∶1

NaHSO4溶液和 Ba(OH)2溶液反应至中性 2∶1

(2)Na2CO3溶液中滴入盐酸

盐酸中滴加Na2CO3溶液

(3)少量的NaHCO3与足量的澄清石灰水反应

过量的NaHCO3与澄清石灰水反应
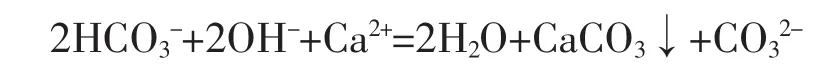
(4)向饱和碳酸氢钙溶液中加入过量或少量氢氧化钙溶液

(5)溴化亚铁溶液中通入少量氯气

溴化亚铁溶液中通入过量氯气

(6)AlCl3溶液中加入少量NaOH溶液

AlCl3溶液中加入过量NaOH溶液

(7)AgNO3溶液中加入少量氨水

AgNO3溶液中加入过量氨水
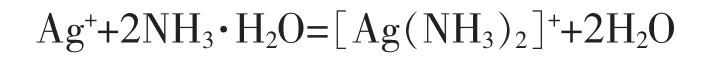
(8)在稀HNO3中加入少量铁粉

在稀HNO3中加入过量铁粉

(9)苯酚通少量或过量CO2

(10)Mg(HCO3)2滴加过量澄清石灰水

(11)碳酸钠溶液中通入过量SO2

碳酸钠溶液中通入少量SO2

(12)明矾与足量 Ba(OH)2反应

明矾与少量 Ba(OH)2反应

(13)向偏铝酸钠溶液中通入少量CO2

向偏铝酸钠溶液中通入过量CO2

(14)向CuSO4溶液中滴加少量的氨水

向CuSO4溶液中滴加过量的氨水

(15)漂白粉溶液中通入少量的二氧化碳
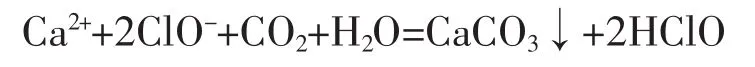
漂白粉溶液中通入过量的二氧化碳:

(16)少量或过量H2S通入FeCl3溶液中

(17)FeCl3溶液中滴加少量Na2S溶液

FeCl3溶液中滴加过量Na2S溶液

