Toll样受体 4在脑梗死损伤中的作用及其与 TNF-α的动态相关性研究
2010-03-21奉俊敏李少明
奉俊敏,郭 伟,李少明
(广州医学院第一附属医院神经内科,广东 广州 510120)
脑梗死缺血性损伤机制错综复杂,其中炎性损伤机制研究备受瞩目,各种炎性细胞的激活,细胞因子、炎性递质的释放,共同造成或加重缺血性损伤,而炎性受体的表达及激活是关键环节之一。Toll样受体 4(Toll-like Receptor4,TLR4)作为跨膜信号转导受体,最初被认为介导细菌内毒素(LPS)诱导的炎症反应,但随着研究的深入,发现 TLR4参与脑缺血再灌注炎性损伤[1-2]。试验证实脑梗死急性期TLR4表达上调,血清炎性因子显著升高[3],但两者在脑梗死病程中的动态相关性研究,国内外少见文献报道。本文运用 RT-PCR法、ELISA法测定脑梗死发病第 1天、第 2天、第 7天外周血单个核细胞(淋巴细胞、单核细胞)TLR4 mRNA表达及血清 TNF-α浓度,进一步探讨 TLR4在急性脑梗死缺血炎性损伤中的作用。
1 资料与方法
1.1 研究对象 于 2009年 1月至 2009年 9月,收集在发病第 1天内收住广州医学院第一附属医院神经内科的急性脑梗死患者 35例,动态观察 7 d,对其进行发病第 1天、第 2天、第 7天三个时间点的外周血淋巴细胞、单核细胞 TLR4 mRNA表达与血清 TNF-α水平动态测定。所有病例均符合 1995年全国第四届脑血管病学术会议制定的诊断标准,并且入院 3 d内经 MRI证实。有下列情况之一者排除:(1)发病前两周有炎性病变史或住院时发生感染性疾病者;(2)急性心肌梗死者;(3)急性肝缺血病变者;(4)自身免疫性疾病者;(5)使用激素或免疫抑制剂者;(6)不依从或不能完成本课题涉及指标测定者。收集同期性别年龄匹配的广州医学院第一附属医院老年科体检健康者 20例作正常对照组;收集同期性别年龄匹配的来广州医学院第一附属医院就诊的脑动脉粥样硬化患者和(或)冠状动脉粥样硬化患者 20例作动脉粥样硬化组。
1.2 试剂与仪器 Trizol(intrivogen公司),M-MuLV逆转录酶(200 U/μl)、Olig(dT)18、RNA酶抑制剂 (20 U/μl)、10 Mm dNTPMix、5×反应 Buffer(MBI公司 ),DNaseⅠ 、Taq DNA Polymerase、PCR Mark(大连宝生物工程有限公司),DEPC(Sigma公司),引物(上海博亚生物公司),人 TNF-αELISA试剂盒(北京晶美试剂公司),其他试剂均为国产分析纯。PCR热循环仪(Techne公司),全自动紫外分光光度仪(Perkin Elmer公司),电泳凝胶图像分析仪(Tanon公司),高速低温离心机(Universal公司)。
1.3 标本处理 取禁食 12 h以上清晨空腹肘静脉血 8 ml,6 ml静脉血肝素(50 U/ml静脉血)抗凝,摇匀,选用 Ficoll分层液法分离得到单个核细胞,2 ml静脉血不抗凝,室温下凝固后分离血清,-20°C下冷冻保存备用。
1.4 RT-PCR 总 RNA按照 intrivogen公司试剂盒说明书进行抽提与纯化,并经 DNaseⅠ处理。逆转录反应按照 MRI公司试剂盒说明书进行。TLR4引物设计参照 Helen等[4]文献,上游引物为:5′TGGATACGTTTCCTTATAAG 3′;下游引物为 :5′GAAATGGAGGCACCCCTTC 3′。 TLR4的 PCR扩增片断为 507 bp。内参为 β-actin,内参引物由上海博亚生物公司设计,上游引物为:5′GGGACCTGACTGACTACCTCAT 3′;下游引物为 :5′CAAGAAAGGGTGTAACGCAAC 3′。 β-actin的 PCR扩增片断为610 bp。TLR4与内参 β-actin同管扩增,PCR反应条件为:预变性 :94°C 5 min;循环 28次:95°C 45 s,54°C 45 s,72°C 60 s;终末延伸 :72°C 10 min。
1.5 琼脂糖凝胶电泳及半定量 取 PCR产物5μl,加 6×载样缓冲液 1μl,在含有 0.5μg/ml EB的 1.2%琼脂糖凝胶中电泳 55 min,恒压 110 V。凝胶图像分析系统测量出 TLR4、β-actin的平均光密度值,两者的比值作为衡量 TLR4 mRNA表达高低的相对值。
1.6 血清 TNF-α浓度测定 采用双抗体夹心 ABC-ELISA法,按照晶美公司人 TNF-αELISA试剂盒说明书进行检测。
1.7 脑梗死患者梗死体积计算 35例脑梗死患者均在发病 3 d内行头部 MRI检查,根据 MRI(DWI序列)结果,采用多田公式计算脑梗死体积(脑梗死体积 =π/6×长 ×宽 ×MRI阳性扫描层数×层厚),由两名放射科医生分别进行,取其平均值。
1.8 脑梗死体积分组 依据发病第 3天脑梗死体积大小将 35例脑梗死患者分为三组[5],≤4 cm3为小梗死组,>4 cm3、<10 cm3为中梗死组,≥10 cm3为大梗死组。
1.9 统计学处理 实验测定的计量资料数值用均数 ±标准差(x±s)表示。多个独立样本均数间的两两比较用 one-way ANOVA及基于此的 q检验,TLR4 mRNA与 TNF-α的相关性用 pearson相关分析。以 P值 <0.05为差异有统计学意义。所有数据使用 SPSS11.5软件包进行统计分析。
2 结 果
2.1 脑梗死组(第 3天)、动脉粥样硬化组、正常对照组中的外周血单个核细胞 TLR4 mRNA表达及血清 TNF-α浓度比较见表 1。
TLR4 mRNA、血清 TNF-α在脑梗死组的水平明显高于动脉粥样硬化组和正常对照组,差异有统计学意义(P<0.01)。

表1 脑梗死组(第 3天)、动脉粥样硬化组、正常对照组中的TLR4 mRNA表达水平及血清 TNF-α浓度比较(x±s)
2.2 脑梗死组(第 3天)外周血单个核细胞TLR4 mRNA表达与血清浓度 TNF-α呈正相关,相关系数为 0.846(P<0.01)。
2.3 不同脑梗死体积组的外周血单个核细胞TLR4 mRNA表达及血清 TNF-α浓度差异比较见表2。
脑梗死三组之间,TLR4 mRNA表达水平及血清TNF-α浓度差异有统计学意义(P<0.01),脑梗死体积越大,TLR4 mRNA表达及血清 TNF-α浓度越高。

表2 不同脑梗死组中的 TLR4 mRNA表达及血清TNF-α浓度比较(x±s)
2.4 脑梗死患者 TLR4 mRNA表达与血清 TNF-α水平动态变化。在发病 24 h内入院并连续完成三个时间点观察的急性脑梗死患者 35例,对其进行周围血淋巴细胞和单核细胞的 TLR4 mRNA表达与血清 TNF-α浓度动态变化观察,时间点依次为第 1天、第 3天、第 7天,结果表明:
(1)脑梗死患者的 TLR4 mRNA动态表达大致呈上升趋势 (见表 3、图 1、图 3)。第 1天的 TLR4 mRNA表达与第 3天、第 7天的 TLR4 mRNA表达水平比较差异有统计学意义,第 3天的 TLR4 mRNA表达水平与第 7天的 TLR4 mRNA表达相近,差异无统计学意义。发病第 1天 TLR4 mRNA与正常对照组相比,即有明显升高趋势(上升 1.71倍),第 3天大幅度上调至高表达水平,第 7天与第 3天的表达水平大致呈平台期。
(2)脑梗死患者的血清 TNF-α动态浓度亦呈上升趋势(见表 4、图 2)。第 1天的血清 TNF-α浓度与第 3天、第 7天的血清 TNF-α浓度比较,差异有统计学意义,第 3天的血清 TNF-α浓度与第 7天的血清 TNF-α浓度比较差异有统计学意义。血清 TNF-α浓度在发病第 1天比正常组略有升高(上升 0.81倍),第 3天呈大幅度升高趋势,第 7天的血清 TNF-α浓度最高。
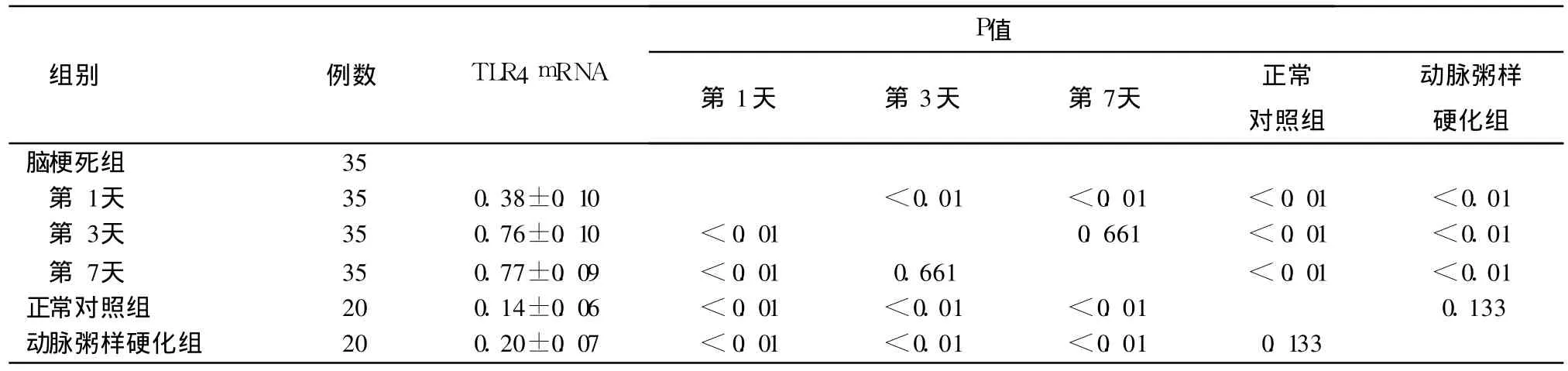
表3 脑梗死组患者第 1天、第 3天、第 7天的动态 TLR4 mRNA表达及与正常对照组、动脉粥样硬化组比较(x±s)
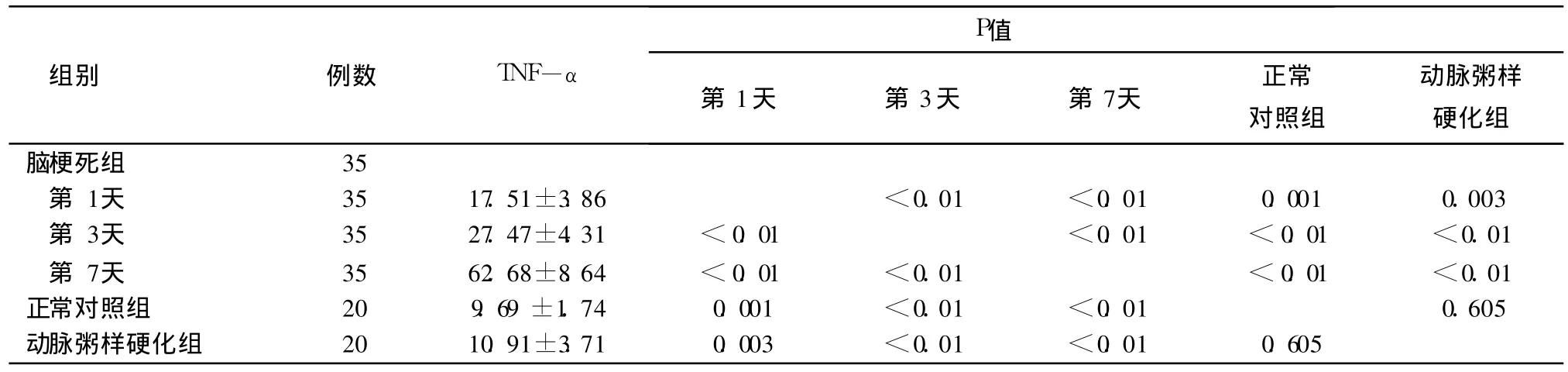
表4 脑梗死组患者第 1天、第 3天、第 7天的动态 TNF-α水平及与正常对照组、动脉粥样硬化组比较(x±s)

图1 脑梗死患者的第 1天、第 3天、第 7天动态TLR4 mRNA表达变化及与正常对照组、动脉粥样硬化组的比较
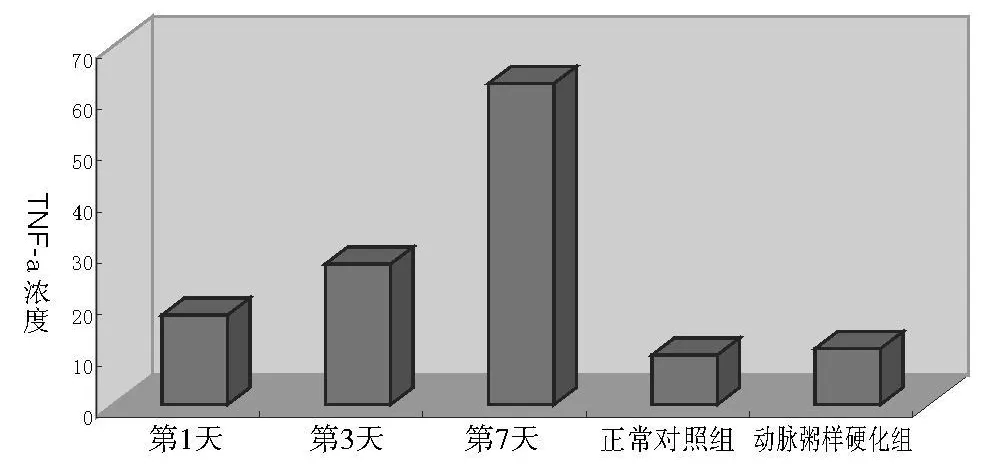
图2 脑梗死患者的第 1天、第 3天、第 7天动态血清 TNF-α浓度变化及与正常对照组、动脉粥样硬化组的比较

图3 发病第 1天、第 3天、第 7天不同时间点与正常对照组、动脉粥样硬化组的 PCR产物1:正常对照组2:动脉粥样硬化组3:发病第 1天患者 507bp处为 TLR 4扩增产物4:发病第 3天患者 610bp处为 β-actin扩增产物5:发病第 7天患者
3 讨 论
脑梗死后坏死及缺血区域因急性缺血而触发炎性瀑布反应,导致过度的炎性损伤,成为神经元死亡的重要机制之一。TNF-α是脑缺血炎性损伤机制中的重要效应因子。本试验对急性脑梗死病程的动态观察研究表明:TNF-α在脑梗死急性期(7 d内)呈上升趋势,第 7天最高;而且,梗死面积越大,血清TNF-α浓度越高;脑梗死体积与血清 TNF-α呈正相关。提示 TNF-α在缺血病理损伤机制中发挥着强大的致炎作用。但 TNF-α仅是炎性损伤机制链条末端的效应环节,它的上游启动环节及促使它被产生、分泌的始发因素值得进一步去探索。
Toll样受体(TLRs)是一个介导天然免疫的古老家族,是历经数亿年演化而仍然保存的宿主防御机制之一。自 1998年 Poltorak等[6]发现了 TLR4以来,其作为炎性跨膜受体在感染性疾病研究领域中已是热点。然而,近年来 TLR4基因敲除鼠的缺血模型实验[7-9]表明:TLR4参与心肌、肝脏缺血炎性损伤机制,并与炎性因子的产生紧密相关。本试验结果表明 TLR4 mRNA在脑梗死组中的表达上调,TLR4 mRNA在脑梗死患者组的表达水平明显高于动脉粥样硬化组和正常对照组,脑梗死体积越大,TLR4 mRNA表达越高。脑梗死体积与周围淋巴、单核细胞 TLR4 mRNA表达呈正相关。
TLR4在外周血淋巴细胞、单核细胞、巨噬细胞膜上表达丰富。中枢神经系统表达 TLR4的主要细胞是小胶质细胞[10],它在炎性状态下被激活后发挥强有力的致炎作用,TLR4是小胶质细胞执行免疫功能作用的关键信号转导受体之一[11]。同时在脑血管内皮细胞、软脑膜、脉络丛、穹隆下器、终板的血管性器官及正中隆起、最后区等处也发现表达[12]。而脑缺血病理损伤中小胶质细胞、巨噬细胞、淋巴细胞、单核细胞是 TNF-α产生分泌的主要来源之一[13]。脑梗死时,缺血缺氧所促发的血管内皮通透性改变,脑组织坏死物质的释放,吸引外源性的单核/巨噬细胞、淋巴细胞趋化、聚集,成为加剧炎性损伤的效应细胞,这些细胞均有丰富的TLR4表达。基于上述认识,可以认为 TLR4 mRNA表达和 TNF-α产生、分泌均源于相同的细胞,有共同的物质基础。
本实验对 35例 24 h入院的急性脑梗死患者外周血淋巴细胞、单核细胞的 TLR4 mRNA表达及血清TNF-α浓度进行第 1天、第 3天、第 7天的动态观察,两者在急性期均呈上升趋势,而 TLR4 mRNA的表达在发病的第 1天即明显升高,血清 TNF-α浓度仅略比正常组高;第 3天 TLR4 mRNA表达达到较高水平时,TNF-a的浓度才呈大幅度的上升趋势;第 7天 TLR4 mRNA持续在高水平的平台期时,TNF-α仍在继续升高,并且达到 7 d内的最高值。尽管我们仅对脑梗死急性期 7 d内的有限三个时间点做了粗略动态观察,不能推测第 7天后 TLR4 mRNA表达和 TNF-α浓度的升降,但该结果仍然体现了两者上升的大致变化轮廓。急性脑梗死患者外周淋巴细胞、单核细胞的 TLR4 mRNA表达变化规律目前在国内外少见报道。第 3天的 TLR4 mRNA表达与TNF-α浓度相关性研究显示:两者呈正相关,具有统计学意义。上述结果提示 TNF-α的产生、分泌可能与 TLR4 mRNA表达存在着密切联系。已有研究[14]证实内毒素血症模型的 TLR4基因缺陷鼠心肌中 TNF-αmRNA表达缺如,而正常鼠心肌中 TNF-αmRNA表达迅速增高,两者的表达差异,揭示了TLR4与炎症因子 TNF-α之间的因果关系。TLR4作为重要炎性受体,介导炎性损伤,其机制[15]可能为启动胞内信号转导,通过 NF-κB(核因子 -κB)和 JNK(c-Jun氨基末端激酶)/SAPK(应急激活蛋白激酶)两条途径,激活炎性细胞,导致炎性因子:IL-1、IL-6、IL-8、IL-12、NO、PAF、PGs和粘附分子等的大量表达,触发一系列炎性反应。而上述炎性因子也正是脑缺血炎性损伤中的效应分子。由本试验中 TLR4 mRNA表达和 TNF-α浓度的动态变化趋势可知:第 3天 TLR4 mRNA表达已达较高水平,TNF-α浓度第 7天才达最高,时间上滞后于TLR4 mRNA。由此推测:在脑缺血损伤炎性病机制中,TLR4 mRNA表达增加有可能是 TNF-α产生、分泌增多的上游启动环节,从而参与介导脑缺血炎性损伤。
当然,TLR4促使 TNF-α产生、分泌仅是 TLR4强大炎性机制中的一部分,TLR4的表达及功能状态与炎性损伤程度存在紧密联系。如果在合适的时间窗内能从 TLR4的水平阻断其下游炎性瀑布效应,将会有效遏制脑缺血炎性损伤。TLR4既是人体的天然免疫防御机制,又参与过度炎性损伤。探索TLR4在急性脑梗死缺血炎性损伤中的作用机制,将为临床提供治疗靶点。
[1] Cao CX,Yang QW,Lv FL,et al.Reduced cerebral ischemiareperfusion injury in Toll-like receptor 4 deficient mice[J].Biochem Biophys Res Commun,2007,353(2)∶509-514.
[2] Yang QW,Li JC,Lu FL,et al.Upregulated expression of toll-like receptor 4 in monocytes correlates with severity of acute cerebral infarction[J].J Cereb Blood Flow Metab,2008,28(9)∶1 588-1 596.
[3] 奉俊敏,刘运海,申向民.急性脑梗死患者 TLR4 mRNA表达与TNF-α相关性研究[J].中华神经医学杂志,2005,5(2)∶149-151.
[4] Helen,Shah PK,Faure E.Toll-Like receptor-4 is expressed by macrophages in murine and human lipid-rich atherosclerotic plaques and upregulated by oxidized LDL[J].Circulation,2001,104(25)∶3 103-3 108.
[5] Pullicion P.Small deed infarctsdiagnosed on computed tomorgraph[J].Neurology,1980,30∶1 890-1 896.
[6] Poltorak A,Xialong H,Smirnoval I,et al.Defective LPSsiganaling in C3H/Hej and C57BL/10ScCr mice:mutation in TLR4 gene[J].Science,1998,282(5396)∶2 085-2 088.
[7] Oyama C,Blais J,Liu X,et al.Reduced myocardial ischemiareperfusion injury in Toll-like receptor 4-deficient mice[J].Circulation,2004,109(6)∶784-789.
[8] Zhai Y,Shen XD,Connell R,et al.Cutting Edge:TLR4 activation mediates liver ischemia/reperfusion inflammatory response via IFN regulatory factor 3-dependent MyD88-independent pathway[J].JImmunol,2004,173(12)∶7 115-7 119.
[9] Wu HS,Zhang JX,Wang L,et al.Toll-like receptor 4 involvement in hepatic ischemia/reperfusion injury in mice[J].Hepatobiliary Pancreat Dis Int,2004,3(2)∶250-253.
[10]Seija L,Leon M,Pamela F,at el.Activation of innate immunity in the CNS triggers neurodegeneration through a Toll-like receptor 4-dependent pathway[J].PNAS,2003,100(14)∶8 514-8 519.
[11]Cornelia S,Manfred PD,Sieghart S.HIV-infection of the central nervous system:the tightrope walk of innate immunity[J].Molecular Immunology,2005,42(2)∶213-228.
[12]Nathal L,Serge R.Toll-like receptor 4:the missing link of the cerebral innate immune response triggered by circulating gramnegative bacterial cell wall components[J].The FASEB Journal,2001,15(2)∶155-163.
[13]Zhai QH,Futrell N,Chen FJ.Gene expression of IL-10 in relationship to TNF-alpha,IL-1 beta and IL-2 in the rat brain following middle cerebral artery occlusion[J].J Neurol Sci,1997,152(1)∶119-124.
[14]程姝娟,薛 桥,王士雯.Toll样受体 4在内毒素血症小鼠心肌TNF-α表达中的作用初探[J].中华老年多器官疾病杂志,2004,3(1)∶37-40.
[15]Chong AJ,Shimamoto A,Hampton CR,et al.Toll-like receptor 4 mediates ischemia/reperfusion injury of the heart[J].J Thorac Cardiovasc Surg,2004,128(2)∶170-179.
