FOLFIRI方案对晚期胃癌二线治疗的临床观察
2009-01-30朱梁军冯继锋潘良熹
朱梁军, 李 晟, 冯继锋, 陈 嘉, 潘良熹
胃癌是全球死亡率居第二位的常见消化道恶性肿瘤[1]。目前,胃癌的早期诊断技术有了很大的提高,但仍有很多患者就诊时已失去手术机会。即使是手术,仍有一半以上的术后患者会出现复发或远处转移。以化疗为主的综合治疗能明显延长晚期胃癌患者的生存期, 并改善其生活质量[2]。对晚期胃癌尚没有标准治疗方案,5-Fu和铂类药物的联合化疗是目前公认的一线治疗方案。晚期胃癌一线方案治疗失败后,以CPT-11和5-Fu联合为主的FOLFIRI 方案是美国NCCN目前推荐的二线方案。为进一步了解FOLFIRI方案对我国晚期胃癌患者的治疗效果,我院肿瘤内科2004年5月至2008年12月采用FOLFIRI 方案二线治疗晚期胃癌38例,取得了一定疗效,现总结报告如下。
1 资料与方法
1.1 病例选择 38例患者为2004年5月至2008年12月经组织学或细胞学证实的晚期胃癌患者,男性21例(55.3%),女性17例(44.7%);年龄29~70岁,中位年龄 52岁;全部为复治病例, 既往曾接受过草酸铂或泰素蒂为主的联合化疗。所有患者均有经CT检查证实的可测量的病灶。ECOG评分0~1分者27例(71.1%),2分者11例(28.9%)。预计生存期>3个月,治疗前血常规、心电图大致正常,肝肾功能≤正常值1.5倍。
1.2 一般资料 胃癌38例,包括低分化腺癌28例(73.7%)(其中黏液细胞癌22例,伴部分为印戒细胞癌17例),中到高分化腺癌10例(26.3%)。所有患者均为复治病例, 其中11例(28.9%)曾接受FOLFOX方案作为一线治疗,22例(57.9%)接受mDCF方案(草酸铂、泰素蒂、5-Fu)为一线治疗,5例(13.2%)接受EOX(表阿霉素、草酸铂、希罗达)方案为一线治疗。伴一个部位转移的患者24例(63.2%),2个及2个以上转移部位的患者14例(36.8%)。最常见转移部位为腹腔淋巴结(25例,65.8%),其次为肝脏(21例,55.3%)、肺部(9例,23.7%)、其他(3例,7.9%)。
1.3 治疗方法 FOLFIRI方案:CPT-11给药剂量按180 mg/m2,第1天静滴30 min;CF 200 mg/m2,第1~2天静滴2 h;5-Fu 400 mg/m2,第1~2天静脉推注;5-Fu 600 mg/m2,第1~2天持续静滴22 h。每 2周为1个周期。阿托品不作为常规治疗前用药,每个患者在FOLFIRI方案治疗前使用5TH3受体拮抗剂预防呕吐,易蒙停作为预防腹泻药物备用。每3个周期后进行CT检查评价客观疗效。
1.4 剂量调整 每个治疗周期前进行仔细的体格检查、血常规和生化检查。按NCI-CTCv2.0版标准进行毒副反应评价,如果出现Ⅳ度血液学或Ⅲ度以上非血液学毒性(腹泻)反应,则药物剂量在下1周期减少25%。连续2个周期出现Ⅳ度血液学或非血液学毒性,则停止治疗。
1.5 评价标准 近期疗效按实体瘤疗效评价标准(RECIST)统一评价,分完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),有效率RR=CR+PR,临床获益率CBR=CR+PR+SD。毒副反应按NCI-CTCv2.0版标准分为0~Ⅳ级。
1.6 统计方法 总生存期(OS)的计算:从开始治疗至死亡或末次随诊时间。疾病进展时间(TTP)的计算:自开始治疗至肿瘤复发或进展的时间。用SPSS10.0软件包进行统计学处理,等级资料用秩和检验,分类资料均以百分率进行描述,用 Kaplan-Meier法绘制生存曲线。
2 结果
2.1 疗效 全组患者共接受192个周期治疗,平均每个患者治疗5个周期。有9个患者进行治疗剂量调整(41个周期),38例患者均可评价疗效和毒性反应。全组没有完全缓解患者,有7个患者达到PR,总有效率达18.4%,10例患者达SD(26.3%),总有效率DCR为44.7%,21例患者PD(55.3%)。中位随访时间为10.2(3~23)个月,中位疾病进展时间(TTP)为3.4个月,见图1。在FOLFIRI方案治疗失败后,有36例患者接受了三线治疗,其中18例给予XP方案(希罗达加顺铂)联合化疗;5例患者接受FOLFIRI+爱必妥进行靶向治疗,13例患者单药希罗达或S-1口服治疗。至2008年6月为止,有31例(82%)患者死亡。中位总生存时间(OS)为 9.1个月,见图2。

图1 疾病进展时间(TTP)
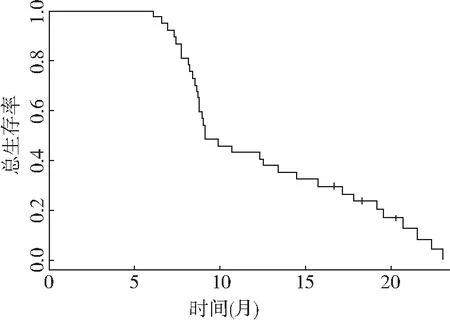
图2 总生存时间(OS)
2.2 毒副反应 本组38例患者未出现药物毒性反应所致的死亡。常见副反应为血液学毒性和消化道反应。血液学毒性主要为贫血、中性粒细胞下降。尤以贫血较常见,但严重者并不多见(见表1)。
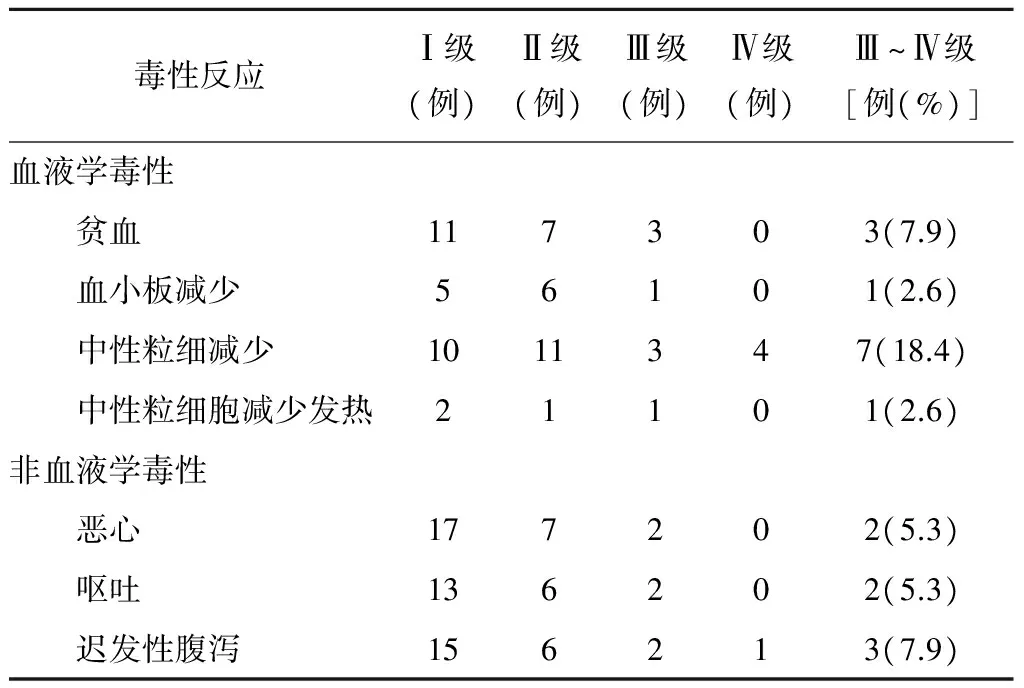
表1 38例患者化疗的毒副反应
2.3 毒副反应的处理 开普拓的剂量限制性毒性为迟发性腹泻和骨髓抑制。迟发性腹泻常在用药24 h后发生,于第 1次稀便发生后立即口服易蒙停4 mg,以后每2 h口服2 mg,直至腹泻停止,一般口服不超过24 h。对Ⅲ~Ⅳ度腹泻患者加用善得定皮下注射抑制肠道分泌,并及时补充水和电解质,防止出现水、电解质平衡紊乱。同时加用喹诺酮类抗生素,防止出现肠道菌群紊乱。对骨髓抑制患者及时应用细胞集落刺激因子(G-CSF),如出现中性粒细胞下降引起发热则须用抗生素对症治疗。
3 讨论
晚期胃癌治疗预后差,目前尚没有标准的一线治疗方案,常用的一线治疗药物有5-Fu、顺铂、泰素蒂和紫杉类等药物,总有效率37%~51%,总生存期9~14个月[2]。如果一线治疗失败则需寻找与一线治疗无交叉耐药性的二线治疗药物。临床研究表明,对身体功能状态较好,转移部位相对较少的患者,与最佳支持治疗相比,二线治疗能够更好地改善患者的生存质量和延长患者的总生存期,给患者带来生存受益[3]。
伊立替康(CPT-11)是一种新型的抗肿瘤药物。该药为特异性的 DNA拓扑异构酶Ⅰ(Topo-1)抑制剂,通过阻止DNA复制及抑制RNA的合成,从而引起细胞死亡达到抗肿瘤的目的[4]。CPT-11进入体内迅速被转化为活性代谢产物 SN-38,SN-38抗肿瘤作用比CPT-11高100~1 000倍。早期研究发现,CPT-11单药对胃癌治疗有很高的疗效,有效率达18%~43%[5-6],与常用的一线胃癌治疗药物没有交叉抗药性。体外研究中也发现,CPT-11同时能下调肿瘤细胞TS酶的表达,与5-Fu有很好的协同作用[7]。在一些Ⅱ期临床研究中,CPT-11与5-Fu及CF联合组成的FOLFIRI方案对晚期胃癌的一线治疗有效率可达40%,中位生存时间达10.7~12.6个月[8-9]。
FOLFIRI方案作为二线方案对晚期胃癌的治疗,在英国和韩国均有报道,总有效率在21%~29%之间,虽然疗效比一线治疗为低,但临床疗效得到公认[10-11],目前在美国NCCN指南中也被推荐为晚期胃癌治疗的二线治疗方案。
在本研究中,采用FOLFIRI方案作为二线方案治疗晚期胃癌的总有效率为 18.4% ,疾病控制率为44.7%,中位PFS为3.4个月,中位OS为9.1个月,与近来国外报道相似[12]。进一步分析发现,对只有一个转移病灶、体质情况较好的患者,疗效较其他患者为好,生存时间也相对较长。7例达到PR的患者,均为单个转移病灶的患者,其中3例为单纯肝转移,4例为单纯腹腔淋巴结转移。而有多处转移病灶的患者疾病进展相对较快,生存期较短。相比既往研究[11],本组患者的总生存期略长,可能与大部分患者在二线方案治疗再次失败后进一步接受三线治疗及中医药治疗有一定的关系。在本组研究中,有9例患者在治疗过程中共进行了41个周期的药物剂量调整,进行剂量调整的主要原因为Ⅳ度骨髓毒性和Ⅲ~Ⅳ度的腹泻。毒性反应的大小与亚洲某些国家报道相似,可能与亚洲人UGT1A1酶具有相似的基因多态性有关[11],目前我们正在开展这方面的检测工作,以作为临床治疗的指导。
本研究的主要不良反应为血液学毒性和延迟性腹泻。血液学毒性大多为Ⅰ~Ⅱ级,Ⅲ~Ⅳ级中性粒细胞下降发生率为18.4%,较国外报道的26.4%为低[10],需应用G-CSF对症处理。其中有1例患者因中性粒细胞下降而引起发热,结合静脉使用有效抗生素后好转。只有1例患者出现Ⅳ度血小板减少,经输注血小板悬液和皮下注射TPO缓解。迟发性腹泻为CPT-11的另一主要毒性反应,一般发生在用药后的1周左右,主要表现为水样腹泻,但大部分为轻度腹泻(55%),Ⅲ~Ⅳ级腹泻发生率仅7.9%,与国外报道相似[10]。经口服易蒙停,补液,必要时使用肠道抗生素和生长抑素对症处理都可以缓解。在本研究中没有发生因严重骨髓毒性和腹泻而导致的相关死亡,可能与5-Fu的持续输注及CPT-11的剂量调整使毒性反应减轻有关。
本研究结果显示,FOLFIRI方案对晚期胃癌患者二线治疗的疗效确切,能使部分患者在一线治疗失败后病情再次得到缓解,总的生存期得到延长。与国外研究结果相一致,严重毒副反应较轻,患者耐受性好,长期生存指标也与国际同类研究水平近似[12],值得在临床上进一步推广应用。
[1] Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2] Wagner AD, Grothe W, Haerting J, et al. Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data[J]. J Clin Oncol ,2006,24(18):2903-2909.
[3] Stahl M, Müller C, Köster W, et al. Second-line chemotherapy of advanced disseminated gastric cancer after cisplatin, infusional 5-fluorouracil, folinic acid(PLF): benefit dependent on progression-free interval after first-line therapy[J].Onkologie,2005,28(10):499-502.
[4] Rougier P,Mitry E. Review of the role of CPT-11 in the treatment of colorectal cancer[J]. Clin Colorectal Cancer,2001,1(2):87-94.
[5] Futatsuki K, Wakui A, Nakao I,et al. Late phase II study of irinotecan hydrochloride (CPT-11) in advanced gastric cancer. CPT-11 Gastrointestinal Cancer Study Group[J]. Gan To Kagaku Ryoho,1994, 21(7): 1033-1038.
[6] Bleiberg H. CPT-11 in gastrointestinal cancer[J]. Eur J Cancer, 1999,35(3): 371-379.
[7] Rothenberg ML, Oza AM, Bigelow RH, et al. Superiority of oxaliplatin and fluorouracil-leucovorin compared with either therapy alone in patients with progressive colorectal cancer after irinotecan and fluorouracil-leucovorin: interim results of a phase III trial[J]. J Clin Oncol ,2003,21(11):2049-2051.
[8] Bouché O, Raoul JL, Bonnetain F, et al. Randomized multicenter phase II trial of a biweekly regimen of fluorouracil and leucovorin (LV5FU2), LV5FU2 plus cisplatin, or LV5FU2 plus irinotecan in patients with previously untreated metastatic gastric cancer: a Federation Francophone de Cancerologie Digestive Group Study—FFCD 9803[J]. J Clin Oncol,2004, 22(21): 4319-4328.
[9] Yilmaz U, Oztop I, Alacacioglu A, et al. Irinotecan combined with infusional 5-fluorouracil and high-dose leucovorin for the treatment of advanced gastric carcinoma as the first-line chemotherapy[J]. Chemotherapy, 2006,52(5):264-270.
[10] Assersohn L, Brown G, Cunningham D,et al.Phase II study of irinotecan and 5-fluorouracil/leucovorin in patients with primary refractory or relapsed advanced oesophageal and gastric carcinoma[J]. Ann Oncol, 2004,15(1):64-69.
[11] Kim ST, Kang WK, Kang JH, et al. Salvage chemotherapy with irinotecan, 5-fluorouracil and leucovorin for taxaneand cisplatin-refractory, metastatic gastric cancer[J]. Br J Cancer, 2005,92(10):1850-1854.
[12] Seo MD,Lee KW,Lim JH, et al. Irinotecan combined with 5-fluorouracil and leucovorin as second-line chemotherapy for metastatic or relapsed gastric cancer[J]. Jpn J Clin Oncol, 2008,38(9):589-595.
