氯喹对骨髓单核细胞向破骨细胞分化的抑制作用及其机制
2022-07-28林立营张文史要鹏姜梅荣张冬燕
林立营,张文 ,史要鹏,姜梅荣,张冬燕
1聊城市人民医院口腔科聊城市人民医院精准生物医学重点实验室,山东聊城 252000;2聊城市东昌府区中医院口腔科
破骨细胞是骨吸收的功能细胞,在病理状态下(如颌骨肿瘤、囊肿和牙周炎等),破骨细胞分化增强或功能亢进,引起骨量失衡,导致骨质疏松[1]。因此,研究破骨细胞的分化和功能对于骨吸收性疾病的防治有重要意义。破骨细胞由髓系单核细胞分化而来,在核因子κB受体激活因子配体(RANKL)的作用下,破骨前体细胞内质网表面的IP3受体(IP3R)被激活,诱发内质网钙外流,导致细胞质中的T细胞活化核因子1(NFATc1)去磷酸化并转入细胞核内,启动破骨细胞分化相关基因的表达[2-3]。溶酶体是破骨细胞中含量较多的细胞器,可以为骨吸收提供必需的酶及酸[4-5]。位于溶酶体膜上的空泡型质子泵(V-ATPase)包括V0和V1两个结构域,其中V0的a亚基是氢离子转运通道,a亚基包括a1~a4四个蛋白异构体[6]。我们前期研究发现,敲低小鼠骨髓单核细胞(BMMs)中a3亚基编码的T细胞免疫调节因子1(TCIRG1)表达,可通过抑制IP3R2表达导致NFATc1入核障碍,抑制大体积破骨细胞的分化[7]。氯喹能降低溶酶体的酸度[8],也能抑制破骨细胞分化[9]。2020年4月—2022年4月,本研究观察了氯喹对BMMs向破骨细胞分化的抑制作用,并基于TCIRG1调控探讨相关机制,现报告如下。
1 材料与方法
1.1 主要实验材料 雄性C57BL/6小鼠20只,鼠龄4~6周,体质量约30 g,由北京唯尚立拓科技有限公司提供。巨噬细胞集落刺激因子(M-CSF)和RANKL购于美国R&D公司;PDMPO购于美国AAT Bioquest公司;TCIRG1抗体购自Abcam公司;NFATc1、IP3R2抗体购自Santa Cruz公司;DAB购于美国Cell Signaling公司;腺病毒购于上海吉凯生物科技有限公司。淋巴细胞分离液、氯喹、TRAP染色试剂盒购自美国Sigma公司;反转录试剂盒购于日本Takara公司。流式细胞仪,化学发光成像系统,倒置相差显微镜,电泳仪,转印槽,电泳槽。
1.2 BMMs的获取及分组 小鼠在麻醉下颈部脱臼处死,无菌分离肱骨和股骨。剪去小鼠长骨的干骺端,用预温的培养液(α-MEM+10%FBS+2%青链霉素+25 ng/mL M-CSF)冲出骨髓,吹打混匀后置入细胞培养箱中培养24 h。吸取未贴壁的细胞至离心管,缓慢加入到等体积淋巴细胞分离液上方,室温下以2 000 r/min离心30 min,吸取中间白膜层细胞即为小鼠BMMs。细胞经过无菌PBS清洗离心2遍后,于含25 ng/mL M-CSF、5 ng/mL RANKL的α-MEM中培养。将细胞分为对照组、氯喹1组、氯喹2组,随诱导液分别加入0、5、10µmol/L的氯喹。
1.3 BMMs向破骨细胞分化情况观察
1.3.1 破骨细胞分化情况观察 采用抗酒石酸酸性磷酸酶(TRAP)染色。3组细胞在诱导96 h后停止培养,PBS冲洗,用4%多聚甲醛于室温下固定20 min。之后根据试剂盒说明配制染液,37℃避光孵育30 min,镜下随检。出现紫红色染色为TRAP阳性细胞,即破骨细胞。
1.3.2 破骨细胞分化相关基因检测 将小鼠BMMs接种于6孔板中,分组及给药操作同“1.2”,加入RANKL、M-CSF诱导48 h。用TRIzol提取细胞总RNA。根据反转录试剂盒说明,分别将3组细胞总RNA反转录为cDNA,采用RT-PCR法检测破骨细胞分化相关基因 TCIRG1、NFATc1、Dc-stamp、MMP9、Oscar、IP3R1、IP3R2、IP3R3 mRNA。目的基因引物序列见表1,以GAPDH作为内参,实验重复至少3次。

表1 TCIRG1、NFATc1、Dc-stamp、MMP9、Oscar、IP3R1、IP3R2、IP3R3、GAPDH基因引物序列
1.4 细胞中 TCIRG1、NFATc1、IP3R2蛋白检测 采用Western blotting法检测TCIRG1、NFATc1、IP3R2蛋白。将小鼠BMMs接种于6孔板中,分组及给药操作同“1.2”,加入RANKL、M-CSF诱导48 h;每孔加入80µL含有1%PMSF的RIPA裂解液冰上裂解细胞30 min后收集细胞,低温12 000 r/min离心15 min,上清即为总蛋白;高温变性总蛋白并用SDS-PAGE凝胶电泳分离蛋白;将蛋白转印到PVDF膜上,封闭蛋白1 h,添加TCIRG1、NFATc1、IP3R2抗体4℃孵育过夜;复温后的PVDF膜用TBS-T冲洗3遍,添加二抗常温孵育1 h,TBS-T冲洗3次;置于化学发光成像系统内拍照分析。采用免疫组化染色检测NFATc1蛋白。将小鼠BMMs以1×105/孔接种于24孔板中,分组及给药方法参照“1.2”,用RANKL、M-CSF诱导三组细胞96 h后终止培养;洗弃培养液,4%多聚甲醛固定20 min后以0.5%Triton X-100通透样本5 min;用3%山羊血清封闭1 h后滴加NFATc1抗体(1:200)封闭过夜,PBS冲洗3遍,加二抗常温孵育1 h;用DAB进行染色,显微镜下观察NFATc1蛋白表达情况及其在细胞中的定位。
1.5 细胞溶酶体酸化相关指标检测 将小鼠BMMs接种于6孔板中,分组及给药操作同“1.2”,加入RANKL、M-CSF诱导48 h;弃培养液,加入含有3µmol/L PDMPO的新培养液在37℃培养箱继续培养30 min。PDMPO特异性聚集在溶酶体中,可被405 nm紫光激发,并且随着pH增高,发射光越短。孵育完成后收集、清洗细胞,采用流式细胞仪(激发光405 nm,发射光421 nm)和BV510通道(激发光405 nm,发射光510 nm)检测溶酶体酸化情况,用FlowJo7.6软件进行数据分析。采用RT-PCR法检测ATP6 V0d2、ATP6 V1c1mRNA。细胞分组、给药操作见“1.3.2”。引物序列见表2。
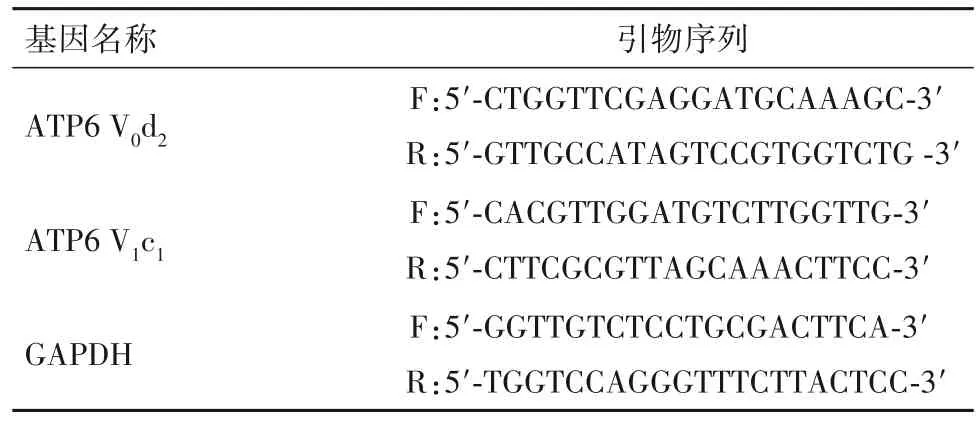
表2 ATP6 V0d2、ATP6 V1c1、GAPDH基因引物序列
1.6 氯喹对TCIRG1过表达BMMs向破骨细胞分化的影响观察 将小鼠BMMs以1×105/孔接种于6孔板中,24 h后细胞进入对数生长期,以MOI=30的滴度在不同孔中分别加入含有绿色荧光蛋白(GFP)的过表达TCIRG1的腺病毒和空病毒,并将细胞置于5% CO2细胞培养箱中继续转染。10 h后终止转染,更换培养基继续培养,观察GFP表达,评估转染效率。将BMMs分为A、B、C、D组。A组转染过表达TCIRG1的腺病毒并以10µmol/L氯喹刺激;B组转染空病毒并以10µmol/L氯喹刺激;C组不转染,给予10µmol/L氯喹;D组为空白组,不转染也不添加氯喹。
1.7 统计学方法 采用Prism5.0统计软件。采用Shapiro-Wilk检验验证正态分布性,符合正态分布的计量资料以±s表示,多组间比较应用单因素方差分析,两两比较应用Bonferroni法。P<0.05为差异有统计学意义。
2 结果
2.1 各组BMMs向破骨细胞分化指标比较 氯喹1组、氯喹2组、对照组均可见TRAP染色阳性细胞,氯喹2组TRAP阳性细胞体积小于氯喹1组。见图1。细胞分化48 h后,氯喹1组和氯喹2组细胞中NFATc1、Oscar、IP3R1、IP3R2、IP3R3 mRNA相对表达量低于对照组,氯喹2组Dc-stamp、MMP9 mRNA表达低于对照组(P均<0.05)。见表3。氯喹1组、氯喹2组细胞中TCIRG1、NFATc1、IP3R2蛋白表达低于对照组,氯喹2组TCIRG1、NFATc1、IP3R2蛋白表达低于氯喹1组(P均<0.05)。见表4。免疫组化染色显示,氯喹2组细胞核中NFATc1表达减少。见图2。
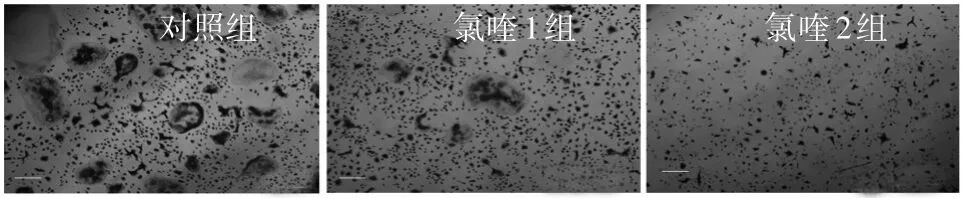
图1 分化诱导96 h后三组TRAP染色阳性细胞情况
表3 分化诱导48 h后三组细胞NFATc1、Dc-stamp、Oscar、MMP9、IP3R1、IP3R2、IP3R3 mRNA相对表达量比较(±s)
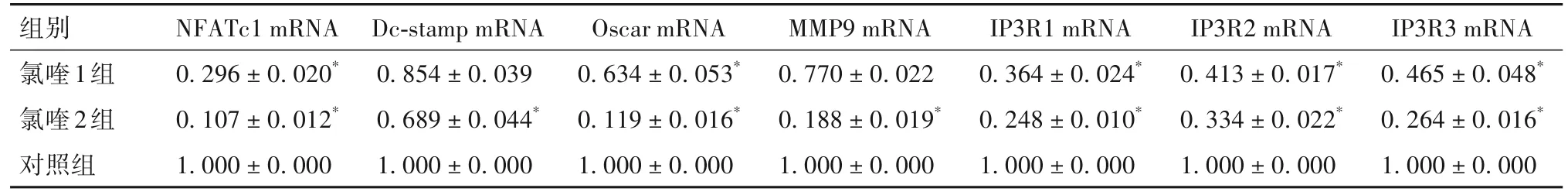
表3 分化诱导48 h后三组细胞NFATc1、Dc-stamp、Oscar、MMP9、IP3R1、IP3R2、IP3R3 mRNA相对表达量比较(±s)
注:与对照组相比,*P<0.05。
组别氯喹1组氯喹2组对照组NFATc1 mRNA 0.296±0.020*0.107±0.012*1.000±0.000 Dc-stamp mRNA 0.854±0.039 0.689±0.044*1.000±0.000 Oscar mRNA 0.634±0.053*0.119±0.016*1.000±0.000 MMP9 mRNA 0.770±0.022 0.188±0.019*1.000±0.000 IP3R1 mRNA 0.364±0.024*0.248±0.010*1.000±0.000 IP3R2 mRNA 0.413±0.017*0.334±0.022*1.000±0.000 IP3R3 mRNA 0.465±0.048*0.264±0.016*1.000±0.000
表4 各组细胞中NFATc1、TCIRG1、IP3R2蛋白相对表达量比较(±s)
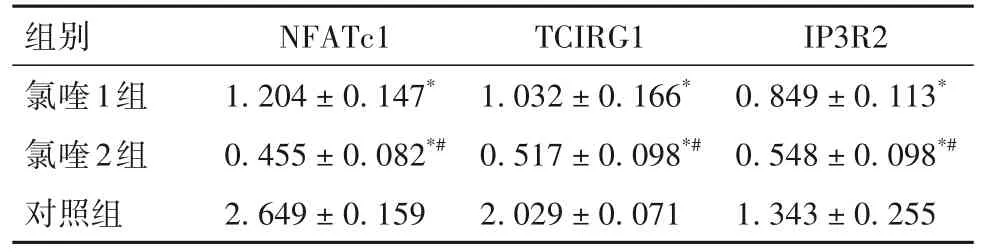
表4 各组细胞中NFATc1、TCIRG1、IP3R2蛋白相对表达量比较(±s)
注:与对照组相比,*P<0.05;与氯喹1组相比,#P<0.05。
组别氯喹1组氯喹2组对照组IP3R2 0.849±0.113*0.548±0.098*#1.343±0.255 NFATc1 1.204±0.147*0.455±0.082*#2.649±0.159 TCIRG1 1.032±0.166*0.517±0.098*#2.029±0.071

图2 各组细胞NFATc1蛋白表达情况(免疫组化染色)
2.2 各组细胞溶酶体酸化相关指标比较 对照组、氯喹1组、氯喹2组细胞主群的荧光信号逐渐倾向于发射光短的BV421通道,提示溶酶体pH增高,酸度降低。见图3。氯喹1组、氯喹2组TCIRG1、ATP6 V0d2、ATP6 V1c1mRNA相对表达量低于对照组,且氯喹2组低于氯喹1组(P均<0.05)。见表5。
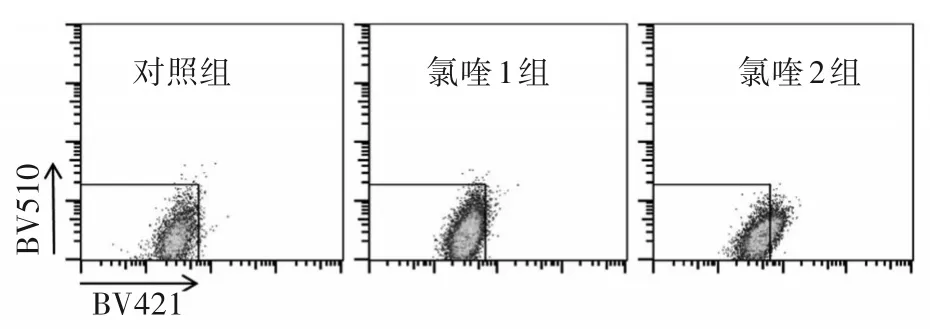
图3 各组细胞诱导分化48 h后溶酶体酸化情况检测结果(流式细胞术)
表5 各组细胞诱导分化48 h后ATP6 V0d2、ATP6 V1c1 mRNA表达比较(±s)

表5 各组细胞诱导分化48 h后ATP6 V0d2、ATP6 V1c1 mRNA表达比较(±s)
注:与对照组相比,*P<0.05;与氯喹1组相比,#P<0.05。
组别氯喹1组氯喹2组对照组ATP6 V1c1mRNA 0.614±0.018*0.414±0.021*#1.000±0.000 ATP6 V0d2mRNA 0.516±0.022*0.219±0.016*#1.000±0.000
2.3 氯喹对TCIRG1过表达BMMs向破骨细胞分化的影响 与B、C组相比,A组出现了一些体积较大的TRAP阳性细胞,但是数量和体积未超过D组。见图4。A组NFATc1、IP3R2 mRNA及蛋白表达高于B、C组,但低于D组(P均<0.05)。见表6、表7。

图4 A、B、C、D组细胞诱导96 h后TRAP染色情况
表6 A、B、C、D组细胞诱导分化48 h后NFATc1、TCIRG1、IP3R2蛋白表达比较(±s)
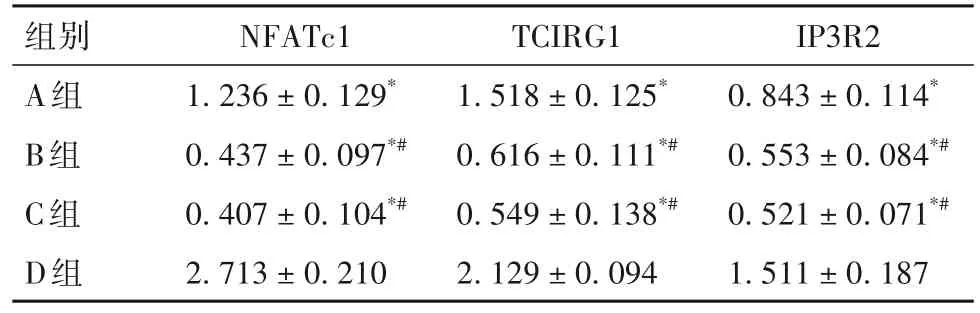
表6 A、B、C、D组细胞诱导分化48 h后NFATc1、TCIRG1、IP3R2蛋白表达比较(±s)
注:与D组相比,*P<0.05;与A组相比,#P<0.05。
组别A组B组C组D组TCIRG1 1.518±0.125*0.616±0.111*#0.549±0.138*#2.129±0.094 NFATc1 1.236±0.129*0.437±0.097*#0.407±0.104*#2.713±0.210 IP3R2 0.843±0.114*0.553±0.084*#0.521±0.071*#1.511±0.187
表7 A、B、C、D组细胞诱导分化48 h后TCIRG1、NFATc1、IP3R1、IP3R2、IP3R3 mRNA表达比较(±s)
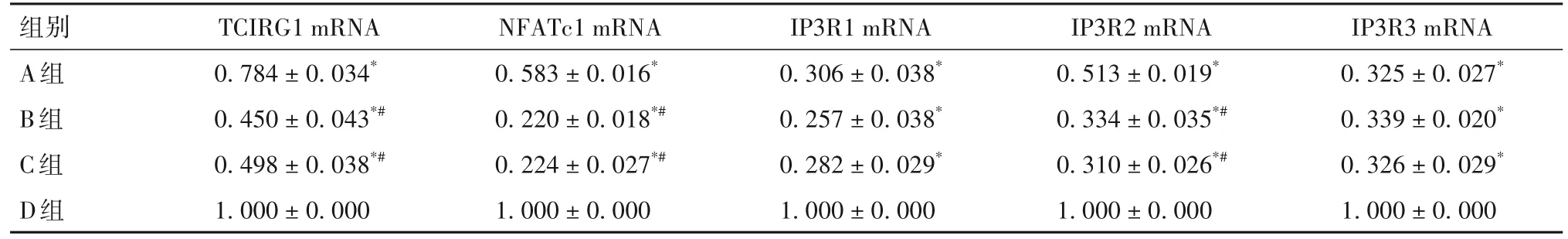
表7 A、B、C、D组细胞诱导分化48 h后TCIRG1、NFATc1、IP3R1、IP3R2、IP3R3 mRNA表达比较(±s)
注:与D组相比,*P<0.05;与A组相比,#P<0.05。
组别A组B组C组D组IP3R3 mRNA 0.325±0.027*0.339±0.020*0.326±0.029*1.000±0.000 TCIRG1 mRNA 0.784±0.034*0.450±0.043*#0.498±0.038*#1.000±0.000 NFATc1 mRNA 0.583±0.016*0.220±0.018*#0.224±0.027*#1.000±0.000 IP3R1 mRNA 0.306±0.038*0.257±0.038*0.282±0.029*1.000±0.000 IP3R2 mRNA 0.513±0.019*0.334±0.035*#0.310±0.026*#1.000±0.000
3 讨论
NFATc1在破骨细胞中高表达,是破骨细胞分化的重要转录因子[10]。NFATc1通常以非活化的磷酸化状态位于破骨前体细胞的胞质中。当破骨前体细胞感受到来自外界的RANKL后,通过与RANK及其配体结合,经过级联反应活化磷脂酶Cγ并产生IP3;IP3与内质网表面的IP3R结合后诱发内质网内钙离子外流,形成钙振荡并激活钙调磷酸激酶;活化的钙调磷酸激酶作用于NFATc1,使其去磷酸化并转位进入细胞核内,结合到染色体特定部位,以启动子功能启动破骨细胞分化相关基因如Dc-stamp、MMP9、Oscar等的表达,启动向破骨细胞分化[11-12]。研究表明,氯喹可抑制破骨细胞分化[9,13]。氯喹可抑制RANKL引起的肿瘤坏死因子受体相关因子3(TRAF3)降解,降解后的TRAF3会与NFATc1竞争结合钙调磷酸激酶,使得去磷酸化的NFATc1相对减少从而实现对破骨细胞分化的抑制作用[10]。
NFATc1由钙调磷酸激酶直接激活,而钙调磷酸激酶活化与否受细胞内钙振荡信号的影响。细胞内钙离子主要存储于内质网中,IP3Rs是内质网膜上释放钙离子的通道,IP3Rs的表达会直接影响钙离子释放从而调控钙调磷酸激酶活化。研究发现,氯喹可以抑制某些细胞中IP3Rs的表达,如B淋巴细胞[14]、骨骼肌细胞[15]、CD4+T 淋巴细胞[16]。IP3R有三种类型,包括IP3R1、IP3R2、IP3R3,其中IP3R1介导短时间的钙振荡,IP3R2介导持续性的钙振荡,IP3R3介导瞬时钙振荡。IP3R2介导的长时间持续性的钙振荡对破骨前体细胞分化有重要意义[17-18]。IP3Rs表达减少对减少NFATc1入核有重要意义。
本研究以氯喹作用于小鼠BMMs,并给予MCSF、RANKL诱导分化,结果显示,氯喹组TRAP阳性细胞体积减小,破骨细胞分化相关基因和蛋白如TCIRG1、NFATc1、IP3R2等表达均减少,NFATc1的入核转位抑制,与之前的研究结果一致。提示氯喹可能通过调控 TCIRG1、NFATc1、IP3R2表达,起到抑制BMMs向破骨细胞分化的作用。
TCIRG1是V-ATPase V0亚基a3蛋白的编码基因,该基因缺陷会引起体积小且功能差的破骨细胞分化,导致骨质增多,诱发骨质硬化症[19-20]。VATPase不仅是细胞内液泡酸化的重要蛋白复合体[21-22],在某些特殊的细胞类型(如肾脏细胞、内耳细胞和破骨细胞),V-ATPase还能跟随细胞内囊泡膜融合到细胞膜上,调节细胞外环境的酸化[23]。VATPase的酸化功能主要依靠V-ATPase V0a亚基实现,a亚基是质子转运的通道,包括a1~a4四个蛋白异构体[24]。其中a3蛋白在破骨细胞中的表达明显高于其他细胞类型[25]。氯喹对溶酶体有趋化性,可以中和溶酶体的酸性。本研究结果显示,氯喹可抑制小鼠BMMs中TCIRG1表达,降低溶酶体酸度。溶酶体酸度降低抑制破骨细胞的细胞外酸化能力,同时降低溶酶体酶活性,但其与破骨细胞分化的直接或间接相关性还需要进一步探讨。
我们之前研究发现,敲低小鼠BMMs中的TCIRG1基因会下调IP3R2表达[7]。为探讨氯喹的破骨细胞分化抑制作用与TCIRG1基因的关系,我们对TCIRG1过表达小鼠BMMs给予氯喹并刺激分化,结果显示,与B、C组相比,A组出现了一些体积较大的TRAP阳性细胞,但是数量和体积未超过D组;A组NFATc1、IP3R2 mRNA及蛋白表达高于B、C组,但低于D组,提示TCIRG1过表达可以部分逆转氯喹对破骨细胞分化的抑制作用,但氯喹对IP3R的抑制作用可能不完全通过抑制TCIRG1实现。我们还发现,过表达TCIRG1基因只对IP3R2的表达有调控作用,而对IP3R1、IP3R3表达无明显影响,具体原因尚需进一步探讨。
以上结果表明,在小鼠BMMs向破骨细胞分化的过程中,氯喹会抑制TCIRG1、IP3R2表达及NFATc1的表达和入核,从而抑制破骨细胞分化。TCIRG1过表达可以部分逆转氯喹对破骨细胞分化的抑制作用,氯喹对破骨细胞分化的抑制作用可能部分通过调控TCIRG1、IP3R2、NFATc1而实现。
