沙蟾毒精对人肝癌细胞HepG2增殖凋亡的调控作用及其机制
2022-07-28孔令麒钱海珊李绍花陈帅黄丰何红平李宝晶
孔令麒,钱海珊,李绍花,陈帅,黄丰,何红平,李宝晶
1云南中医药大学中药学院云南省南药可持续利用重点实验室,昆明 650500;2云南中医药大学民族医药学院云南省傣医药与彝医药重点实验室
肝癌是全球范围内最常见的恶性肿瘤之一,所有肝癌病例中90%以上是肝细胞癌[1-2]。临床肝癌治疗策略包括手术切除、放疗和化疗等,但患者预后仍不理想[3]。因此,开发安全性高、毒性作用小的新药具有重要意义。蟾皮为蟾蜍科动物中华大蟾蜍的干燥皮,其性凉,味辛,微毒,具有清热解毒、利水消胀的功效,可治痈疽、肿毒、瘰疬、疳积腹胀[4]。华蟾素注射液为蟾皮的水提取物,现已广泛应用于多种恶性肿瘤的治疗,如肝癌、胃癌等[5]。前期研究发现,蟾蜍二烯酸内酯类化合物是其主要成分,部分蟾蜍二烯酸内酯类化合物对HepG2、A549、HeLa细胞具有体外增殖抑制作用[6]。沙蟾毒精是蟾皮中主要的蟾蜍二烯酸内酯类化合物之一。现代药理研究表明,沙蟾毒精具有良好的抗肿瘤活性[7-9],具体机制有待进一步明确。2020年9月—2021年8月,本研究通过体外实验,观察了沙蟾毒精对人肝癌HepG2细胞增殖和凋亡的调控作用,对其可能的机制进行探讨,为沙蟾毒精的抗肿瘤应用研究提供理论依据。
1 材料与方法
1.1 细胞与主要实验材料 沙蟾毒精从蟾皮中分离获得[10],经高效液相(HPLC)检测纯度超过98%。人肝癌HepG2细胞购自中国典型培养物保藏中心细胞库。DMEM培养基、细胞增殖及毒性检测试剂盒购自江苏凯基生物技术股份有限公司;胰酶购自北京索莱宝科技有限公司;白细胞介素(IL)-6、IL-8、转化生长因子 β1(TGF-β1)、血管内皮生长因子(VEGF)试剂盒均购自江苏酶免实业有限公司;Annexin V-FITC/PI凋亡试剂盒购自杭州联科生物技术股份有限公司;BCA蛋白定量试剂盒购自北京康为世纪生物科技有限公司;GAPDH小鼠单克隆抗体、辣根酶标记山羊抗小鼠IgG(H+L)抗体、辣根酶标记山羊抗兔IgG(H+L)抗体购自北京中杉金桥生物技术有限公司;p-STAT3兔单克隆抗体、p-JAK2兔单克隆抗体购自Abcam公司;p-JAK1兔多克隆抗体购自江苏亲科生物研究中心有限公司。倒置荧光显微镜(MF53)购于广州明美光电有限公司;全自动酶标仪(WD-2102B)、蛋白垂直电泳仪(DYY-6C)购于北京六一生物科技有限公司;低温高速离心机(TGL-16D)购于常州中捷实验仪器制造有限公司;Novo-Cyte™流式细胞仪(NovoCyte 2060R)购于艾森生物(杭州)有限公司;二氧化碳恒温培养箱(BPN-80CW)购于上海一恒科学仪器有限公司。
1.2 沙蟾毒精对HepG2细胞增殖的影响观察
1.2.1 细胞培养 HepG2细胞用DMEM完全培养基(含10%胎牛血清)于37℃、5% CO2的细胞培养箱中培养。细胞贴壁生长至80%后,弃培养上清液,PBS洗2遍后加入胰酶消化2 min,加入培养基终止消化并重悬细胞,收集细胞至离心管,1 000 r/min离心3 min,进行传代培养。取数生长期细胞用于实验。
1.2.2 细胞存活率测算 取对数生长期的HepG2细胞,按1×106/mL接种于96孔培养板,每孔100µL,设对照组和不同浓度实验组,每组5个复孔。待第2天细胞贴壁后去除原培养液,PBS洗2次,对照组加入DMEM完全培养基、每孔100µL,实验组分别加入含5、10、20、40、80 nmol/L沙蟾毒精的DMEM完全培养基、每孔100µL。分别于培养24、48、72 h后,每孔加CCK-8检测试剂10µL,37℃恒温孵育2 h,使用酶标仪在450 nm波长处检测每孔光密度值并计算细胞存活率。选用HepG2细胞开始出现增殖抑制时的沙蟾毒精浓度作为后续实验的最高浓度,逐级减半分别为中剂量和低剂量组的作用浓度。
1.3 沙蟾毒精对HepG2细胞形态及凋亡的影响观察
1.3.1 细胞形态观察 取对数生长期的HepG2细胞,以1×106/mL接种于96孔培养板、每孔100µL,设对照组和沙蟾毒精低、中、高剂量组,每组设3个复孔。细胞贴壁24 h后,弃去原培养液,PBS洗2次。对照组加入DMEM完全培养基,每孔100µL。沙蟾毒精低、中、高剂量组分别加入含1.25、2.5、5 nmol/L沙蟾毒精的DMEM完全培养基,每孔100µL。培养48 h,采用倒置荧光显微镜观察各组细胞形态变化。
1.3.2 流式细胞术检测HepG2细胞凋亡 分组及给药方法参考“1.3.1”。各组培养48 h,PBS洗2遍后加胰酶消化2 min,收集细胞,1 500 r/min离心3 min,洗2遍后稀释。取1×Binding Buffer 300µL重悬细胞,每管中加入Annexin V-FITC 3µL、PI-PE 5µL,孵育 10 min,再加入 1×Binding Buffer 200µL,混匀后上流式细胞仪观察并计算细胞凋亡率。
1.4 沙蟾毒精对HepG2细胞肿瘤免疫相关因子分泌水平的影响观察 分组及给药方法参考“1.3.1”。各组培养48 h,离心后收集上清液。采用ELISA法检测上清液中的IL-6、IL-8、TGF-β1、VEGF。
1.5 沙蟾毒精与JAK/STAT3信号通路作用关系验证
1.5.1 沙蟾毒精与JAK1、JAK2、STAT3蛋白分子对接 通过PBD数据库(https://www.rcsb.org/)下载JAK1、JAK2、STAT3蛋白的晶体结构,PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载沙蟾毒精的分子结构。采用Autodock tools1.5.6和PyMol2.4.1软件对沙蟾毒精和各蛋白结构进行修饰。采用Autodock vina1.1.2软件对受体蛋白和沙蟾毒精进行分子对接和结合能打分,结合能越低表明亲和力越好。对接过程中对接20次获得20个可能结合的构象,选取亲和力最佳的构象,借助Discovery Studio 4.5 Visualizer软件进行可视化分析。
1.5.2 JAK/STAT3信号通路相关蛋白检测 取对数生长期的HepG2细胞,以1×106/mL接种于6孔培养板,每孔2 mL。设对照组和沙蟾毒精低、中、高剂量组,每组设3个复孔。培养24 h后,弃去原培养液,PBS洗2次。对照组加入DMEM完全培养基,每孔2 mL;沙蟾毒精低、中、高剂量组分别加入含1.25、2.5、5 nmol/L沙蟾毒精的DMEM完全培养基,每孔2 mL。作用48 h后,收集细胞,提取总蛋白。BCA法测定总蛋白浓度,加入上样5×缓冲液混匀,煮沸5 min。加入一定体积的蛋白样品进行SDSPAGE电泳,80 V恒压电泳1.5 h,300 mA恒流转膜1.5 h,5%脱脂牛奶封闭液封闭1 h,孵育一抗过夜,TBST清洗3次。PVDF膜孵育二抗2 h,TBST洗3次。置于超高灵敏度化学发光成像系统运行程序显影成像。以目的蛋白灰度值与GAPDH灰度值的比值表示目的蛋白相对表达量。
1.6 统计学方法 采用SPSS20.0统计软件。计量资料采用Shapiro-Wilk法进行正态性检验,符合正态分布的计量资料以±s表示,经方差齐性检验,组间比较采用单因素方差分析(One-way ANOVA),多组间两两比较采用Bonferroni检验,重复测量资料采用重复测量方差分析;不符合正态分布的计量资料以M(IQR)表示,采用非参数检验。P<0.05为差异有统计学意义。
2 结果
2.1 沙蟾毒精对HepG2细胞增殖的影响 5、10、20、40、80 nmol/L的沙蟾毒精作用24、48、72 h后HepG2细胞存活率均低于对照组(P均<0.01),详见表1。选择5 nmol/L作为最高作用浓度进行后续实验。
表1 各组HepG2细胞存活率比较(%,±s)
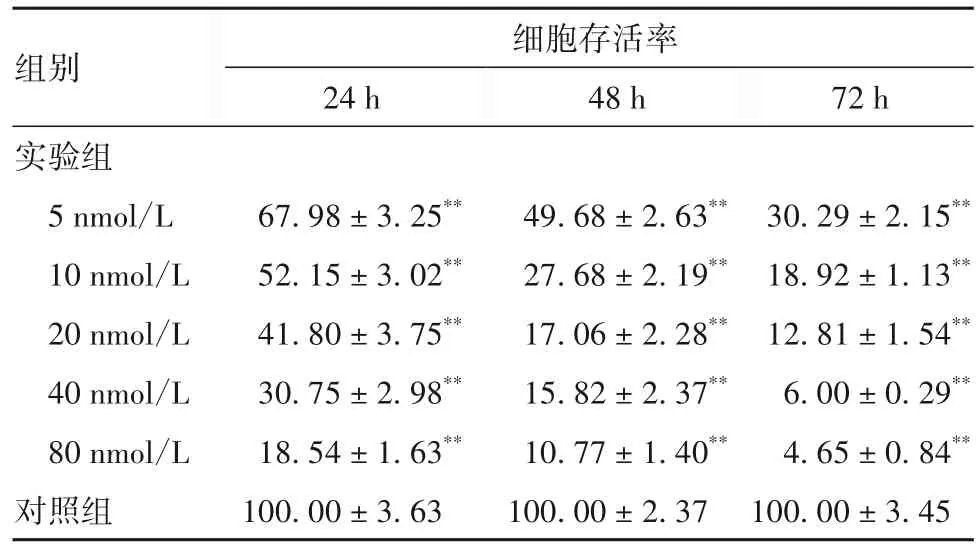
表1 各组HepG2细胞存活率比较(%,±s)
注:与对照组相比,**P<0.01。
组别实验组5 nmol/L 10 nmol/L 20 nmol/L 40 nmol/L 80 nmol/L对照组细胞存活率24 h 48 h 72 h 30.29±2.15**18.92±1.13**12.81±1.54**6.00±0.29**4.65±0.84**100.00±3.45 67.98±3.25**52.15±3.02**41.80±3.75**30.75±2.98**18.54±1.63**100.00±3.63 49.68±2.63**27.68±2.19**17.06±2.28**15.82±2.37**10.77±1.40**100.00±2.37
2.2 沙蟾毒精对HepG2细胞形态的影响 倒置显微镜下观察发现,对照组细胞生长状态较好,细胞与细胞之间呈现紧密连接的状态。沙蟾毒精低、中、高剂量组细胞增殖受到抑制,细胞数量显著减少,细胞间隙增大,部分细胞形态不规则。见图1。
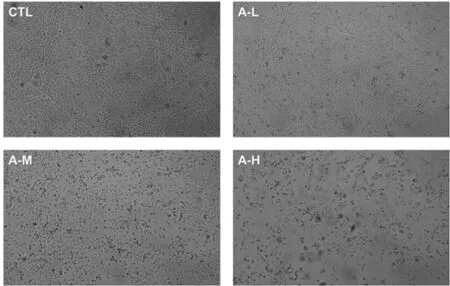
图1 沙蟾毒精对HepG2细胞形态的影响
2.3 沙蟾毒精对HepG2细胞凋亡的影响 对照组和沙蟾毒精低、中、高剂量组细胞凋亡率分别为4.12%±0.16%、10.29%±0.36%、13.72%±0.70%、31.61%±4.06%,沙蟾毒精低、中、高剂量组细胞凋亡率高于对照组,沙蟾毒精低、中、高剂量组细胞凋亡率依次增高(P均<0.05)。
2.4 沙蟾毒精对HepG2细胞肿瘤免疫相关因子分泌水平的影响 沙蟾毒精低、中、高剂量组细胞上清液IL-6、TGF-β1、VEGF水平低于对照组,沙蟾毒精低、中、高剂量组细胞上清液IL-6、TGF-β1、VEGF水平依次降低(P均<0.05);沙蟾毒精中、高剂量组细胞上清液IL-8水平低于对照组,沙蟾毒精低、中、高剂量组细胞上清液IL-8水平依次降低(P均<0.05)。详见表2。
表2 各组HepG2细胞上清液IL-6、IL-8、TGF-β1、VEGF水平比较(pg/mL,±s)

表2 各组HepG2细胞上清液IL-6、IL-8、TGF-β1、VEGF水平比较(pg/mL,±s)
注:与对照组相比,*P<0.05;与沙蟾毒精低剂量组相比,#P<0.05;与沙蟾毒精中剂量组相比,△P<0.05。
组别沙蟾毒精高剂量组沙蟾毒精中剂量组沙蟾毒精低剂量组对照组VEGF 27.43±3.07*#△37.05±3.51*#46.22±8.34*58.81±3.99 IL-6 5.02±0.68*#△6.63±0.18*#7.68±0.73*10.53±2.04 IL-8 23.35±1.25*#△28.34±1.22*#39.00±5.66 41.74±4.15 TGF-β1 24.14±3.23*#△35.30±2.82*#39.80±1.52*45.05±5.21
2.5 沙蟾毒精与JAK/STAT3信号通路的作用关系 分子对接结果显示,沙蟾毒精与JAK1、JAK2、STAT3有良好的亲和力,结合能分别为-8.0、-7.2、-8.4 kcal/mol。沙蟾毒精中、高剂量组细胞中p-JAK1、p-JAK2、p-STAT3蛋白相对表达量低于沙蟾毒精低剂量组和对照组,沙蟾毒精高剂量组p-JAK1、p-JAK2、p-STAT3蛋白相对表达量低于沙蟾毒精中剂量组(P均<0.05)。见表3。
表3 各组细胞中p-JAK1、p-JAK2、p-STAT3蛋白表达比较(±s)
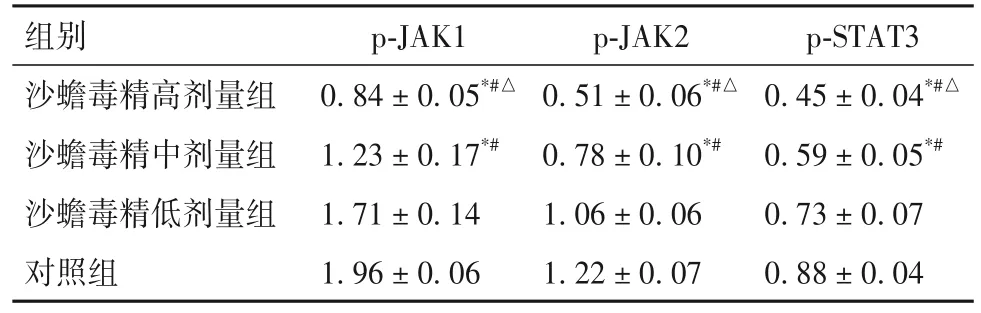
表3 各组细胞中p-JAK1、p-JAK2、p-STAT3蛋白表达比较(±s)
注:与对照组相比,*P<0.05;与沙蟾毒精低剂量组相比,#P<0.05;与沙蟾毒精中剂量组相比,△P<0.05。
p-STAT3 0.45±0.04*#△0.59±0.05*#0.73±0.07 0.88±0.04组别沙蟾毒精高剂量组沙蟾毒精中剂量组沙蟾毒精低剂量组对照组p-JAK1 0.84±0.05*#△1.23±0.17*#1.71±0.14 1.96±0.06 p-JAK2 0.51±0.06*#△0.78±0.10*#1.06±0.06 1.22±0.07
3 讨论
肝癌是最常见的恶性肿瘤之一,我国肝癌发病率与病死率呈上升趋势,治疗效果不理想。中药抗肝癌具多效应、多靶点、多层次等特点,治疗效果显著,可延长患者的生存时间,且不良反应小,已成为国内外学者研究的热点[11]。目前中药抗肿瘤主要表现在:提高机体免疫,抑制肿瘤细胞的生长;调节特定信号通路,抑制肿瘤细胞增殖,促进细胞凋亡与自噬;抑制肿瘤血管生成;抑制肿瘤细胞的侵袭与迁移[12]。沙蟾毒精是从中药蟾皮中分离得到的一种天然活性物质。近年来,蟾皮类制剂广泛用于治疗各种恶性肿瘤、心脏疾病、疼痛、感染性疾病等。现代药理学研究表明,蟾蜍二烯酸内酯类具有良好的抗肿瘤和抗辐射作用,具体机制有待进一步阐明。
本研究通过体外实验,观察了沙蟾毒精对人肝癌HepG2细胞增殖和凋亡的影响,对其可能的机制进行探讨。研究结果显示,沙蟾毒精可抑制肝癌细胞增殖,促进细胞凋亡,降低肿瘤免疫相关因子IL-6、IL-8、TGF-β1、VEGF分泌水平,且作用呈一定的剂量依赖性。分子对接结果显示,沙蟾毒精与JAK1、JAK2、STAT3有良好的亲和力,细胞实验验证结果显示,沙蟾毒精作用后,肝癌细胞中p-JAK1、p-JAK2、p-STAT3蛋白相对表达量下调,且沙蟾毒精高剂量组p-JAK1、p-JAK2、p-STAT3蛋白相对表达量低于沙蟾毒精中剂量组。以上结果提示,沙蟾毒精对肝癌细胞的增殖抑制、促凋亡等作用可能与其直接作用于JAK-STAT信号通路有关。
JAKs家族属于非受体型酪氨酸激酶,包括JAK1、JAK2、JAK3和TYK2。STATs为其下游底物,迄今为止发现有7个成员,包括STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B 和 STAT6。JAK/STAT3信号通路由配体与细胞膜上的受体结合所激活。受体与配体的结合导致受体齐聚化,进而激活JAK激酶,激活的JAKs磷酸化受体上的特征酪氨酸残基,以创建STATs的对接位点。在与受体对接时,JAKs磷酸化STATs蛋白SH2结构域和C端,反式激活结构域之间的保守酪氨酸残基,形成二聚体,进而转入细胞核,与靶基因结合,最终调控基因表达[13-14]。JAK/STAT3 信号通路主要由 JAK、STAT3组成,在肿瘤细胞生长、增殖、侵袭、转移及凋亡过程中发挥着重要作用[15-16]。
JAK/STAT3通路功能失调被认为是恶性肿瘤发病的关键因素[17]。ZHANG等[18]研究发现,肝癌患者肿瘤组织中JAK2、STAT3表达高于癌旁组织,且miRNA-402高表达能下调HepG2细胞中JAK2、STAT3表达。研究发现,下调CKS1B基因表达,可通过抑制JAK/STAT3通路激活从而影响肝癌细胞的侵袭、迁移能力和凋亡[19]。潘奇等[20]分析不同转移潜能的人肝癌细胞系细胞核内转录因子活性差异,发现STAT3的活性随着肝癌细胞转移潜能的增加而增加,提示STAT3的活性异常与肝癌细胞侵袭转移关系密切。
炎症是肿瘤发生发展中的重要促进因素。IL-6参与了肿瘤细胞的存活、增殖、侵袭和转移。研究发现,IL-6水平升高可导致JAK/STAT3信号通路过度激活,JAK/STAT3信号通路过度活化也会诱导IL-6分泌,从而产生正反馈回路[21]。IL-8是一种具有趋化作用的细胞因子,其功能包括免疫作用、刺激血管生成和刺激肿瘤细胞增殖[22]。肿瘤患者的IL-8主要是由肿瘤细胞自身产生,其血清浓度与肿瘤负荷呈正相关[23]。VEGF在血管生成中起着至关重要的作用,并驱动各种致癌过程[24]。TGF-β在肿瘤发生中具有双重作用,早期可诱导细胞周期阻滞和凋亡,随着肿瘤进展,肿瘤细胞逐渐对其不敏感,分泌的TGF-β蛋白增强了肿瘤免疫抑制,促进肿瘤血管生成、侵袭和转移[25]。
长期以来,抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡是肿瘤治疗相关研究的热点。本研究结果显示,沙蟾毒精能抑制HepG2细胞增殖、诱导其凋亡,并抑制炎症因子IL-6、IL-8、TGF-β1和VEGF的分泌,机制可能与调控JAK/STAT3信号通路相关。然而,细胞凋亡的发生机制不仅仅局限于JAK/STAT3信号通路,其具体联系还需进一步研究。
