溶酶体膜蛋白Sidt2缺失导致肝脏细胞自噬受损
2021-09-10耿梦雅王李卓裴文俊漆梦湘许家豪梁洋洋何春玲高家林
耿梦雅,王李卓,章 尧,裴文俊,漆梦湘,杨 梦,许家豪,梁洋洋,吕 坤,何春玲,高家林,2,
皖南医学院1弋矶山医院内分泌科,2弋矶山医院内分泌糖尿病研究所,3临床医学院,4安徽省活性生物大分子研究安徽省重点实验室,5基础医学院生化教研室,6中心实验室,7重大疾病非编码RNA转化研究安徽普通高校重点实验室,安徽 芜湖241002
肝脏具有高水平的新陈代谢应激诱导的自噬[1],肝脏自噬通过促进大分子和细胞器的降解为饥饿的细胞提供氨基酸、葡萄糖和游离脂肪酸[2],用于能量生产和合成新的大分子,并控制线粒体等细胞器的质量和数量,从而在调节肝脏生理中发挥着动态平衡的作用[3]。已有研究发现,在患有肝相关疾病的人的肝细胞中自噬被调节,自噬参与了各种肝脏疾病的发生发展,包括肝炎、脂肪肝、肝硬化、肝细胞癌[1,4]等。细胞自噬分为巨自噬、微自噬、和分子伴侣介导的自噬[5],其中巨自噬在本文中称为自噬,其依赖于自噬小体的产生,通过自噬小体隔离细胞质物质,然后与溶酶体融合形成自噬溶酶体,并将其内容物进行降解加工[6],所以巨自噬中的降解和再循环过程严格取决于溶酶体的功能[7,8]。
肝脏含有丰富的溶酶体,溶酶体是膜结合的细胞器,溶酶体膜包含多种蛋白质,其中溶酶体膜蛋白是溶酶体的一个重要功能单位,SID1跨膜家族成员2(SID1 transmembrane family member 2,Sidt2)是一种溶酶体膜蛋白,其主要在肝脏和肾脏组织中高表达[9]。研究表明当溶酶体膜蛋白异常时,溶酶体内环境发生改变,溶酶体不能发挥正常的生物学功能,进而可能影响自噬[10-11]。自噬异常时受损的细胞器和蛋白质降解异常,从而导致肝细胞损伤和细胞死亡[12]。同时,自噬也可以作为促进肝脏疾病发生和发展的替代途径[13]。目前研究表明当Sidt2缺失后肝脏出现自噬紊乱[11],但其具体机制并未得到探究,基于此,我们希望通过对溶酶体膜蛋白Sidt2的研究来进一步探究肝脏自噬的改变,希望为肝脏相关疾病的发生发展提供潜在靶标。
1 材料和方法
1.1 细胞
HL7702人肝脏细胞购自购自中国科学院典型培养物保藏委员会细胞库,用10%FBS(Excell Bio)1640培养。细胞培养箱CO2浓度保持在5%,温度保持在37 ℃。
1.2 使用CRISPR/Cas9基因编辑慢病毒载体系统剔除Sidt2基因
购买Lenticrispr-v2(AddgenePlasmid49535)质粒,利用sgRNA在线设计工具(http://crispr.mit.edu/)设计靶向Sidt2的sgRNA,序列如下(F:5'-CACCGCAGGT GCCCCTAATCCTGCG-3',R:5'-AAACCGCAGGATT AGGGGCACCTGC-3'),通过生物公司(SangonBiotech)进行合成,使用CRISPR/Cas9 lentivirus system,将Lenticrispr-v2 质粒线性化,与退火的sgRNA 双链进行连接,构建Lenticrispr-v2-Sidt2重组质粒。使用Vigofect(VigorousBiotechnology,China)转染试剂,分别转染Lenticrispr-v2质粒和Lenticrispr-v2-Sidt2重组质粒构建慢病毒,将得到的慢病毒转染HL7702细胞,48 h后使用嘌林霉素筛选72 h,生存下来的细胞即为转染成功的Sidt2+/+组和Sidt2-/-组。
1.3 蛋白质印迹实验
具体方法如前所述[14],本研究中使用一抗包括兔抗LC3B(1∶1000;Sigma-Aldrich),鼠抗P62(1∶1000;abcam),鼠抗β-actin(1∶1000;Sigma-Aldrich),兔抗SIDT2(1∶1000;abgent),鼠抗LAMP1(1∶1000;Santa),兔抗Atg5(1∶1000;Cell signaling technology),兔抗Atg7(1∶1000;Cell signaling technology),兔抗Atg12(1∶1000;Cell signaling technology)。
1.4 免疫荧光实验
将细胞接种在玻底培养皿上,使用多聚甲醛固定,封闭后使用一抗孵育过夜,二抗黑暗环境下孵育90 min,使用DAPI(1 μg/mL)染核后在激光共聚焦显微镜(Olympus,Japan)下进行拍摄。LC3B与P62免疫荧光共定位实验,采用含有LC3B(1∶200;Sigma-Aldrich)及P62(1∶200;abcam)的抗体孵育细胞过夜,抗鼠二抗Cy3-conjugated Affinipure Goat Anti-Mouse IgG(H+L)(Proteintech;1∶200)与抗兔二抗CoraLite488-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)(Proteintech;1∶200)混合孵育的方式。LC3B 与LAMP1 免疫荧光共定位实验,采用含有LC3B(1∶200;Sigma-Aldrich)及LAMP1(1∶200;Santa)的抗体孵育细胞过夜,荧光二抗采取上述方法混合孵育。LysoTracker(Beyotime)同样将细胞接种在玻底培养皿上,在生长到合适密度之后,加入含有LysoTracker终浓度为75 nmol/L的细胞培液,刺激45 min后在激光共聚焦显微镜(Olympus,Japan)下拍摄。
1.5 统计学分析
结果表示为平均值±标准差,使用配对t检验进行两组之间的统计学比较,使Graphpad Prism 8.0软件进行统计学分析,P<0.05为差异具有统计学意义,本研究中的每组实验至少独立重复3次。
2 结果
2.1 构建Sidt2剔除HL7702细胞模型
对HL7702细胞使用Crispr-Cas9技术进行Sidt2基因的敲除,挑取单克隆细胞后进行测序,测序结果显示模型构建成功,使用Western blot技术检测Sidt2蛋白水平表达(图1A),结果显示Sidt2-/-组较Sidt2+/+组蛋白水平明显降低(P<0.05,图1B)。

图1 HL7702细胞Sidt2剔除后蛋白水平验证Fig.1 Protein level verification after Sidt2 deletion in HL7702 cells.A:Western blotting for detecting Sidt2 protein expression before and after Sidt2 deletion;B:Quantitative analysis of the results.*P<0.05.
2.2 HL7702细胞Sidt2剔除后自噬通路异常
对HL7702细胞模型进行基础自噬水平的相关检测(图2A),发现Sidt2-/-细胞较Sidt2+/+细胞,LC3-II/I和P62表达明显增加(P<0.01,图2B)。
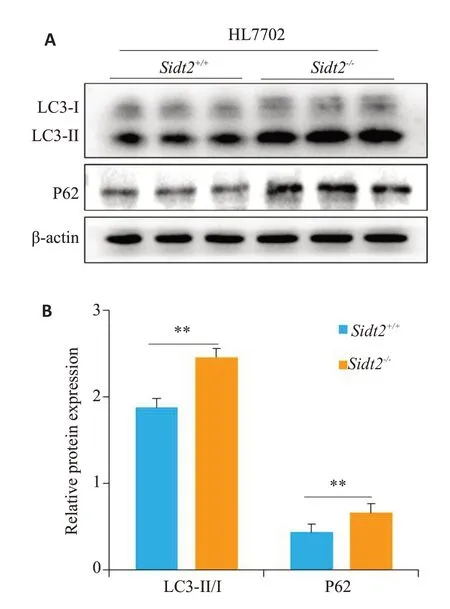
图2 HL7702细胞Sidt2剔除后自噬关键蛋白表达Fig.2 Expression of key autophagy proteins after Sidt2 knockout in HL7702 cells.A:Western blotting for detecting the expression of the key autophagy proteins before and after Sidt2 deletion;B:Quantitative analysis of the results.**P<0.01.
2.3 HL7702细胞Sidt2剔除后自噬相关蛋白表达改变
对Sidt2缺失前后自噬相关蛋白进行检测(图3A),结果发现Sidt2-/-组较Sidt2+/+组自噬相关蛋白Atg5(P<0.001)、Atg7(P<0.01)、Atg12(P<0.05)表达均明显降低(图3B)。

图3 HL7702细胞Sidt2剔除后自噬相关蛋白表达Fig.3 Expression of autophagy-related proteins after Sidt2 deletion in HL7702 cells.A:Western blotting for detecting the expression of autophagy-related proteins before and after Sidt2 is eliminated;B:Quantitative analysis of the results.*P<0.05,**P<0.01,***P<0.001.
2.4 免疫荧光检测HL7702 细胞Sidt2 剔除后LC3B 及P62的表达
对Sidt2缺失后自噬关键蛋白表达及定位进行了进一步的检测,可以清楚的发现LC3B和P62在胞质中表达(图4A、C),同时Sidt2-/-组较Sidt2+/+组LC3B及P62荧光点数均增加(P<0.001,图4B、D)。

图4 免疫荧光检测HL7702细胞自噬关键蛋白表达Fig.4 Immunofluorescence detection of the expression of key autophagy proteins in HL7702 cells (10 μm).A,B:Immunofluorescence assay of LC3B in Sidt2+/+and Sidt2-/-HL7702 cells and quantitative analysis.C,D:Immunofluorescence assay of P62 in Sidt2+/+and Sidt2-/-HL7702 cells and quantitative analysis.***P<0.001.
2.5 HL7702细胞Sidt2基因缺失后自噬小体对P62货物蛋白识别及封存的影响
对Sidt2+/+组及Sidt2-/-组自噬小体和P62货物蛋白进行免疫荧光共定位检测,结果发现Sidt2-/-组较Sidt2+/+组相比LC3B及P62的皮尔森相关系数降低,显示共定位减少(图5)。

图5 Sidt2缺失后LC3B与P62免疫荧光共定位Fig.5 Immunofluorescence co-localization of LC3B and P62 after Sidt2 deletion in HL7702 cells(10 μm).
2.6 Sidt2基因缺失对HL7702细胞自噬小体与溶酶体融合的影响
对Sidt2+/+组及Sidt2-/-组自噬小体及溶酶体标记蛋白进行免疫荧光共定位检测,结果发现Sidt2-/-组较Sidt2+/+组相比,LC3B与LAMP1的皮尔森相关系数降低(图6),自噬小体与溶酶体融合减少。

图6 Sidt2 缺失后LC3B 与LAMP1 免疫荧光共定位Fig.6 Immunofluorescence co-localization of LC3B and LAMP1 after Sidt2 deletion in HL7702 cells(10 μm).
2.7 Sidt2基因缺失后HL7702细胞酸性溶酶体数量减少
使用溶酶体示踪剂LysoTracker对Sidt2基因缺失前后酸性溶酶体进行标记(图7A),结果发现Sidt2-/-组较Sidt2+/+组相比酸性溶酶体数量减少(P<0.05,图7B)。

图7 Sidt2缺失后酸性溶酶体数量的改变Fig.7 LysoTracker for detecting the number of functional lysosomes before and after Sidt2 knockout in HL7702 cells and quantitative analysis of the results(10 μm).*P<0.05.
3 讨论
肝病已经成为全世界疾病和死亡的主要原因之一[15]。已有研究表明,肝炎、脂肪变、肝细胞癌等都与自噬的发生发展有关[16],自噬通过消除肝相关疾病患者体内引入的受损细胞器和蛋白质,保护肝细胞免受损伤和细胞死亡[2]。
巨自噬在本文中称为自噬,其过程依赖自噬小体与溶酶体融合形成自噬溶酶体,并将其内容物进行降解加工的过程[6]。溶酶体的功能对自噬的降解和再循环过程起着决定性的作用[17,18],而溶酶体膜蛋白是溶酶体的一个重要功能单位[19,20],参与多种生理过程,如溶酶体的酸化和膜融合[21,22],对溶酶体的结构、形态和功能维持具有重要作用,已有研究表明多种溶酶体膜蛋白参与了自噬的调节过程[14,23,24],因此对溶酶体膜蛋白的研究值得引起更多的关注。在我们研究全身敲除Sidt2的小鼠时,发现小鼠肝脏出现脂肪变性[10],而最近有证据表明,自噬溶酶体途径在肝细胞脂质代谢中起重要作用,肝脏中自噬的降低可能会导致肝脏脂质的积累,同时脂质的积累可能会随着年龄的增长而导致自噬功能的降低[25,26],因此我们使用Crispr-Cas9技术构建了Sidt2敲除的人肝脏HL7702细胞模型,并对其进行自噬相关研究,希望为肝脏疾病的发生发展提供干预靶标。
我们发现人肝脏细胞(HL7702)Sidt2缺失后自噬关键蛋白LC3-Ⅱ/Ⅰ和P62出现堆积,同时免疫荧光亦表明LC3B及P62荧光点数增加,LC3-Ⅱ常用作为自噬小体标记物[27,28],其表达增加说明自噬小体增加,而自噬小体的增加可能是自噬被激活导致自噬小体产生增多或者自噬受阻导致自噬小体降解障碍所致。P62的堆积可能是其产生增多或者降解减少所致。以上结果提示我们Sidt2基因的缺失会导致肝脏细胞自噬发生紊乱。随后,我们对自噬相关蛋白Atg5、Atg7、Atg12进行检测,自噬相关蛋白参与自噬小泡延伸形成自噬小体的过程[29,30],当Sidt2基因缺失后自噬相关蛋白表达降低表明自噬小体的形成受阻,进一步说明LC3B的增多是自噬小体降解受阻所致。而P62增加的具体原因还需要进一步的研究。
自噬过程中P62 通过自噬溶酶体途径进行降解[31,32],所以我们将研究聚焦在了自噬溶酶体降解途径上。P62降解的过程首先需要与自噬小体结合,再通过自噬小体与溶酶体融合形成自噬溶酶体进行降解[33],我们首先对自噬小体与P62的结合进行了研究,发现Sidt2缺失后代表自噬小体的LC3B 与P62 的共定位降低。这有两种解释,其一可能是Sidt2剔除后P62通过自噬溶酶体途径降解增多所致,其二可能是Sidt2剔除后对货物蛋白P62的识别及封存出现异常所致[34]。因为上述我们已经得出自噬小体的增多是降解障碍导致的,同时P62蛋白水平的增加也表示其降解并不会增多,故自噬小体对货物蛋白的识别及封存障碍是Sidt2剔除后P62堆积的重要原因[34]。
随后我们又对自噬溶酶体的形成进行了探究。自噬溶酶体是由自噬小体与溶酶体融合形成的,我们发现Sidt2基因缺失后LC3B与溶酶体膜性标志物LAMP1[35]共定位降低,提示Sidt2基因的缺失导致自噬小体与溶酶体融合障碍[36]。而由于Sidt2是溶酶体膜蛋白,我们猜想其缺失可能会导致溶酶体的异常[20,21],所以我们使用LysoTracker 对酸性溶酶体进行检测[27],结果发现Sidt2缺失后酸性溶酶体数量减少。以上两点是导致P62与LC3B堆积自噬受阻的重要原因。已有文献表明,在肝脏中自噬可以通过脂质吞噬作用将脂质小滴隔离在自噬小体内并在溶酶体内降解,以防脂质在肝脏中的堆积[37],所以Sidt2缺失导致的自噬受阻可能会导致肝脏脂质堆积,进而影响肝脏疾病的发生发展,这将为我们进一步的研究指明方向。
综上所述,人肝脏细胞Sidt2基因缺失后自噬小体对货物蛋白的识别与封存受阻,同时酸性溶酶体数量减少、自噬小体与溶酶体融合受阻导致自噬溶酶体形成障碍,从而导致自噬小体与货物蛋白发生堆积。我们的研究可能只是Sidt2对人肝脏自噬调节的一部分,但为深入探究溶酶体膜蛋白与肝脏疾病的关系提供了一个新思路。
