外泌体在卵巢癌中的研究进展
2022-03-08陈笑笑贺其志
陈笑笑, 贺其志
(1. 同济大学附属第一妇婴保健院妇科,上海 201204; 2. 同济大学附属第一妇婴保健院病理科,上海 201204)
卵巢癌的死亡率居妇科恶性肿瘤之首[1],其早期症状隐匿,缺乏有效的筛查和检测手段,约75%的患者确诊时已属晚期。此外,由于卵巢癌易转移且化疗后易耐药,晚期卵巢癌患者的5年生存率只有20%~30%[2],对女性的生命健康造成严重的威胁。因此寻找灵敏度和特异度较高的卵巢癌早期诊断标志物,深入探讨卵巢癌增殖、侵袭和转移的机制,寻求有效抑制卵巢癌转移的方法,对于降低卵巢癌的死亡率、提高5年生存率等均具有重要意义。外泌体是直径为30~200 nm的细胞外囊泡,天然存在于各种体液中,包括血液、唾液、尿液、脑脊液和乳汁等。肿瘤细胞分泌的外泌体携带原发肿瘤特异性的蛋白质和核酸,通过多种途径促进肿瘤的增殖、转移和侵袭[3],因而受到了广泛关注。在卵巢癌中,肿瘤来源的外泌体在卵巢癌的发生、发展及其生物学行为中都有着重要的作用。
1 外泌体简介
外泌体的形成始于细胞内陷形成早期内体,早期内体进一步内陷形成多囊体(multivesicular bodies, MVBs)。最后,MVB与细胞膜融合向外界分泌的腔内囊泡(intrauminal vesicles, ILVs)称为外泌体[4]。研究发现,MVBs主要是由运输所需的内体分选复合体(endosomal sorting complex, ESCRT)介导形成的。ESCRT主要包含ESCRT 0、Ⅰ、Ⅱ、Ⅲ,其主要功能是提供泛素化的蛋白质以诱导溶酶体降解。除此之外,其他蛋白也有助于外泌体的生物发生,包括凋亡诱导因子6相互作用蛋白(apoptosis-linked gene-2 interacting protein X, Alix),液泡分选蛋白4(vacuolar protein sorting 4, Vps4),肿瘤易感基因101蛋白(tumor susceptibility gene 101, TSG101)和染色质修饰蛋白4(chromatin modifying protein 4, CHMP4)等[5]。目前,外泌体常见的生物标志物是四次穿膜蛋白(CD82、CD81、CD63和CD9)、热休克蛋白(HSP70、HSP90)以及参与膜转运与融合的相关蛋白(膜联蛋白和Rab)[5]。外泌体的内部包含随机吞噬的细胞质成分,富含mRNA、microRNA(miRNA/miRs),蛋白质和脂质。越来越多的研究表明,外泌体通过递送多种生物分子介导信号转导,在肿瘤的生长、转移、血管生成及免疫调节和代谢方面发挥了重要的作用。Wang等[6]证明了在肺癌细胞中高表达的miRNA-141可通过外泌体途径进入肿瘤基质血管内皮细胞,然后通过调节生长终止特异性同源盒基因(growth arrest-specific homeobox gene,GAX)的表达促进血管生成,从而促进肿瘤的侵袭。Chang等[7]发现通过调节miR-1228在外泌体中的表达,有望使其在胃癌的治疗中发挥重要作用。Sun等[8]发现lncRNA-MALAT1通过抑制miR-503-5p的表达,介导Janus激酶2(janus kinase 2, JAK2)/信号转导及转录激活因子3(signal transducer and activator of transcription 3, STAT3)信号通路的激活,促进卵巢癌细胞的增殖并抑制其凋亡。总之,外泌体在肿瘤的发生及进展中发挥着重要的作用,在肿瘤诊断和治疗方面具有独特的优势和潜在的价值。
2 外泌体在卵巢癌转移中的作用
外泌体在卵巢癌的发生、发展中扮演了重要的角色。卵巢癌细胞在生长过程中不断将外泌体释放到周围环境,通过转运特异性的核酸、蛋白质等,提高卵巢癌细胞的侵袭力,促进卵巢癌的转移。众多研究证实,外泌体与卵巢癌的关系密切,具体见表1。

表1 外泌体在卵巢癌转移中的机制
2.1 外泌体促进卵巢癌细胞上皮-间质转化(epithelial-mesenchymal transition, EMT)
肿瘤的发生、发展是一个极其复杂的过程,有多个调控和转变在其中发挥作用。EMT是细胞的可塑性过程,伴随着上皮表型的逐渐丧失和间充质表型的获得,其在肿瘤发生发展过程中,为癌细胞提供了生长和转移潜能[9]。
E-钙黏蛋白表达的缺失是EMT的关键。研究表明,经过卵巢癌相关成纤维细胞(cancer-associated fibroblasts, CAFs)衍生的外泌体处理过SKOV-3和CAOV-3细胞后,其间质标志物的表达升高,E-钙黏蛋白的表达水平降低,促进EMT[10]。并且,CAF衍生的外泌体富含TGFβ1,可通过激活SMAD信号转导进而调控癌细胞EMT[10]。Zong等[11]通过蛋白印迹法发现外泌体中的circ-WHSC1在卵巢癌组织中上调,诱导癌细胞发生EMT,从而加速了卵巢癌的腹膜扩散。除此之外,将从卵巢癌分泌的包含CD44的外泌体转移到人腹膜间皮细胞(human peritoneal mesothelial cells, HPMC),可以使HPMC重新编程为具有EMT的表型,从而促进卵巢癌的侵袭和转移[12]。与良性肿瘤患者和健康者相比,卵巢癌患者的血清中miR-99a-5p水平显著升高,并且纤连蛋白和波形蛋白的表达水平也显著增加,进一步促进了上皮性卵巢癌(epithelial ovarian cancer, EOC)细胞发生EMT[13]。Cai等[14]还发现卵巢癌腹水中的外泌体通过传递miR-6780b-5p来增强卵巢癌细胞的EMT。卵巢癌的侵袭力不同,其分泌的外泌体对EMT的作用也有差异。与来自低侵袭能力细胞的外泌体相比,从高侵袭性卵巢癌细胞系中分离的外泌体在体内更能促进卵巢癌发生EMT和转移[15]。总之,EMT在卵巢癌的增殖和转移中发挥着至关重要的作用,而外泌体是调节EMT的上游信号物,进一步研究外泌体对EMT的调控作用将有助于揭示其在卵巢癌转移中的作用机制。
2.2 外泌体促进卵巢癌的血管生成
血管生成是肿瘤生长和转移的重要营养来源。外泌体通过改变血管内皮细胞的生物学特性和调节促血管生长因子来诱导血管生成,有利于肿瘤细胞的扩散和转移[16]。
卵巢癌细胞分泌的外泌体含有转录因子2(activating transcription factor 2, ATF2)、转移相关蛋白1(metastasis associated protein 1, MTA1)和CD147等,可诱导血管生成并增加血管通透性[16],促进肿瘤的增生和转移。其次,外泌体表面的可溶性上皮性钙黏蛋白(sE-cadherin, sE-cad)也可以调控肿瘤血管生成。Tang等[16]证明了卵巢癌患者的腹水中高表达的sE-cad以外泌体的形式大量释放,诱导血管生成。随着肿瘤的生长,血液供氧不足,肿瘤组织内产生的乏氧环境促进其释放外泌体,从而可刺激周围血管形成。在乏氧条件下,卵巢癌细胞来源的外泌体中miR-130a的表达上调,促进血管内皮细胞增殖及血管形成[17]。随着对以上研究的深入开展,将会有助于人们解析卵巢癌的血管生成分子机制,选择新的靶点开展卵巢癌治疗,以减少肿瘤的扩散。
3 外泌体影响卵巢癌的免疫微环境
外泌体在卵巢癌的肿瘤微环境中发挥了重要的作用,源自免疫细胞的外泌体可以靶向卵巢癌细胞发挥抗肿瘤作用,而卵巢癌细胞来源的外泌体通过多种途径发挥免疫抑制和免疫逃逸的作用。卵巢癌细胞和免疫细胞之间通过外泌体相互作用,发挥抗肿瘤或促进肿瘤的作用,具体见表1。
卵巢癌衍生的外泌体抑制T细胞的活化。从腹水中发现大部分卵巢肿瘤细胞分泌的外泌体表面含有神经节苷脂GD3,其对唾液酸依赖性T细胞有抑制作用[18],这种抑制作用在除去外泌体后,24~48 h内会逆转,逆转外泌体介导的T细胞下调的能力可能完全取决于细胞暴露于外泌体的持续时间[19]。在免疫抑制的各种机制中,携带精氨酸酶1(arginase-1, ARG1)的外泌体也是导致卵巢癌生长的重要因素。据报道,卵巢癌患者的腹水和血浆中含有携带ARG1的外泌体,其被运送至引流淋巴结,被树突状细胞吸收并抑制抗原特异性T细胞增殖[20]。此外,卵巢癌患者腹水中的磷脂酰丝氨酸(phosphatidylserine,PS)阳性的外泌体可以阻断T细胞中的NF-kB和NFAT信号通路,可逆地抑制T细胞活化[21]。
肿瘤相关巨噬细胞(tumor-associated macro-phages, TAMs)是肿瘤微环境中最常见的免疫细胞之一,癌细胞与TAMs之间的通信影响卵巢癌的生长与转移[22]。尽管在癌症中炎性细胞产生大量的M1炎性介质,但TAMs的表型特征始终显示其缺乏M1功能,主要表达M2功能。M2巨噬细胞可以释放免疫抑制因子支持卵巢癌的免疫逃逸。在卵巢癌中,受到IL-4、IL-10、IL-13和IL-33刺激的巨噬细胞分化为M2型并分泌TGF-β、精氨酸酶-1和IL-6来增强血管形成、基质重塑和免疫抑制。TAMs衍生的外泌体中存在大量的miR-29a-3p和miR-21-5p,这两种物质通过外泌体转移到CD4+T细胞,抑制STAT3调节Treg和Th17的比例,帮助卵巢癌逃避主动免疫反应[23]。TAMs还通过STAT3信号级联反应分泌TGF-β,SDF-1和血管内皮生长因子(vascular endothelial growth factor, VEGF)促进卵巢癌的转移[24]。此外,M2型巨噬细胞通过外泌体转移miR-221-3p靶向抑制细胞周期蛋白依赖性激酶抑制剂1B(cyclin-dependent kinase inhibitor 1B, CDKN1B),促进卵巢癌细胞的增殖[25]。在缺氧条件下,上皮性卵巢癌细胞分泌的外泌体含有丰富的miR-940,诱导巨噬细胞分化为M2表型[26]。源自卵巢癌干样细胞的COX-2可以激活JAK和COX-2/PGE2途径,以促进巨噬细胞的M2型极化[27]。总之,卵巢癌细胞可通过外泌体促进巨噬细胞分化成M2型,并且M2型巨噬细胞可以进一步分泌外泌体促进卵巢癌的生长和转移,见图1。
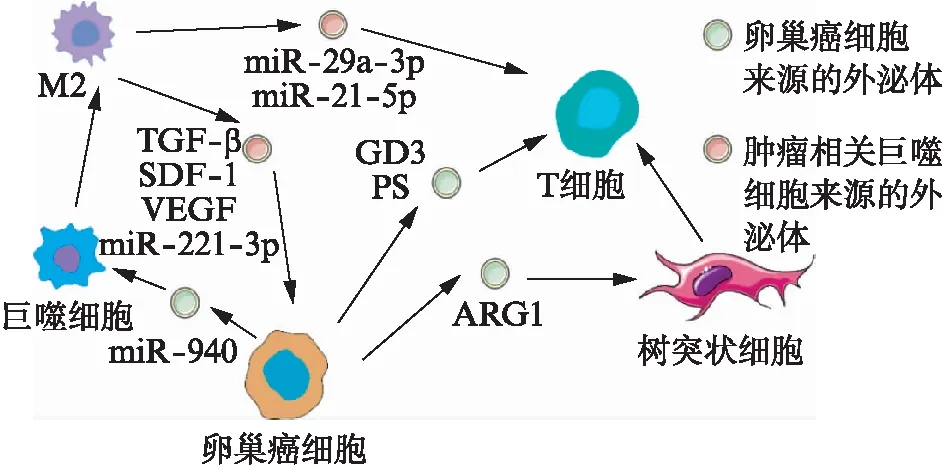
图1 外泌体在卵巢癌免疫微环境中的作用Fig.1 Role of exosomes in the immune microen-vironment of ovarian cancer
4 外泌体在卵巢癌诊断方面的作用
由于卵巢癌的早期诊断率低、晚期死亡率高,已经开展了大量的研究以筛查疾病潜在的生物标志物。CA125是最早鉴定出的卵巢癌生物标志物。研究发现,卵巢癌治疗成功时,循环系统中的CA125水平会降低,而水平升高则与耐药和复发有关[28]。此外,CA125的表达也与其他疾病(例如肺癌和子宫内膜癌)有关,并受到其他因素(例如卵巢癌的进展和类型)的影响,缺乏诊断卵巢癌的特异性[28]。因此,以CA125为分子标志物得出的结果具有很高的假阳性和假阴性率,CA125不能作为诊断卵巢癌可靠的生物标志物[29]。除此之外,研究的另一种生物标志物人附睾蛋白4也像CA125一样,不是可靠的生物标志物。这些生物标志物都具有较高的假阴性和假阳性率,必须进一步研究其他生物分子用于卵巢癌的早期检测。
实际上,几乎所有类型的细胞都释放外泌体,可反映卵巢癌的病理变化,包括其生长、血管生成和转移。由于缺乏早期检测卵巢癌的方法,来源于卵巢癌细胞的外泌体被认为是有价值的生物标志物,主要存在于血液和腹水中,在早期诊断和预后具有巨大潜力。在一项研究中,观察到miR-200a、miR-200b、miR-200c和miR-1290的水平在卵巢癌患者的腹水中升高,并且miR-200b水平与总生存率有关[30]。在另一项研究中,发现外泌体中miR-16,miR-21,miR-92a,miR-200b和miR-200c的表达水平与EOC患者的临床病理和风险参数之间存在着显著相关性,并且外泌体中miR-200b的定量具有诊断和预后的意义[31]。这些研究结果都表明了卵巢癌患者与健康者或是良性卵巢肿瘤患者相比,其外泌体中的miRNA表达水平发生了巨大的变化。因此,卵巢癌外泌体中的miRNA有望成为新的生物标志物。
外泌体中的蛋白质也已作为卵巢癌潜在的生物标志物得到大量研究。卵巢癌的外泌体中发现了CA125,其含量高于血液中游离的CA125[32],显著地提高了卵巢癌诊断的灵敏度。研究表明,从卵巢癌患者血浆中提取出的外泌体含有连接蛋白4,其表达与肿瘤分期呈正相关且灵敏度和特异度均较高[33]。此外,卵巢癌患者与非卵巢癌患者的外泌体相比,表达较高水平的TGFβ1[10]、EpCAM[34]、ADAM-10[35]等。总之,这些外泌体中的蛋白质具有成为卵巢癌生物标志物的潜力。
当然,除了外泌体中的miRNA和蛋白质可以作为卵巢癌潜在的分子标志物外,其他的外泌体相关分子也具有一定潜力。Lea等[36]发现,通过ELISA检测方法可以检测到卵巢癌患者的血液中含有PS的外泌体,根据外泌体中PS的含量可以鉴别卵巢癌和卵巢良性肿瘤。尽管外泌体作为卵巢癌的生物标志物具有很大潜力,但要实现其临床应用仍然需要大量的研究。
5 外泌体在卵巢癌治疗中的作用
药物化疗是治疗卵巢癌并阻断其恶性进展的重要方法,然而卵巢癌在化疗后期极易产生耐药,对治疗效果产生巨大的影响。外泌体在卵巢癌化疗耐药的组织或细胞中表达下调或上升可发挥抑制卵巢癌化疗耐药性的作用,从而增强卵巢癌对化疗的敏感性,起到对卵巢癌的治疗作用。Zhao等[37]研究发现,circRNA CDR1as在顺铂耐药卵巢癌患者的血清外泌体中下调,通过调控miR-1270/SCAI信号通路抑制耐药卵巢癌细胞的增殖,促进顺铂诱导的耐药卵巢癌细胞凋亡,增强了卵巢癌细胞的顺铂化学敏感性。研究发现,顺铂耐药的上皮性卵巢癌患者的血浆外泌体circFoxp1上调,其作为致癌基因使上皮性卵巢癌对顺铂产生耐药性,可作为上皮性卵巢癌潜在的治疗靶点[38-39]。此外,源自抗原提呈细胞(antigen presenting cell, APC)的外泌体[如B细胞和树突状细胞(dendritic cells, DC)]在通过免疫调节的抗肿瘤反应中也发挥重要的作用[40]。研究表明,来自DC的外泌体可以激活T细胞和NK细胞,并且DC细胞来源的外泌体可以影响晚期卵巢癌[40]。Besse等[41]使用DC细胞衍生的外泌体进行了针对晚期非小细胞肺癌的Ⅰ期临床研究。22例卵巢癌患者接受了DC细胞衍生的富含IFN-γ的外泌体治疗,其中7例病情稳定超过4个月,且这些患者的NK细胞功能增强。抑制血管生成也是卵巢癌既定的治疗靶标,一些临床试验已经证实了VEGF靶向药物在卵巢癌治疗中的积极作用[42-43]。CD44在癌症侵袭中也具有重要作用,其有望成为卵巢癌的治疗靶标。但是,用CD44中和抗体进行全身治疗的毒性水平太高[44],需要开发出无毒替代疗法,这表明免疫疗法是外泌体应用于卵巢癌治疗的选择之一。Xu等[45]在一项临床研究中发现miR-101可通过抑制神经源性营养因子抑制卵巢癌细胞的侵袭和迁移。而卵巢癌外泌体中miR-101的表达降低可增强卵巢癌细胞的迁移。因此,miR-101也可能是卵巢癌的潜在治疗药物。尽管外泌体在卵巢癌治疗上具有很大前景,但外泌体的大规模生产、寻找细胞来源及其对靶细胞的特异性方面仍然面临许多挑战。
6 展 望
外泌体在卵巢癌的进展中起着至关重要的作用。卵巢癌细胞释放外泌体作用于体内免疫细胞、间质细胞、实质细胞等,而这些细胞又分泌外泌体反过来作用于卵巢癌细胞,它们以外泌体作为细胞间通信介质相互影响,形成特殊的微环境。因此,阐明卵巢癌与外泌体之间的关系对于理解肿瘤形成的机制非常关键。此外,卵巢癌中的外泌体包含多种生物信息分子,以一种物质作为生物标志物,其灵敏度和特异度大都不尽如人意,或许将多个分子作为生物标志物会取得更好的效果。最后,利用外泌体治疗卵巢癌也具有巨大潜力。外泌体具有稳定性和特异性,可以作为药物传递的载体,用于分子生物疗法和抗肿瘤免疫疗法。但是,将外泌体用于卵巢癌的治疗还存在着许多挑战,例如目标外泌体的选择、目标外泌体的分离和纯化、工程化外泌体的作用效果等。外泌体在肿瘤生物学中的重要性以及各种研究结果都表明外泌体在肿瘤诊疗中的重要作用,应对其开展进一步探索,为其临床应用奠定理论基础。
