去外泌体血清对脂肪干细胞及胃癌细胞生物学活性的影响
2022-03-08谢佳慧
谢佳慧, 文 艺, 王 舰, 徐 俊
(同济大学医学院,上海 200092)
外泌体是一种由真核细胞分泌的直径40~150 nm、密度1.13~1.19 g/mL的囊泡结构[1],表面富含胆固醇、神经鞘磷脂、神经酰胺等脂类物质[2],膜内包含着多种生物活性成分和细胞信号分子,如蛋白质、多肽、脂类及mRNA、microRNA、miRNA、DNA等[3]。外泌体作为细胞间信息交流的重要载体[4],可携带内容物靶向投递至特定的部位释放,在介导微环境中细胞间信号和物质交流上起重要作用[5],且不同来源、不同环境下发挥作用不同,为疾病诊治、组织修复治疗提供了新思路[6]。目前,对于外泌体的研究几乎涉及全部机体组织,其中基础领域中对脂肪干细胞和肿瘤细胞的外泌体功能及相关作用机制的研究更是近年来热点之一[7]。
脂肪干细胞来源丰富,便于获取和操作,分泌外泌体能力强且脂肪干细胞外泌体(adipose-derived stem cells-derived exosomes, ADSCs-Exos)功能众多[8],它能通过细胞分化、周期调控、炎症趋化等相关因子影响或改变受体细胞行为,参与机体内多种生理进程,如细胞增殖、分化、迁移、凋亡以及损伤修复与再生、血管生成、抗炎反应、免疫应答等[9],有很好的研究前景[10]。肿瘤细胞来源的外泌体(tumor-derived exosomes, TEX)既有抑制宿主免疫应答[11],促进肿瘤转移的作用,在一定条件下又能够起到抗肿瘤免疫作用,因其双重性,探索TEX对免疫应答作用及其相关机制在肿瘤诊断及治疗中具有重要意义[12]。研究指出干细胞和肿瘤细胞均能分泌大量外泌体,因此研究它们的旁分泌作用对干细胞的转化及肿瘤的治疗具有重要的意义。
然而,目前的用于外泌体研究的细胞培养体系中通常需要添加胎牛血清,而血清中带有大量的牛外泌体,会对后续提取细胞上清液中的细胞源外泌体的研究产生较强的干扰作用[13];一些研究中会选择采用无血清培养法避免干扰,但往往会对细胞活力以及其外泌体效应产生很大影响,所以在一些高质量的研究中,更倾向于使用含有去除外泌体的血清培液来培养细胞。目前外泌体分离的方法有很多种,但暂时还没有理想且统一的标准。本研究使用的去除血清外泌体的超离法建立在已有文章报道[14-15],并研究了其对ADSCs和肿瘤细胞的影响,为获得理想细胞源外泌体提供可行方法。
1 材料与方法
1.1 材料
原代脂肪干细胞来源于上海美立方医疗美容医院抽脂提取的脂肪组织,且原代脂肪干细胞已完成检验鉴定工作。肿瘤细胞为购买自中国科学院细胞库的胃癌细胞MGC803。
DMEM/F12培养基购自美国Gibco公司,FBS购自澳洲Moregate公司,无外泌体血清购自美国SBI公司,CCK-8试剂盒、细胞凋亡试剂盒、衰老β-Gal半乳糖苷酶染色试剂盒均购自碧云天生物技术有限公司,细胞周期试剂盒购自美国BD公司,Alix抗体购自美国Cell Signaling Technology公司,CD63抗体购自美国圣克鲁斯生物技术公司,TSG101抗体和Actin抗体购自英国Abcam公司,山羊抗小鼠IgG和山羊抗兔IgG购自美国Proteintech公司。
1.2 方法
1.2.1 超离法去除血清外泌体 将FBS分装到超速离心管中离心(离心半径88 cm,34 800 r/min,18 h),使用移液器从上方贴着液面小心吸取上清液,避免扰动底部的沉淀,收集80%左右的上清液,转移到50 mL离心管,混匀后使用0.45 μm的滤器过滤,即可得到无菌的Exo-Free FBS。处理后的Exo-Free FBS可以冻存于-20 ℃。
1.2.2 对比不同血清中外泌体的含量 提取两种不同血清中外泌体,使用RIPA裂解液裂解外泌体,BCA法测定蛋白浓度,根据测定的外泌体浓度以每孔上样15 μg计算每孔上样量。然后加入1/4体积的5×上样缓冲液与外泌体混合,放入蛋白煮样器100 ℃进行蛋白变性10 min,结束后立即放在冰上待用。使用上海雅酶PAGE凝胶快速制备试剂盒(10%)制备SDS-PAGE凝胶,上样,电泳,转膜。用TBST清洗5 min后,放入5%牛奶中,摇床上振荡封闭2 h。Alix(E6P9B,Rabbit mAb),TSG101(ab125011),CD63(MX-49.129.5)以及Actin(ab8226)抗体孵育过夜,洗膜,接着分别加入对应二抗Goat anti-mouse IgG(H+L), HRP conjugate,SA00001-1和Goat anti-rabbit IgG(H+L), HRP conjugate,SA00001-2,室温孵育2 h。
1.2.3 脂肪干细胞的分离培养 将脂肪组织剪碎,加入0.15%的Ⅰ型胶原酶,37 ℃消化45 min;将悬液离心(离心半径88 cm,800 r/min,5 min),即获得P0代细胞,将细胞接种于含有90% DMEM/F12、10% FBS、10 ng/mL成纤维细胞生长因子(b-FGF)和1%青霉素-链霉素双抗的培养基中,37 ℃ 5%CO2培养箱中培养,隔天换液,长至80%~90%汇合度时传代,加0.25%胰酶消化3 min,离心(离心半径13.5 cm,1 000 r/min,5 min)收集细胞,接种至新鲜培养基中。从P1代开始分成实验组和对照组,实验组用10%去外泌体血清(Exo-Free FBS)代替FBS,选取P4代细胞和P6代细胞作为实验材料。
1.2.4 肿瘤细胞的培养 购买自中国科学院细胞库的胃癌细胞MGC803,使用90% RPMI-1640和10% FBS配制培养基,培养传代从P1代开始分成实验组和对照组,实验组用10% Exo-Free FBS代替FBS,选取P4代细胞和P6代细胞作为实验材料。
1.2.5 细胞计数试剂盒-8(CCK-8)分析 将细胞以5×103/孔铺至96孔板中,每隔24 h向一组的3个复孔中添加10 μL CCK-8溶液,37 ℃孵育2 h。使用酶标仪测量在450 nm处吸光度(A450),A450代表细胞活力。持续检测6 d绘制生长曲线。
1.2.6 细胞衰老分析 用SA-β-Gal染色试剂盒测定细胞衰老,按照试剂盒说明书进行染色,用光学显微镜随机捕获多个不同视野的细胞并计数,计算蓝色阳性细胞的比例。
1.2.7 细胞周期分析 6孔板接种106/孔细胞,取对数生长期的细胞,PBS清洗3次,细胞消化后用PBS清洗3次,用0.5 mL的PBS将细胞重悬,再加入1.5 mL预冷的无水乙醇混匀细胞,悬液放置-20 ℃固定12 h以上。PBS清洗3次,去除乙醇,加入300 μL碘化丙啶染色液,室温避光染色15 min,使用滤网过滤,流式细胞分析仪上机检测。Modfit软件分析各时期细胞情况。
1.2.8 细胞凋亡分析 6孔板接种细胞106/孔培养细胞48 h后,PBS洗涤消化细胞,转移到离心管内离心(离心半径13.5 cm,1 000 r/min,5 min),弃上清液,收集细胞,用PBS轻轻重悬细胞并计数。取(5~10)×104细胞重悬离心(离心半径13.5 cm,1 000 r/min,5 min),弃上清液,加入195 μL Annexin Ⅴ-FITC结合液轻轻重悬细胞,加5 μL Annexin Ⅴ-FITC,轻轻混匀,加入10 μL碘化丙啶染色液,轻轻混匀。室温避光孵育20 min,随后置于冰浴中,1 h内流式细胞仪检测。FlowJo软件分析凋亡细胞比例。
1.3 统计学处理
采用SPSS 13.0统计软件进行统计,采用t检验法分析比较组间差异,P<0.05为差异有统计学意义,每个实验组均重复3次以上。
2 结 果
2.1 不同类型培养方法对ADSCs细胞活力的影响
比较不同培养方法: 饥饿培养法(Hungry组)、购买的无外泌体血清培养法(SBI Exo-Free组)、超离去除外泌体血清培养法(Exo-Free组)及正常血清培养法(Control组)对ADSCs细胞活力的检测。配置培养基培养ADSCs,48 h后CCK-8法对细胞活力进行检测,结果显示,饥饿培养的ADSCs活力显著性降低(P<0.000 1),两个去外泌体血清组的细胞活力均明显降低(P<0.01),其中购买的去外泌体血清与超离法去外泌体的血清之间差异有统计学意义(P<0.01),见图1。
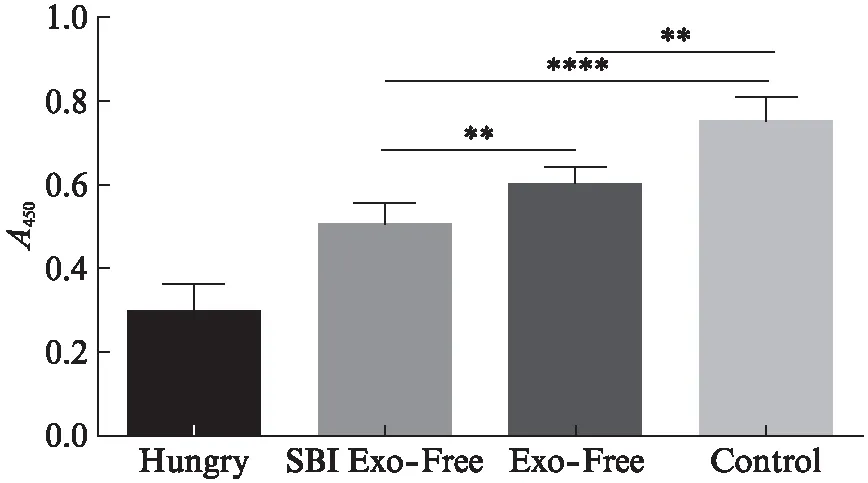
图1 不同类型培养基中ADSCs增殖情况Fig.1 Proliferation of ADSCs in different medium**P<0.01,****P<0.000 1
2.2 去除外泌体的效果
应用超离法去除血清外泌体,利用Western印迹法检测control组,以及Exo-Free组,典型外泌体蛋白标记Alix,TSG101,CD63以及骨架蛋白Actin,结果清晰表明,超离法能高效去除血清外泌体,见图2。
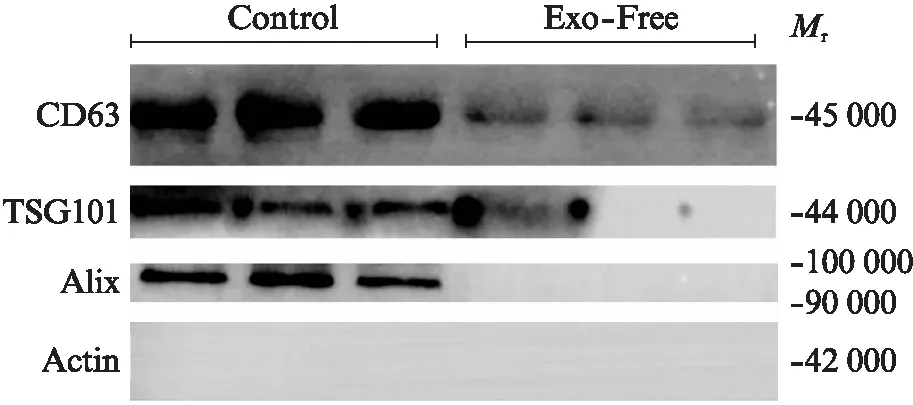
图2 Western印迹法检测蛋白表达Fig.2 Protein expression was detected by Western blotting
2.3 去外泌体血清对ADSCs和MGC803细胞的增殖情况
应用CCK-8法对Exo-Free组Control组的ADSCs和MGC803进行检测,结果表明Exo-Free组的ADSCs增殖速度较Conrol组会有一定程度的减慢,且培养时间越长细胞数量差距越大。肿瘤细胞MGC803的增殖则不受影响,见图3。
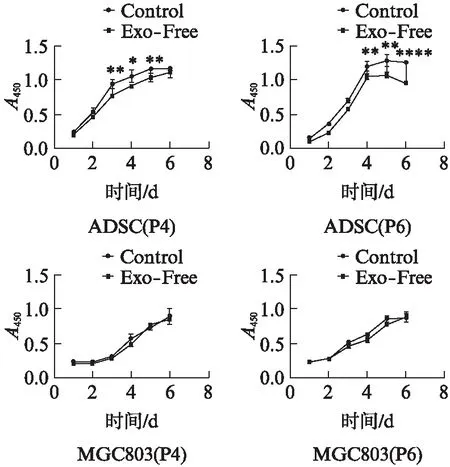
图3 ADSCs和MGC803的增殖情况Fig.3 The proliferation of ADSCs and gastric cancer MGC803 cells*P<0.05,**P<0.01,****P<0.000 1;P4: P4代细胞,P6: P6代细胞
2.4 ADSCs和MGC803的衰老情况
应用SA-β-Gal染色法对Exo-Free组和Control组的ADSCs和MGC803进行染色,随机选取10个以上视野,将阳性蓝色细胞计数并统计衰老细胞的比例。Exo-Free组的ADSCs和Exo-Free组的MGC803的衰老细胞比例均无明显变化,见图4、5。

图4 ADSCs的SA-β-Gal染色(标尺200 μm)Fig.4 SA-β-Gal staining of ADSCs(scale bar 200 μm)
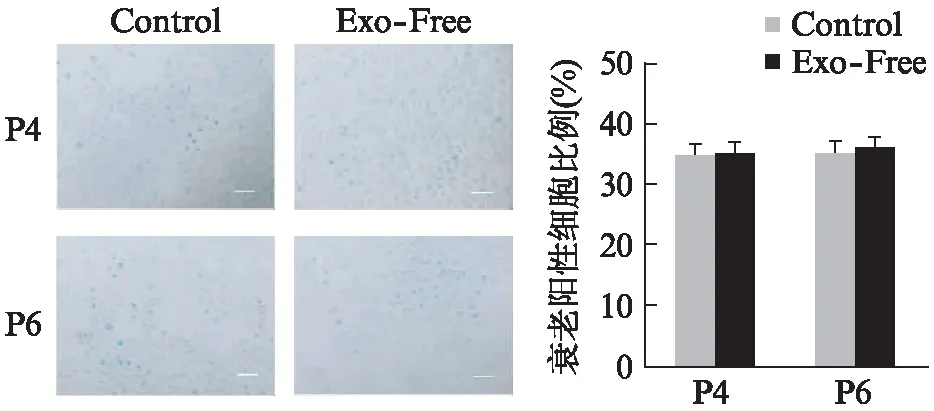
图5 MGC803的SA-β-Gal染色图片(标尺200 μm)Fig.5 SA-β-Gal staining of MGC803 cells(scale bar 200 μm)
2.5 ADSCs和MGC803的细胞周期情况
用细胞周期检测试剂盒,对固定的对数期细胞进行染色,流式细胞分析仪检测,并分析各时期细胞比例,结果显示Exo-Free组与Control组ADSCs的S期比例差异无统计学意义,见图6。Exo-Free组MGC803的S期比例略微的低于Control组,但其差异无统计学意义(P>1),可以认为对细胞周期变化无影响,见图7。
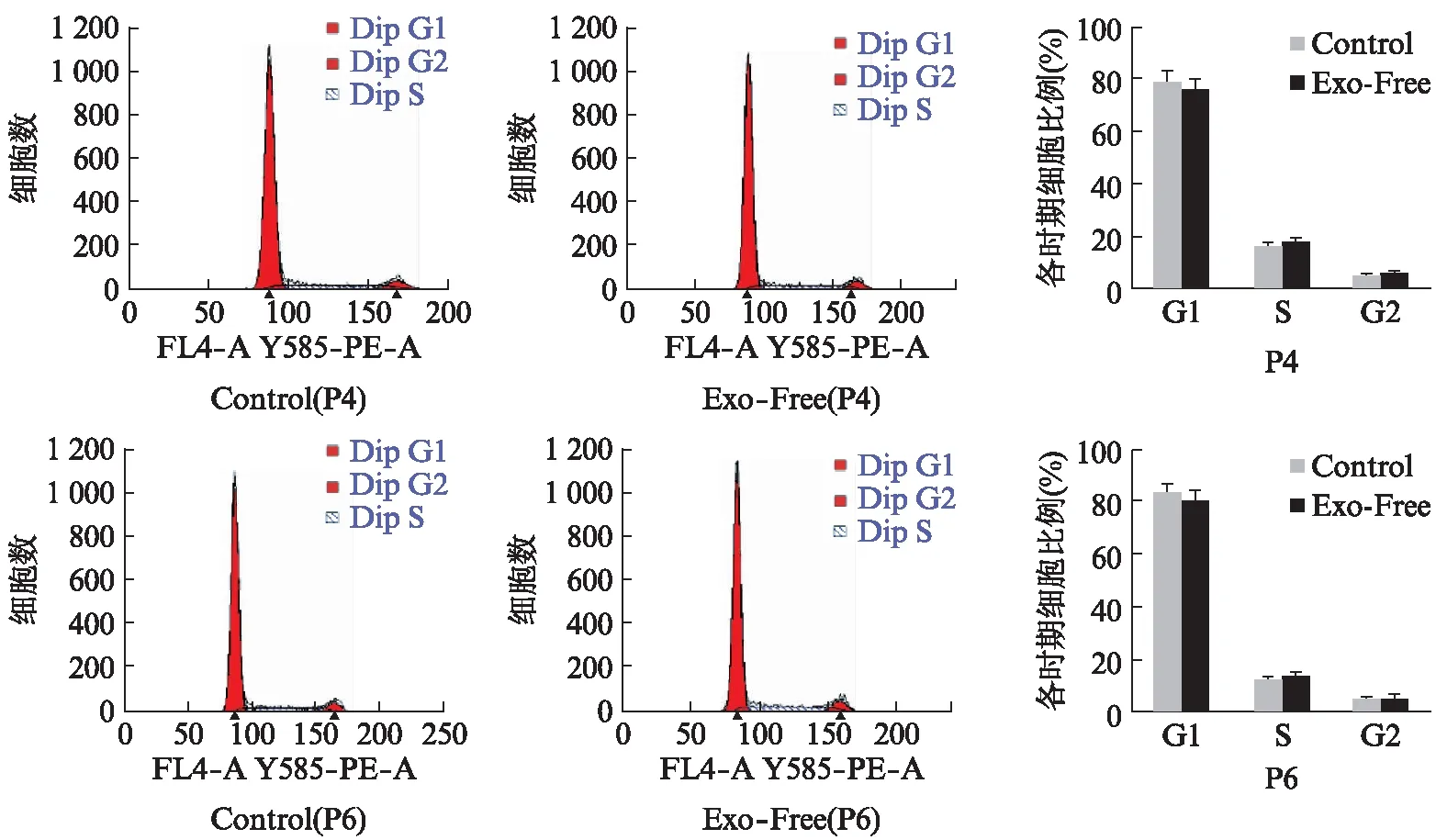
图6 ADSCs的细胞周期流式图Fig.6 Cell cycle flowcytometry diagram of ADSCs
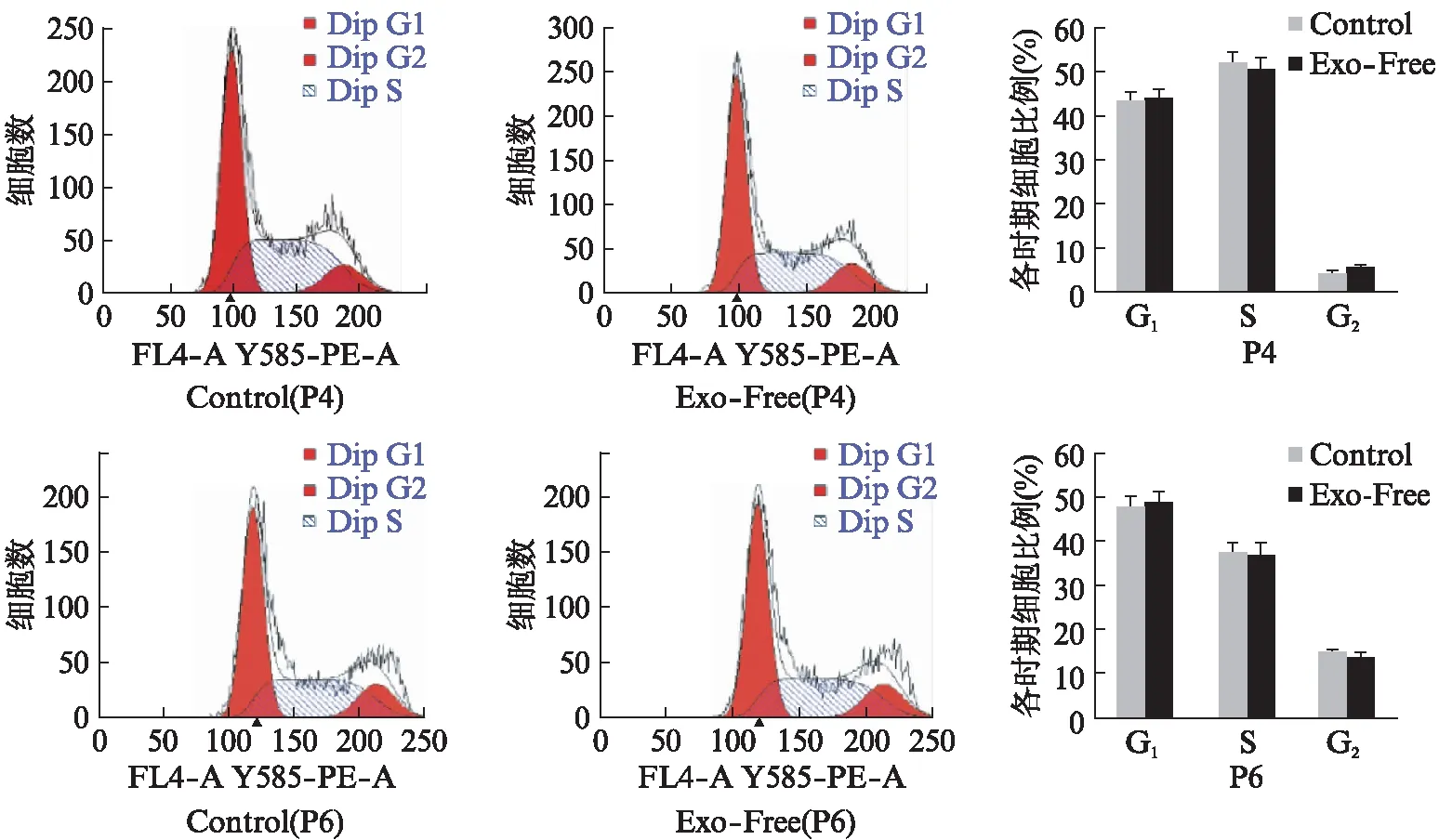
图7 MGC803的细胞周期流式图Fig.7 Cell cycle flowcytometry diagram of MGC803 cells
2.6 ADSCs和MGC803的细胞凋亡情况
用细胞凋亡检测试剂盒,对细胞进行染色,流式细胞分析仪对细胞进行检测,分析凋亡细胞比例。结果显示Exo-Free FBS的使用对ADSCs的早期凋亡不产生影响,但对晚期凋亡比例产生了显著性影响,P4和P6代一致显示Exo-Free FBS组的晚期凋亡比例上升,见图8;MGC803的实验组与对照组之间无论早期凋亡还是晚期凋亡差异均无统计学意义,见图9。结果表明超离法获得的去外泌体血清对细胞的早期凋亡无影响,对MGC803的晚期凋亡无影响。
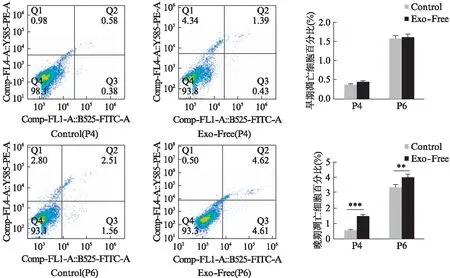
图8 ADSCs的细胞凋亡流式图Fig.8 Cell apoptosis flow cytometry diagram of ADSCs**P<0.01,***P<0.001
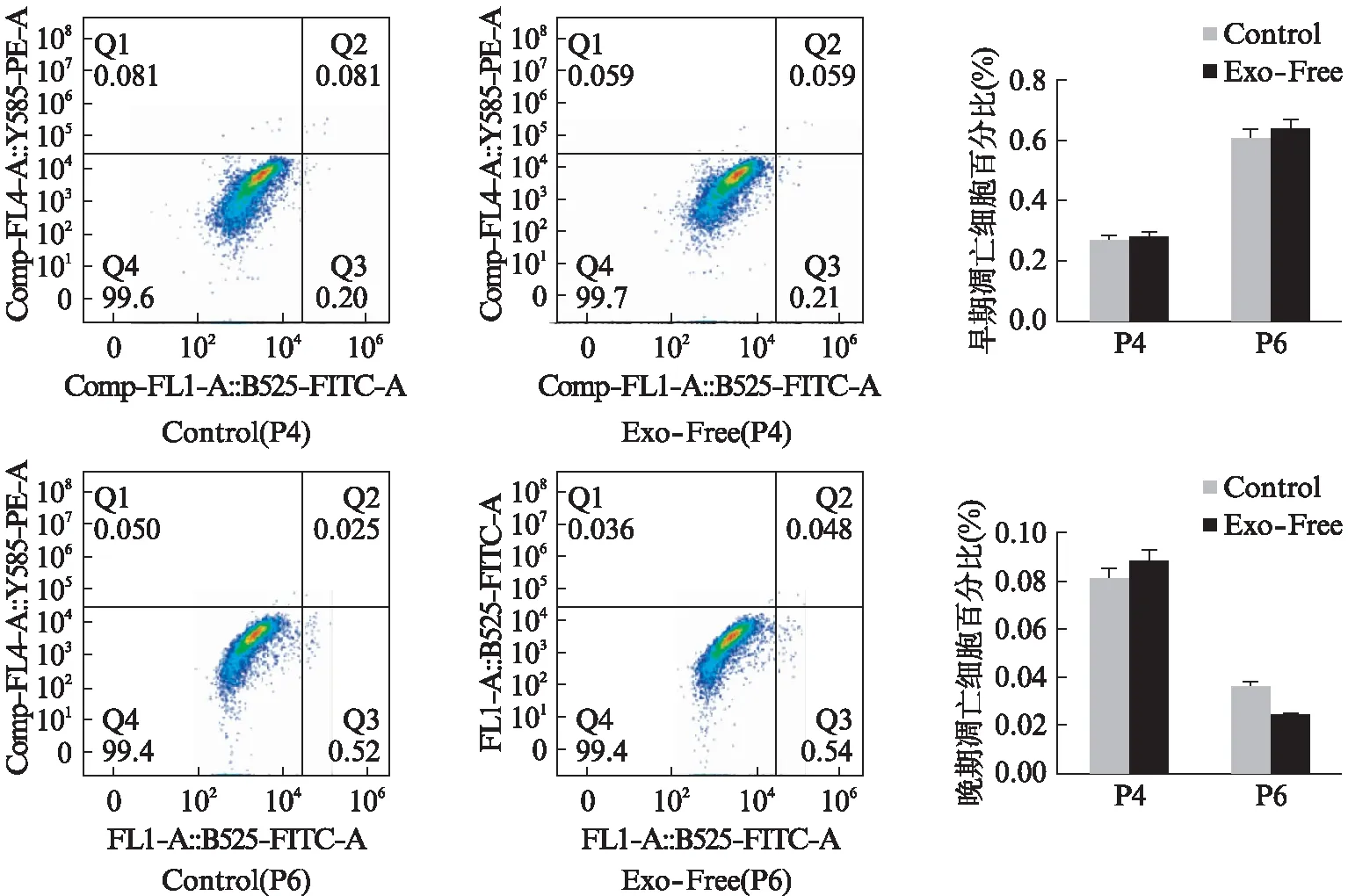
图9 MGC803的细胞凋亡流式图Fig.9 Cell apoptosis flowcytometry diagram of MGC803 cells
3 讨 论
外泌体携带大量特异性的蛋白质以及功能性生物活性物质,在体内参与细胞通信、细胞迁移、促血管新生和抗肿瘤免疫等生理过程,与多种疾病的发生和进程密切相关[16]。由于外泌体的特殊结构和功能,使它具有潜在的应用价值,一方面作为诊断多种疾病的生物指标,另一方面也可以作为治疗手段,未来作为药物的天然载体用于临床治疗[17],已成为再生医学领域无细胞治疗的理想解决方案[18]。
ADSCs-Exos的研究是近年来热点之一,ADSCs-Exos可以促进内皮细胞增殖和迁移,促使血管生成[19],且具有良好的耐受性,能降低细胞治疗带来的免疫排斥反应的问题[20],并且能解决干细胞移植的存活率低、致瘤风险等问题[21],在皮肤损伤修复,神经退行性疾病和中枢神经系统疾病治疗,肿瘤诊治等多种领域扮演着重要角色[22],但目前对于ADSCs-Exos的生物成分、功能以及发挥作用的机制仍存在很多未知,需要继续深入研究[23]。TEX的相关研究领域也是备受关注,TEX参与肿瘤微环境中细胞之间的信息传递[24],在癌细胞的生长、迁移、侵袭等过程中发挥重要作用[25],而且TEX在介导肿瘤微环境的过程中机制复杂,呈现一定的双重性,一方面通过抑制宿主免疫应答,促进肿瘤转移[26],在另一些特定条件下又起到抗肿瘤免疫作用[27]。因此,对不同条件下TEX的成分以及信号传递分子机制的研究,有望了解肿瘤免疫相关机制并开发肿瘤标志新型分子靶点[28],为肿瘤早期诊断以及预后判断提供了新的方向[29]。
然而在研究某种特定的细胞分泌的外泌体时,通常需要提取细胞上清液,而在细胞培养过程中对于大多数细胞来说,标准培养基须在基础培养基中外加FBS作为生长添加物。常用的FBS含有大量的牛源外泌体,这些外泌体含有牛相关蛋白质或miRNA等分子,对于相关细胞自身分泌外泌体的提取和研究,牛血清中的外泌体可能会造成严重的背景问题,从而影响或干扰结果的判断。一些研究中直接选择采用无血清培养法,但饥饿培养法往往对细胞活力影响巨大,所以在一些高质量的文献中[30-34]研究者更倾向于使用含有去除外泌体的血清培液来培养细胞,收集上清液分离细胞外泌体。因此通过适当的分离技术获得去除外泌体的血清,排除血清中外源干扰获得纯净的细胞源外泌体样本是必要的。
市面上已存在一些商业化的无外泌体血清产品,但这些产品不仅价格昂贵并且可能对不同细胞的生长情况造成一定的影响[35]。本研究使用的去除血清外泌体的超离法,即离心(半径88 cm,34 800 r/min,18 h)取上层约80%的上清液后0.45 μm滤器过滤,是建立在已有文章报道基础上[14-15]。此方法使用的设备简单,操作步骤较少容易实现,Western印迹法结果显示去除外泌体的效率极为可观。一次操作可获取200 mL左右的去除外泌体血清,冻存后可供后续使用,与购买的无外泌体血清商品其高达2 500元(50 mL)的费用相比,在大量科研工作的进行过程中操作可行具有经济优势。为研究超离方法获得的去外泌体血清在细胞生长过程中是否会产生影响,本次选择了外泌体研究领域较为关注的两种细胞进行了研究。在ADSCs中,超离法获得的去外泌体血清对增殖的影响比购买的无血清外泌体小,且其差异有统计学意义(P<0.01),说明超离法比商品化获得的无外泌体血清更适用于ADSCs的培养。接着,为了验证超离法获得的去外泌体血清对细胞生长状况的影响,将去除外泌体的血清作为实验组(Exo-Free组)配制培养基培养细胞与对照组进行对比,在ADSCs中结果显示,ADSCs的增殖速度会因血清外泌体的去除显著降低,细胞数量差异呈现随生长时间增加的累积效果,P4代显示P<0.01,P6代达到P<0.000 1;在细胞周期和细胞衰老的分析中,Exo-Free组均无明显变化;在细胞凋亡方面,Exo-Free组的ADSCs的早期凋亡无显著性差异,Exo-Free组的晚期凋亡比例有显著性升高,具体原因需要进一步探索。总体来说,可以认为超离法去除的外泌体对ADSCs的生长状况并无明显影响。在肿瘤细胞MGC803中结果显示,超离法去除血清外泌体对细胞增殖、衰老和凋亡均不产生影响,Exo-Free组的S期细胞比例有一定的变化,但差异无统计学意义。综上所述,超离法可以有效去除血清外泌体对细胞外泌体研究的干扰且对ADSCs和肿瘤细胞MGC803的活性不产生影响。特别是在对血清的要求比较高的干细胞上,商品化去外泌体血清可能不适合干细胞生长,改变细胞培养基条件可能会影响干细胞的生物学活性及干细胞外泌体的效应。本团队认为完全可以使用本研究中的超离方法自行制备去外泌体血清,即解决血清外泌体的干扰问题又有一定经济价值。本研究为外泌体研究中的细胞培养用去外泌体血清的获取提供了新的思路与策略,在饥饿培养和购买昂贵的商业化去外泌体血清找到了平衡点。
本研究中讨论的方法仍存在一些局限性,目前仅针对外泌体的分离去除的应用进行验证,超离法是否也适合对细胞培养液上清液中目标外泌体的提取,是否可以保证外泌体提取过程中不被破坏,在未来的研究中,可以进一步在高分辨率显微镜下观察分离后的外泌体的形态是否完整,并将分离的外泌体使用到机制研究中,去验证提取的外泌体是否保持活性且具备相应的功能。未来继续改进现有的方法,得到理想的外泌体提取技术,并建立统一的操作体系,探索、开发及优化获得质量均一、能大规模生产和存储的外泌体的相关技术,将为外泌体研究进展和临床的应用提供技术基础。
