基质细胞衍生因子1、趋化因子受体4和淋巴管新生在子宫内膜异位症中的意义
2020-04-17周雅娟开海丽乔海风张连锁吴刘成刘颖蕾刘曼华
周雅娟,开海丽,乔海风,张连锁,吴刘成,刘颖蕾,刘曼华
子宫内膜异位症(endometriosis,EMs)是一种常见的妇科疾病,指子宫内膜中的腺体和基质异位到子宫以外的部位,种植、生长形成异位病灶,常伴有盆腔痛、痛经、不孕等临床表现[1]。目前尚无学说可以明确解释EMs的发病机制。1921年Sampson提出“经血逆流学说”的同时提出子宫内膜也可以通过淋巴传播[1]。不少学者在盆腔淋巴管、淋巴结中发现子宫内膜组织。有研究指出,在腹膜型及深部浸润型EMs异位内膜中淋巴管数目大于正常组织,但尚无研究明确子宫内膜进入淋巴系统的机制。基质细胞衍生因子1(SDF-1)是趋化因子的一种,与其特异性受体趋化因子受体4(CXCR4)结合后在多种恶性肿瘤淋巴管新生、淋巴转移中发挥重要作用[2-3]。D2-40是新近发现的最具特异性的新生淋巴管特异性标记物[4],所标记出的淋巴管数目以微淋巴管密度(microlymphatic vessel density,MLVD)表示。EMs与恶性肿瘤有相似的生物学行为,因此本研究通过检测正常内膜、在位内膜和异位内膜中SDF-1、CXCR4以及D2-40标记的MLVD,探讨SDF-1、CXCR4在EMs淋巴管新生、子宫内膜细胞淋巴迁移中的意义。
1 对象与方法
1.1 研究对象选取2017年11月—2018年5月就诊于南通大学第二附属医院的患者。试验组为因卵巢型EMs行腹腔镜下卵巢子宫内膜异位囊肿剥除术的患者(n=20),术前行诊刮术取在位内膜,术中取囊肿壁为异位内膜。取同期因子宫肌瘤行子宫切除或子宫肌瘤挖除术患者的子宫内膜作为对照组(n=20)。所有患者年龄25~45岁,无其他内外科合并症,术前3个月内未使用激素类药物,所取标本均经病理学确诊。取材过程严格遵守伦理学标准,均取得患者本人的知情同意。
1.2 实验试剂Trizol购自生工生物工程(上海)股份有限公司,聚合酶链反应(PCR)引物由其合成;逆转录、SYBR Green Master Mix购自美国 Thermo公司;SDF-1多克隆抗体、CXCR4单克隆抗体和D2-40单克隆抗体购自美国Abcam公司;免疫组织化学(免疫组化)试剂盒、鼠抗人细胞角蛋白和波形蛋白购自北京中杉金桥生物技术有限公司;DMEM/F-12培养基、10%胎牛血清和Ⅳ型胶原酶购自美国Gibco公司;人SDF-1α购自美国PeproTech公司。
1.3 研究方法
1.3.1 实时定量PCR(RT-PCR)检测SDF-1和CXCR4 mRNA表达水平 用Trizol抽提组织mRNA,分光光度计检测RNA浓度。采用梯度PCR扩增仪逆转录合成cDNA,应用RT-PCR仪进行扩增。以β-actin为参照物,反应条件均按照试剂盒说明书执行。所需引物见表1。

表1 RT-PCR所需引物序列
1.3.2 免疫组化法检测SDF-1、CXCR4和D2-40蛋白表达水平 将所有标本用10%甲醛固定,石蜡包埋,4 μm厚连续切片并脱蜡,二甲苯、乙醇脱水,进行HE染色确认为子宫内膜组织。切片经枸橼酸盐缓冲液抗原修复后,操作步骤严格按照SP免疫组化试剂盒进行。磷酸盐缓冲液(PBS)代替一抗作为阴性对照。镜下观察,以细胞膜和(或)细胞质呈清晰棕黄色或棕褐色颗粒为阳性表达。采用Image-J图像分析系统对切片进行分析,计算SDF-1、CXCR4阳性细胞的积分光密度(integrated optical density,IOD)和总面积(area)。以平均光密度值(mean denisty,MD)作为 SDF-1、CXCR4 的表达强度,MD=IOD/area。D2-40阳性定位于淋巴管内皮细胞,呈黄褐色。每个D2-40染色阳性的内皮细胞、内皮细胞簇或单个微小脉管均计数为1个微淋巴管。MLVD判定方法[5]:先在低倍镜下(×100)选取脉管数目最多的两个区域,即“热点”,然后在高倍镜下(×200)观察每个热点中的5个视野,计数其中脉管数。最后计算2个热点、5个视野的平均值作为该标本的MLVD。
1.3.3 异位子宫内膜间质细胞的分离和原代培养 细胞培养方法参照文献[6]并加以改进。将所取内膜标本用PBS冲洗3次后剪碎,以0.125%胶原酶37℃消化30 min后于倒置显微镜下观察到细胞脱落、游离后,将消化液吸出,经400目不锈钢细胞滤网过滤至含10%胎牛血清的DMEM-F12培养基的离心管内终止消化。将未消化组织重复上述步骤2~3次。收集的细胞滤液以1 000 r/min离心5 min,弃上清液,沉淀用含10%胎牛血清的DMEM-F12培养液混悬后转至培养瓶中,置于37℃、5%CO2培养箱中培养。波形蛋白主要表达于基质细胞,细胞角蛋白表达于腺上皮细胞,选择相应的抗体采用免疫组化法进行细胞鉴定。实验所用基质细胞均为2~6代。
1.3.4 细胞划痕实验 将细胞按4×105/mL的密度接种于6孔板中,待细胞长满后用100 μL吸头在6孔板内垂直划痕,用PBS清洗3次。对照组孔内加入DMEM-F12培养液,试验组孔内加入等体积50 ng/mL SDF-1溶液,继续培养24 h后,在倒置光学显微镜下随机取点观察并拍照。采用Image-J图像分析划痕面积。细胞迁移率=(0 h划痕面积-24 h划痕面积)/0 h划痕宽度×100%。
1.4 统计学方法采用SPSS 20.0统计软件进行统计分析。定量资料用均数±标准差(±s)表示,异位内膜组和在位内膜组SDF-1、CXCR4 mRNA和蛋白质及MLVD比较采用配对t检验;异位内膜组或在位内膜组与正常内膜组的比较及细胞迁移率的组间比较采用两独立样本均数的t检验。P<0.05为差异有统计学意义。
2 结果
2.1 异位、在位及正常内膜中SDF-1、CXCR4 mRNA和蛋白的表达情况SDF-1、CXCR4 mRNA和蛋白在异位内膜中的表达水平高于在位内膜和正常内膜,在位内膜中的表达水平高于正常内膜,差异均有统计学意义(均 P<0.01),见表1。SDF-1、CXCR4在子宫内膜基质细胞和腺体细胞中均有表达。3组内膜中,SDF-1在腺体细胞中的表达强度均高于基质细胞。CXCR4在异位内膜中主要表达于腺体细胞,而在位内膜和正常内膜基质细胞中CXCR4的表达强度高于腺体细胞。见图1(见封三)。
表1 异位、在位及正常内膜中SDF-1、CXCR4 mRNA和蛋白的表达情况 (±s)
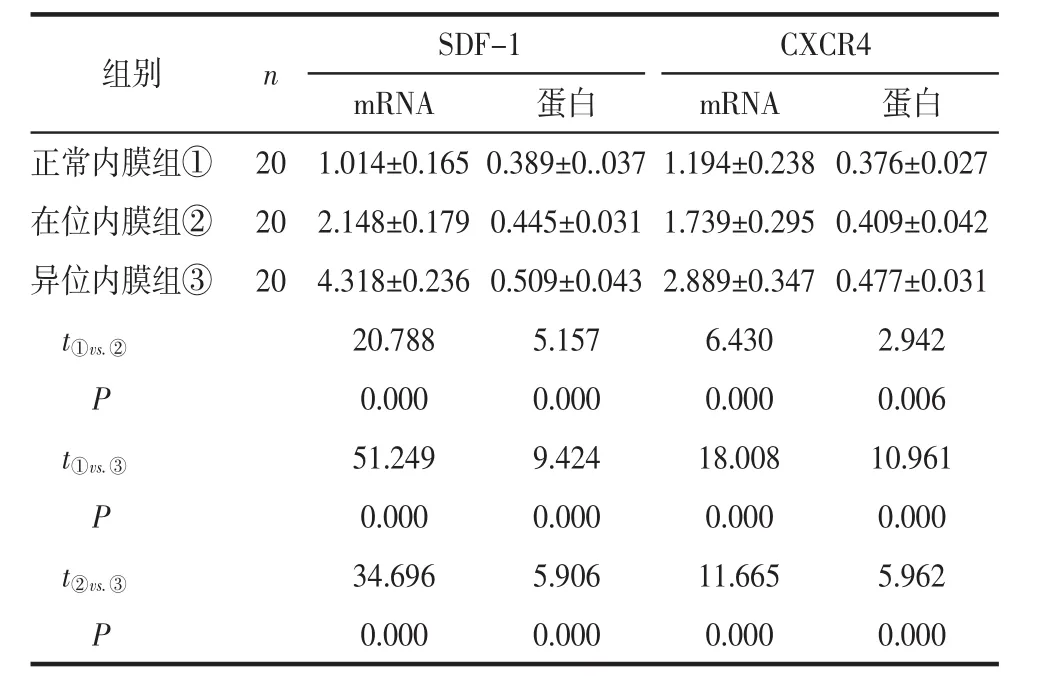
表1 异位、在位及正常内膜中SDF-1、CXCR4 mRNA和蛋白的表达情况 (±s)
组别 n SDF-1 CXCR4 mRNA 蛋白 mRNA 蛋白正常内膜组① 20 1.014±0.165 0.389±0..037 1.194±0.238 0.376±0.027在位内膜组② 20 2.148±0.179 0.445±0.031 1.739±0.295 0.409±0.042异位内膜组③ 20 4.318±0.236 0.509±0.043 2.889±0.347 0.477±0.031 t①vs.② 20.788 5.157 6.430 2.942 P 0.000 0.000 0.000 0.006 t①vs.③ 51.249 9.424 18.008 10.961 P 0.000 0.000 0.000 0.000 t②vs.③ 34.696 5.906 11.665 5.962 P 0.000 0.000 0.000 0.000
2.2 异位、在位及正常内膜中D2-40标记的MLVD比较D2-40阳性定位于淋巴管内皮细胞的细胞膜和细胞质。正常内膜中淋巴管管腔较大、形态完整,在位和异位内膜中淋巴管内皮细胞多不连续、管腔不完整、管壁薄(见图1,见封三)。异位内膜、在位内膜和正常内膜中MLVD分别为(20.98±1.77)LV/mm2、(5.67 ±1.45)LV/mm2、(1.77 ±1.22)LV/mm2。异位内膜中MLVD高于在位和正常内膜,差异有统计学意义(n=20,t=34.912,P=0.000;t=39.970,P=0.000)。在位内膜中MLVD高于正常内膜,差异有统计学意义(n=20,t=9.179,P=0.000)。
2.3 异位内膜细胞鉴定结果异位内膜基质细胞细胞核较大,细胞膜表面有胞浆突起,边界不清,呈纺锤状。免疫组化结果示:细胞角蛋白阴性,波形蛋白阳性,其纯度达95%以上。见图2(见封三)。
2.4 细胞迁移实验培养24 h后,DMEM-F12组划痕面积大于SDF-1组(见图3)。DMEM-F12组细胞迁移率为(36.06±2.92)%,SDF-1组细胞迁移率为(50.17±2.76)%,SDF-1组细胞迁移率高于 DMEMF12 组,差异有统计学意义(n=20,t=15.714,P=0.000)。见图3(见封三)。
3 讨论
EMs是一种常见的育龄期女性疾病,其发生机制尚不明确。SDF-1是CXC类趋化因子,由骨髓、子宫内膜等多种器官的基质细胞和内皮细胞产生,与其特异性受体CXCR4结合后激活下游信号通路,诱导靶细胞迁移和细胞骨架重排,广泛参与多种生理、病理过程[7]。研究报道,卵巢癌、乳腺癌患者体内过度表达雌激素受体(ER),雌二醇(E2)可以刺激癌细胞中SDF-1分泌增加,并通过E2-SDF-1-CXCR4通路介导癌细胞的增殖,SDF-1作为雌激素的直接作用靶点,在疾病发展过程中发挥重要作用[8]。EMs是雌激素依赖性疾病,因此本研究对SDF-1、CXCR4与EMs发病机制之间的关系进行了探究。
近年来,SDF-1、CXCR4与淋巴管生成、肿瘤淋巴转移的关系逐渐成为研究热点。研究指出,胰腺癌[2]、乳腺癌[3]患者的原发性肿瘤、癌旁组织、淋巴结中SDF-1表达水平逐渐升高,并且CXCR4表达水平越高,肿瘤原发部位的浸润率越高;同时,存在淋巴转移和TNM分期越高的患者新生淋巴管数目越多,提示SDF-1、CXCR4参与肿瘤的淋巴转移,与患者的预后密切相关。EMs虽是良性疾病,但具有转移性、侵袭性和高复发率等恶性生物学特征。在本研究中,采用RT-PCR和免疫组化法检测正常、在位和异位内膜中SDF-1和CXCR4 mRNA和蛋白的表达水平,结果发现3组内膜中SDF-1 mRNA和蛋白的表达水平呈递增趋势,异位内膜中的表达水平显著高于在位和正常内膜,在位内膜中的表达水平显著高于正常内膜(P<0.05)。有研究指出,子宫内膜基质细胞在雌激素刺激下可分泌SDF-1,并呈时间和浓度依赖性[9]。众所周知,EMs是一种雌激素依赖性疾病,异位组织中雌激素代谢紊乱,其浓度是在位内膜的4~5倍[10-11],因此在高雌激素作用下,SDF-1表达水平响应性地升高,该趋势与本研究结果一致。鉴于以上研究结果,推测SDF-1、CXCR4表达异常参与了子宫内膜异位病灶的形成,在子宫内膜细胞的淋巴迁移中发挥一定作用。
D2-40是一种肾小球足突细胞膜表面的跨膜黏蛋白,既不能使有周细胞/平滑肌的大淋巴管显色,也不与血管内皮反应,对新生淋巴管具有高度特异性[12]。D2-40标记阳性的淋巴管数目通常以MLVD表示。在腹膜型、深部浸润型EMs中,异位病灶MLVD较相对应的正常组织均升高。本研究对卵巢型EMs异位组织进行研究,结果发现异位内膜中的MLVD显著增高,高于在位和正常内膜(P<0.05),在位内膜中MLVD约为正常内膜的3倍,进一步证实了淋巴系统在子宫内膜异位过程中扮演重要角色。Zhuo等[13]在小鼠体内注射SDF-1,发现小鼠体内新生淋巴管数目与SDF-1呈浓度相关性,说明SDF-1可直接促进淋巴管生成。同时SDF-1可利用相关通路诱导血管内皮生长因子 C(VEGF-C)分泌[14],VEGF-C 与淋巴管内皮细胞上的膜型酪氨酸激酶受体VEGFR-3结合后,诱导淋巴管内皮细胞增殖,促进淋巴管生成[15]。因此,EMs中SDF-1、CXCR4表达升高可能促进淋巴管新生,为内膜细胞淋巴传播提供了条件。
趋化因子作为趋化介质,其基本功能是吸引表达相应受体的靶细胞沿浓度梯度趋化性迁移。在本研究中,经SDF-1培养后的子宫内膜基质细胞的迁移率高于对照组(P<0.05),表明SDF-1可以有效促进子宫内膜细胞的迁移。本研究观察到在位内膜和异位内膜中新生淋巴管管壁薄,管腔不完整,呈扩张状态,异位内膜中的淋巴管多位于囊腔面。这些形态特征有利于CXCR4阳性的子宫内膜基质细胞侵袭,内膜细胞进入新生淋巴管后沿SDF-1浓度梯度趋化性迁移,在SDF-1高表达的部位种植、生长,形成异位囊肿,完成淋巴途径迁移。
综上所述,EMs中SDF-1、CXCR4高表达,新生淋巴管数目增多,提示SDF-1、CXCR4可能与EMs淋巴管新生、内膜细胞淋巴迁移有一定关联。EMs发病机制复杂,能否将降低SDF-1、CXCR4的表达、阻断淋巴管生成作为治疗该疾病新的切入点,仍需进一步的探究。
