宫颈癌新辅助化疗前后BAG-1、MCM2的表达及其与化疗疗效的相关性
2020-04-17宋丽娟康雅琼李晓琴魏春燕戴银桥张骞文狄晓鸿
宋丽娟,向 琳,金 荣,康雅琼,李晓琴,魏春燕,戴银桥,张骞文,狄晓鸿
宫颈癌是发展中国家女性癌症中发病率仅次于乳腺癌的恶性肿瘤[1],也是严重威胁女性生命和生活质量且死亡率很高的恶性肿瘤,近年来,其发病年龄也趋于年轻化。宫颈癌5年生存率约55%,近50%患者治疗后复发转移。甘肃省是宫颈癌高发省份,宫颈癌病死率在全国也处于前列[2],大多患者就诊时即为局部晚期(巨块型)宫颈癌。新辅助化疗(neoadjuvant chemotherapy,NACT)是宫颈癌治疗的重要手段之一,然而随着NACT在临床的广泛应用,发现部分宫颈癌患者对NACT不敏感,从而影响化疗效果并贻误治疗时机。因此,寻找与NACT药物敏感性相关因子,是宫颈癌个体化治疗的关键所在。细胞凋亡在肿瘤细胞对化疗药物的敏感性方面发挥着重要作用,细胞凋亡信号途径激活能增强多种肿瘤细胞对化疗药物的敏感性,而凋亡信号传导通路缺陷或抑制可导致肿瘤细胞对化疗药物抵抗性增加[3]。B细胞淋巴瘤基因2(B-cell lymphoma-2,Bcl-2)结合致癌基因1(Bcl-2 associated athanogene-1,BAG-1)是一个凋亡相关的多功能蛋白,具有抗细胞凋亡的作用[4]。BAG-1可与Bcl-2结合,通过影响蛋白质的稳定性而显著增强Bcl-2的抗凋亡作用[5]。微小染色体维持蛋白 2(mini chromosome maintenance protein 2,MCM2)是一种细胞周期蛋白,是DNA复制起始的主要调控因子之一,MCM2过表达与多种恶性肿瘤的发生、发展相关。目前,BAG-1及MCM2蛋白表达与宫颈癌NACT疗效的相关性报道尚少见。本研究通过免疫组织化学(免疫组化)检测NACT前、后宫颈癌组织中BAG-1及MCM2蛋白的表达,并分析其与化疗疗效的相关性,以期为寻找可以预测宫颈癌化疗疗效的生物标志物提供新思路。
1 对象与方法
1.1 研究对象2015年1月—2018年6月甘肃省肿瘤医院(我院)收治的宫颈癌患者共312例,选择符合以下标准者入组研究:①病理确诊为宫颈癌,包括鳞状细胞癌和腺癌;②国际妇产科联盟(FIGO)分期Ⅰb2~Ⅱa2期;③首次治疗前未接受过任何抗肿瘤治疗,且首次治疗在我院进行并完成全程治疗;④肝肾功能正常;⑤未合并其他恶性肿瘤;⑥行广泛子宫切除+双侧盆腔淋巴结清扫术。排除标准:①术前接受过放疗、非铂类化疗药物化疗、生物免疫治疗等抗肿瘤治疗;②出现严重化疗不良反应而终止治疗;③合并其他恶性肿瘤;④严重的心、肝、肾等脏器功能不全;⑤患有严重的神经、精神疾病;⑥病历资料不完整。最终纳入宫颈癌患者90例(宫颈癌组),收集同一患者化疗前宫颈活检及化疗后手术切除标本石蜡包埋组织。选择60例同期因子宫肌瘤手术切除的正常宫颈组织作为正常对照组。
1.2 主要试剂兔抗人单克隆抗体BAG-1(浓缩型,Y166)购自英国Abcam公司,兔抗人单克隆抗体MCM2(即用型,ZA-0642)及EnVision两步法免疫组化试剂盒购自北京中杉金桥公司。
1.3 免疫组化检测方法所有石蜡包埋样本均采用免疫组化EnVision两步法检测组织中BAG-1及MCM2蛋白的表达。BAG-1工作浓度为1∶1 000,MCM2为即用型抗体。所有石蜡包埋组织均切成4 μm厚切片,经常规脱蜡脱水后,柠檬酸盐(pH=6.0)高温高压修复5 min,冷却至室温后磷酸盐缓冲液(PBS)冲洗3次×3 min,滴加3%H2O2去离子水常温10 min以降低内源性过氧化物酶活性。之后PBS冲洗3次×3 min,滴加一抗(BAG-1工作浓度1∶1 000)37℃温箱孵育2 h,从温箱取出湿盒,PBS冲洗3次×3 min,滴加二抗37℃温箱孵育20 min,PBS冲洗 3次×3 min,DAB 显色 5 min,苏木精复染后封片。PBS代替一抗为阴性对照。
1.4 免疫组化检测结果判定标准BAG-1定位于细胞质/核,根据Xie等[6]的评价标准,采用着色百分比及着色强度相结合的判读模式。着色比例:0分,细胞无着色;1分,<30%细胞着色;2分,31%~70%细胞着色;3分,>71%细胞着色。着色强度:0分,细胞无着色;1分,微弱淡黄色;2分,中等强度棕黄色;3分,强棕褐色。将两项得分相加,0~3分为低表达,4~6分为高表达。MCM2定位于细胞核,根据Amaro等[7]的评价标准,采用着色比例评价标准。无细胞着色为0分,阳性细胞数<25%为1分,26%~75%为2分,>75%为3分。0分和1分为低表达,2分和3分为高表达。
1.5 治疗方法NACT方案为以铂类为基础化疗方案:紫杉醇联合顺铂[8]。紫杉醇150 mg/m2+顺铂75 mg/m2静脉化疗,每21 d为1个疗程,均化疗2个疗程。化疗前后进行常规妇科检查、B型超声(B超)、胸片、血常规及心电图检查。化疗结束2周,根据妇科检查及B超情况,综合评价疗效后,均行广泛子宫切除+双侧盆腔淋巴结清扫术。本研究经甘肃省医学科学研究院伦理委员会批准,所有患者化疗前均签署知情同意书。
1.6 临床疗效判定标准根据世界卫生组织(WHO)疗效判定标准[9]判断临床疗效。完全缓解(CR):所有肿瘤病灶完全消失;部分缓解(PR):肿瘤病灶缩小≥50%以上;稳定或无变化(SD):肿瘤病灶变化介于PR和进展(PD)之间;PD:肿瘤病灶增大超过25%或出现新肿瘤病灶。CR+PR为临床有效,SD+PD为临床无效。
1.7 统计学方法采用SPSS 22.0软件进行统计学分析。定性资料采用例数(百分比)表示,组间比较采用χ2检验,若T<5,采用校正χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料90例宫颈癌患者年龄30~69岁,中位年龄47岁。鳞状细胞癌76例,其中高分化11例、中分化37例、低分化28例;腺癌14例,其中高分化2例、中分化8例、低分化4例。肿瘤最大径线≥4 cm者57例,<4 cm者33例。FIGO分期:Ⅰb2~Ⅰb3期38例,Ⅱa1~Ⅱa2期52例。所有病理切片均由2位副高级职称以上病理医生根据FIGO 2018分期标准进行诊断及复核,所有病例临床病理资料均完整。
2.2 宫颈癌组织及正常宫颈组织中BAG-1及MCM2表达情况BAG-1及MCM2蛋白在宫颈癌组织中的高表达率均高于正常宫颈组织,差异有统计学意义(均P=0.000),见表1。

表1 BAG-1及MCM2蛋白在宫颈癌组及正常宫颈组织中的表达[例(%)]
2.3 宫颈癌NACT前、后BAG-1及MCM2蛋白表达变化NACT前宫颈活检组织及NACT后手术切除标本中BAG-1及MCM2蛋白高表达率比较,差异均无统计学意义(均P>0.05),见表2。
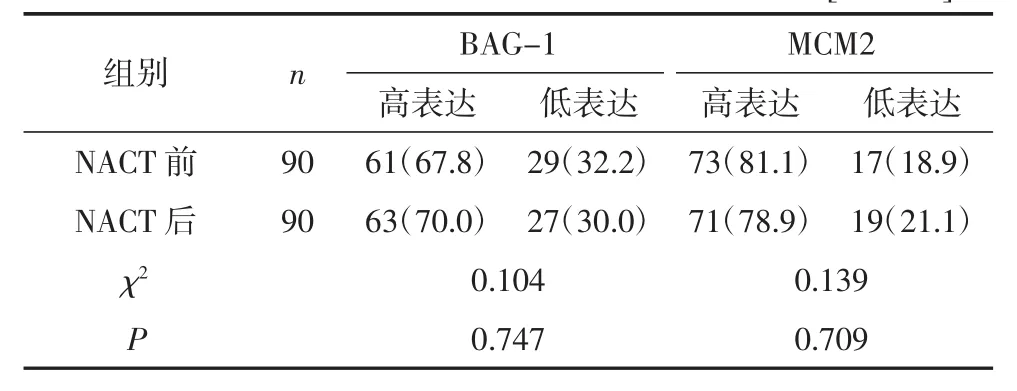
表2 BAG-1及MCM2蛋白NACT前、后表达情况[例(%)]
2.4 NACT临床疗效及与宫颈癌临床病理特征的关系所有入组患者NACT结束2周后根据WHO疗效判定标准进行疗效评价。90例宫颈癌患者中有效 59例(65.6%),其中 CR 6例(6.7%)、PR 53例(58.9%);无效31例(34.4%),其中SD 27例(30%)、PD 4例(4.4%)。NACT疗效与年龄、病理类型、分化程度、肿瘤最大径线及FIGO分期均无关(均P>0.05),见表3。
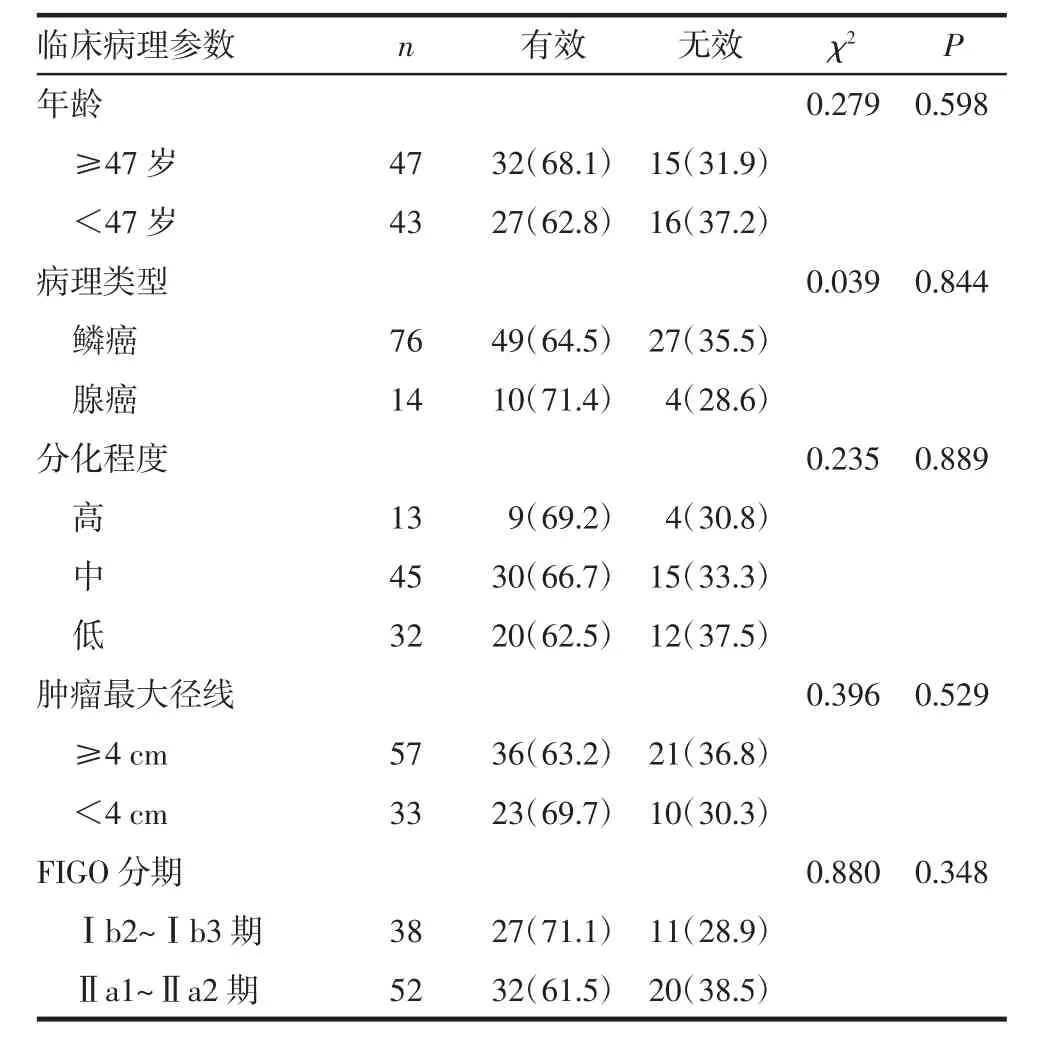
表3 NACT化疗疗效与临床病理特征的关系[N=90,例(%)]
2.5 BAG-1及MCM2蛋白表达与NACT疗效的关系化疗有效组BAG-1高表达率低于无效组,差异有统计学意义(P=0.000),见表4及图1(见后插二)。MCM2高表达率在2组间相比差异无统计学意义(P>0.05),见表4及图 2(见后插二)。
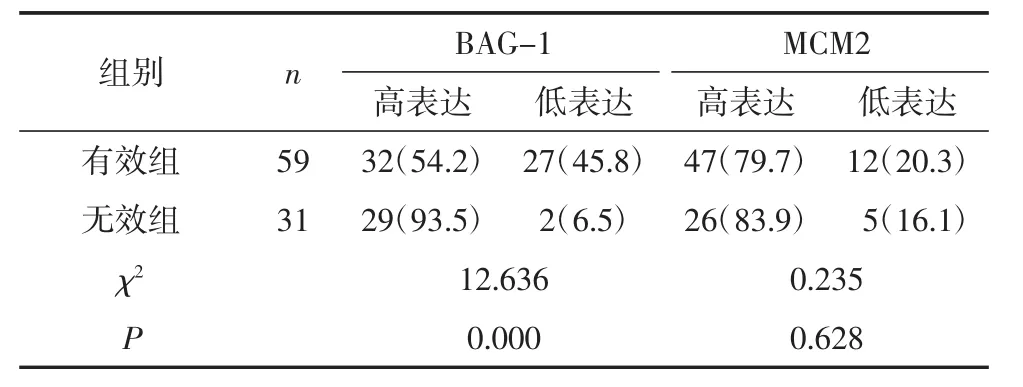
表2 BAG-1及MCM2蛋白NACT前、后表达情况[例(%)]
3 讨论
NACT可缩小肿瘤体积、改善宫旁浸润情况、降低手术难度、提高手术成功率、降低盆腔淋巴结转移率[10]。以铂类为基础的联合化疗在宫颈癌NACT中占重要地位[11],但化疗中出现的肿瘤多药耐药(multidrug resistance,MDR)现象却又严重影响临床疗效和患者预后。因此,深入研究以铂类为基础的化疗MDR形成机制,寻找药物敏感性靶基因位点作为研究耐药形成的切入点,是肿瘤研究与治疗中的难点,也是国内外研究热点,是亟待解决的关键问题,具有重要的理论意义和实际价值。
铂类药物抗肿瘤主要是通过与肿瘤细胞DNA结合,形成铂-DNA螯合物,造成DNA双螺旋扭曲、解旋及染色体破坏,抑制肿瘤细胞DNA复制,并损伤其细胞膜上的结构,使细胞停滞于G2期,从而诱导细胞凋亡。铂类药物耐药与多种因素相关,目前认为主要与谷胱甘肽转移酶(GST)活性增强[12]、DNA损伤修复增强、拓朴异构酶活性改变、细胞凋亡抑制等有关。细胞凋亡和肿瘤MDR是目前影响化疗疗效最关键的两个因素。多数化疗药物通过诱导细胞凋亡而发挥作用,如果抗细胞凋亡通路异常激活或细胞凋亡通路失活,导致抗凋亡基因过表达或促凋亡基因丢失,都会导致肿瘤细胞耐药。
抗凋亡蛋白表达增加是细胞凋亡抑制最主要的原因之一,可以降低肿瘤细胞对化疗药物的敏感性,导致MDR发生。BAG-1是一种抗凋亡蛋白,可与Bcl-2、多种核激素受体和Hsp70相互作用[13]。BAG-1具有多种亚型,通过与大量的细胞靶点相互作用来实现其抗凋亡作用。国内外研究表明,BAG-1在正常组织几乎不表达,而在许多恶性肿瘤中高表达,且证实BAG-1调控的信号通路在癌症的发生、发展、侵袭、转移以及患者对癌症治疗的反应性及预后等方面起重要作用。BAG-1在非小细胞肺癌中高表达,与肿瘤侵袭及肿瘤细胞对酪氨酸激酶抑制剂产生抵抗相关[14]。Huang等[15]在体内外研究中发现,通过小干扰RNA(siRNA)下调BAG-1在结直肠癌细胞中的表达,可以显著提高肿瘤细胞凋亡速率,并缩小肿瘤体积,推断BAG-1可能是结肠直肠癌治疗的基因靶标。Kilbas等[16]通过siRNA转染技术使BAG-1表达降低,可导致MCF-7乳腺癌细胞对由顺铂或紫杉醇诱导的细胞凋亡敏感性增强;BAG-1基因沉默后,化疗药物诱导MCF-7乳腺癌细胞凋亡增加,细胞增殖能力降低,推测针对BAG-1靶向治疗可能会提高化疗药物治疗乳腺癌的疗效。Liu等[17]研究发现,进展期头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)细胞显示出对顺铂的抵抗性,且伴有BAG-1蛋白表达增加。经siRNA干扰后,BAG-1表达水平降低可导致HNSCC对顺铂敏感性的显著改善,推断BAG-1表达增加与顺铂耐药和肿瘤侵袭相关,BAG-1过表达可能是原发性或复发性HNSCC患者顺铂耐药的生物标志物,靶向BAG-1治疗可能有助于改善顺铂耐药。此外,BAG-1在宫颈癌HEN-16-2/CDDP MDR细胞中也过表达,其过表达可通过降低MDR细胞中半胱氨酸天冬氨酸蛋白酶3(Caspase-3)活性而引起对细胞凋亡的抵抗性[18]。本研究结果显示,NACT有效组中BAG-1表达水平低于无效组,提示BAG-1低表达患者对以铂类为基础NACT更敏感,疗效更好,这与文献报道相一致,提示BAG-1可以作为预测宫颈癌NACT疗效的生物标志物。
MCM2属于MCM蛋白质家族,现已有10个家族成员被发现,家族成员高度同源且保守,是DNA复制的关键调控因子之一。真核生物中MCM通常由MCM2~MCM7蛋白形成一种异六聚体复合物[19],是细胞复制起始的关键复合物,在G1期主要以无活性双六聚体形式在复制起始点组装异六聚体复制解旋酶复合物,为细胞进入S期做准备。基因组结构改变导致细胞异常增殖是恶性肿瘤发生、发展过程中最主要的原因。研究发现,MCM家族中的MCM2在正常组织和静止期细胞几乎不表达,而在增殖、转化的恶性肿瘤中过表达,其表达水平和活性在保持基因组的稳定性中发挥着重要作用,MCM2异常表达与肿瘤发生密切相关[20]。左元元等[21]对宫颈液基细胞蜡块及活检组织研究发现,MCM2表达随宫颈上皮内病变严重程度的增加而升高,且与人乳头瘤病毒(HPV)感染密切相关,推荐MCM2用于宫颈癌前病变人群的分流管理。Zheng[22]的研究发现,在宫颈癌和癌前病变中,MCM2过表达并且与高危型HPV呈正相关,联合检测HPV及MCM2可以提高诊断的敏感度和特异度。Das等[23]运用聚合酶链反应(PCR)、免疫组化及蛋白质印迹等方法对宫颈癌细胞株及宫颈癌组织进行研究发现,MCM2在宫颈癌高表达,但其表达水平与宫颈癌临床病理分期无关。本研究中,MCM2在NACT前、后均呈高表达,且MCM2高表达率在化疗有效组和化疗无效组比较差异无统计学意义,说明MCM2与NACT疗效无关,并不能有效预测宫颈癌NACT疗效。关于MCM2表达与宫颈癌化疗疗效之间的关系,国外尚未有相关报道,国内仅有的几篇文献中,结果也不一致。因此,关于MCM2与宫颈癌NACT疗效之间的关系还有待于大样本研究证实。
综上所述,本研究结果提示宫颈癌NACT前、后BAG-1及MCM2蛋白表达均无明显变化,但NACT有效组BAG-1表达明显低于无效组,而MCM2在有效组和无效组均呈高表达。故在宫颈癌NACT前,检测BAG-1表达情况有望成为预测以铂类为基础的NACT疗效的参考指标,也可能为宫颈癌的治疗提供新的基因靶点,为宫颈癌新型抗肿瘤药物的研发提供实验依据和理论基础。
