MicroRNA-7-5p调控p53表达对非小细胞肺癌增殖及侵袭能力的影响
2019-11-22
(云南省第二人民医院 肿瘤科,云南 昆明 650021)
非小细胞肺癌(non-small cell lung cancer, NSCLC)在肺癌中的比例约为85%,并且67%肺癌患者年龄≥65岁[1-2]。人类抑癌基因p53的失活能够改变其对细胞生长、凋亡和DNA修复的调控作用,从而转变为癌基因并对肿瘤形成起重要作用[3-4]。在p53基因的调控作用中,microRNA-7-5p(miR-7-5p)能够对其起到正向作用[5]。本研究以人NSCLC细胞株NCI-H1975作为研究对象,深入剖析miR-7-5p对NCI-H1975增殖、侵袭能力的干扰。
1 材料与方法
1.1 试剂与细胞
肺癌细胞株NCI-H1975购自中国科学院细胞库,胎牛血清购自美国Gibco公司,链霉素、青霉素及胰蛋白酶购自美国HyClone公司,DMEM高糖培养基、细胞裂解液及MTS细胞增殖检测试剂盒购自南京凯基生物科技有限公司,Trizol试剂、PCR引物和脂质体Lipo fectamine™ 2000购自美国Invitrogen公司,实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)试剂盒购自日本TaKaRa公司,p53抗体购自美国Santa Cruz公司,双荧光素酶检测报告系统试剂盒购自北京普洛麦格生物技术有限公司。miR-7-5p等引物序列由上海吉玛公司合成。
1.2 细胞培养
NCI-H1975培养于含1%链霉素、青霉素和10%胎牛血清的高糖DMEM中,并置于5%二氧化碳CO2、37℃恒温环境中培养,待细胞生长至对数期,即融合度达80%左右时进行传代培养,若未达到传代密度,则每2天更换新鲜培养基。
1.3 荧光素酶活性检测
按1×106个/孔将NCI-H1975细胞铺板于6孔板中,培养24 h后均进行转染。转染中使用了2种萤火虫荧光素酶的质粒载体,分别是没有表达作用的pMIR-report-3'UTR非突变体和具有表达作用的pMIR-report-3'UTRm突变体,两者在实验中被分别设置到不同的共转染细胞作为对照。此外,质粒采用的是具有表达海肾荧光素酶的pRL-TK质粒。
NCI-H1975细胞转染48 h后,用细胞裂解液将细胞裂解,按照说明书提示,依次加入StopRlo和荧光素酶测试试剂Ⅱ,分别用于检测海肾荧光素酶活性和萤火虫荧光素酶活性,相对荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性×100%。
1.4 p53 mRNA及蛋白检测
按1×106个/孔将NCI-H1975细胞铺板于6孔板中,培养24 h。依据对照原则,将转染对象miR-7-5p与miR-NC分别作为miR-7-5p组和miR-NC组,未处理的细胞作为空白对照组。
qRT-PCR检测p53 mRNA。NCI-H1975细胞转染48 h后,用Trizol试剂裂解各组细胞,提取总mRNA,参照东洋纺(上海)生物科技有限公司的逆转录试剂盒的说明书进行操作,逆转录为cDNA后,进行qRTPCR扩增,反应条件为:95℃预变性3 min,95℃变性2 s,60℃延伸30 s,共40个循环。将单链的引物退火成双链Oligos序列,连接入经XhoⅠ和HpaⅠ限制性内切酶对表达载体进行双酶切得到线性化的RNA干扰载体。用2-ΔΔCt法将检测的Ct值结果进行处理,比较各组变化[5]。
Western blotting检测p53蛋白。第一步借助细胞裂解液提取转染后的NCI-H1975细胞总蛋白;第二步使用BCA法对获得的蛋白浓度进行测定;第三步通过10% SDS-PAGE对蛋白进行分离操作,样本标准是30μg/孔。PVDE转印蛋白,使用5%脱脂牛奶对其进行封闭操作。同时培育p53及相应的辣根过氧化物酶标记二抗,电化学发光免疫测定显影。
1.5 细胞增殖能力检测
将转染miR-7-5p或miR-NC 48 h后的NCIH1975细胞及未处理的NCI-H1975细胞用胰蛋白酶消化、重悬,在96孔板中按照1 000个/孔的细胞密度接种,并于铺板后的0、18、36、54和72 h观测细胞增殖情况,检测加入MTS试剂后上清液中450 nm波长处的光密度(optical density, OD)值。
1.6 细胞周期检测
对各组细胞进行胰蛋白酶消化与重悬后,用70%冰乙醇进行固定处理24 h。用碘化丙啶对细胞进行染色,流式细胞仪检测细胞周期情况,采用美国B&D公司的Version 3.4 CELL Quest软件对实验数据进行处理与分析。
1.7 细胞侵袭能力检测
对NCI-H1975细胞转染48 h后,用胰蛋白酶进行细胞消化。在DMEM中加入0.2%胎牛血清,借助盼蓝染色的方法检测死细胞,间接测算出细胞存活率,其存活率≥95%。最后检测细胞侵袭能力。依据Transwell小室法进行操作,在Transwell的上室接种各组细胞,均按照5×105个/孔的标准进行操作。与此同时,将DMEM注入到Transwell下室中,此时的DMEM中加入10%胎牛血清,在上、下室分别接种或注入材料后,进行24 h细胞常规培养。利用染色剂对已经发生侵袭并穿透基质胶的NCI-H1975细胞进行染色和脱色处理,测定560 nm波长处的OD值。
1.8 统计学方法
数据分析采用SPSS 19.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或单因素方差分析或重复测量设计的方差分析,进一步的两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组迁移细胞数及克隆形成数比较
miR-7-5p对荧光酶表达发挥的抑制作用,是通过将3'UTR作为靶向调控位点实现的。各组的迁移细胞数比较,经方差分析,差异有统计学意义(P<0.05),miR-7-5p组较miR-NC组低(P<0.05)。各组克隆形成数比较,经方差分析,差异有统计学意义(P<0.05),miR-7-5p组较miR-NC组低(P<0.05)。见表1。
表1 各组迁移细胞数、克隆形成数比较 (±s)

表1 各组迁移细胞数、克隆形成数比较 (±s)
空白对照组 198.000±2.231 83.000±3.211 miR-NC组 196.000±2.514 84.000±2.561 miR-7-5p 组 76.000±1.893 38.000±2.892 F值 201.142 267.232images/BZ_20_1281_423_2244_506.pngimages/BZ_20_1281_836_2244_919.png
2.2 miR-7-5p对p53的靶向作用
3'UTR位点因为受到miR-7-5p的靶向调控作用,抑制荧光素酶的翻译表达,而miR-NC组没有观察到这种现象。miR-7-5p组与miR-NC组3'UTR相对荧光素酶活性比较,经t检验,差异有统计学意义(P<0.05)。当3'UTR调节位点发生突变,miR-7-5p组与miR-NC组3'UTRm相对荧光素酶活性比较,经t检验,差异无统计学意义(P>0.05),3'UTRm中的荧光素酶活性与是否加入miR-7-5p无关。见表2和图1。
表2 两组相对荧光素酶活性比较 (%,±s)
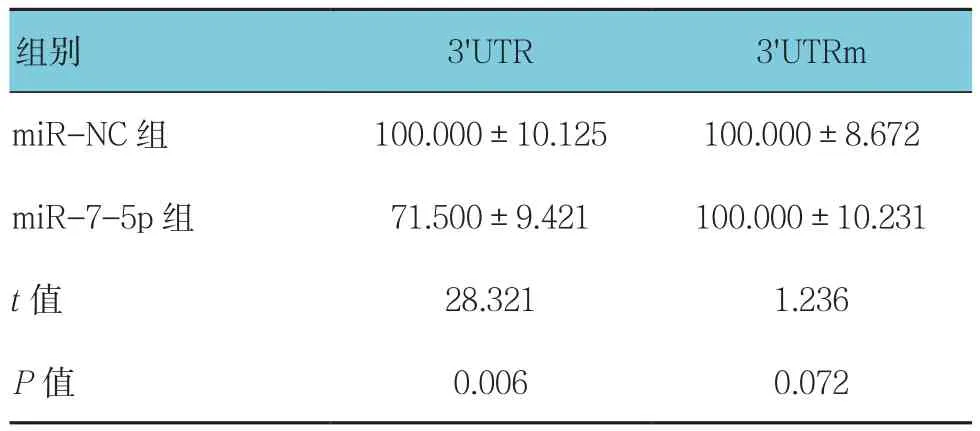
表2 两组相对荧光素酶活性比较 (%,±s)
miR-NC组 100.000±10.125 100.000±8.672 miR-7-5p 组 71.500±9.421 100.000±10.231 t值 28.321 1.236images/BZ_20_1281_1781_2244_1864.pngimages/BZ_20_1281_2112_2244_2195.png

图1 两组相对荧光素酶活性比较 (±s)
2.3 各组p53 mRNA和蛋白相对表达量比较
各组p53 mRNA相对表达量比较,经单因素方差分析,差异有统计学意义(P<0.05),进一步两两比较,miR-7-5p组较miR-NC组低(P<0.05)。各组p53蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05),miR-7-5p组较 miR-NC 组低(P<0.05)。见表3和图2、3。
表3 各组p53 mRNA和蛋白相对表达量比较 (±s)

表3 各组p53 mRNA和蛋白相对表达量比较 (±s)
空白对照组 0.981±0.013 1.000±0.021 miR-NC组 1.133±0.124 1.080±0.018 miR-7-5p 组 0.221±0.006 0.300±0.017 F值 15.852 14.961images/BZ_21_236_728_1199_811.pngimages/BZ_21_236_1141_1199_1224.png
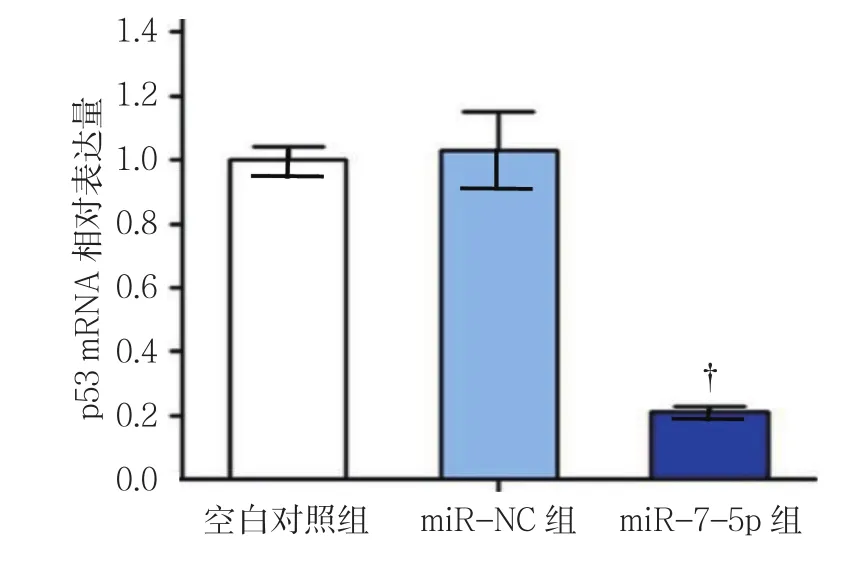
图2 各组NCI-H1975细胞中p53 mRNA相对表达量比较 (±s)
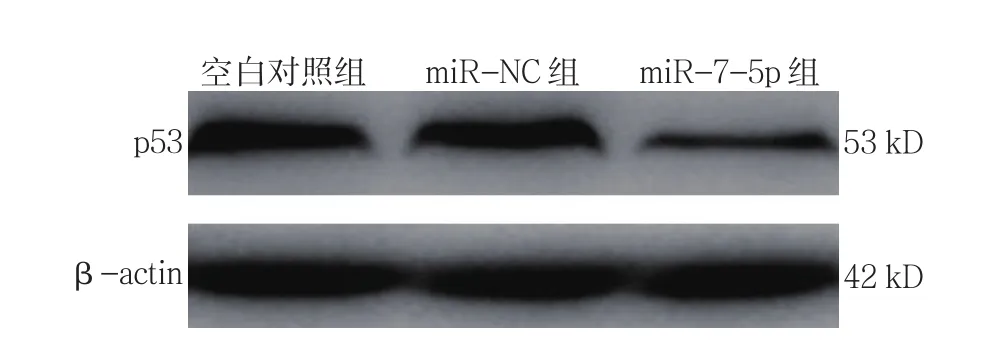
图3 各组NCI-H1975细胞中p53蛋白的表达 (±s)
2.4 miR-7-5p对NCI-H1975细胞的增殖作用
空白对照组、miR-NC组和miR-7-5p组培养0、18、36、54及72 h细胞OD值比较,采用重复测量设计的方差分析,结果如下:①不同时间点的细胞OD值比较,差异有统计学意义(F=18.571,P=0.001);②各组细胞OD值比较,差异有统计学意义(F=73.231,P=0.001);③各组OD值变化趋势比较,差异有统计学意义(F=23.752,P=0.001)。见表4。
2.5 各组NCI-H1975细胞周期比较
各组细胞周期的G0/G1期比例比较,经单因素方差分析,差异有统计学意义(P<0.05),进一步两两比较,miR-7-5p组高于空白对照组和miR-NC组(P<0.05)。各组G2/M期比例比较,差异有统计学意义(P<0.05),miR-7-5p 组低于 miR-NC 组(P<0.05)。各组S期比例比较,差异有统计学意义(P<0.05),miR-7-5p组低于空白对照组和miR-NC组(P<0.05)。见表5。
表4 各组不同时间点NCI-H1975细胞OD值比较 (±s)
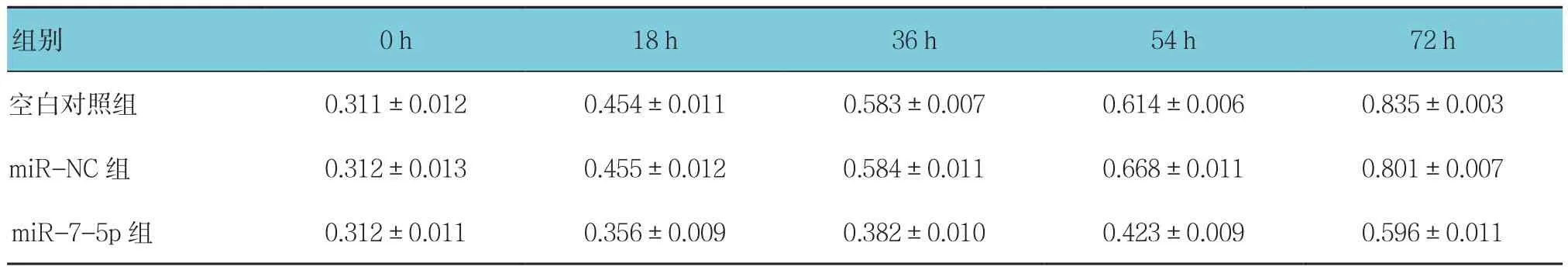
表4 各组不同时间点NCI-H1975细胞OD值比较 (±s)
组别 0 h 18 h 36 h 54 h 72 h空白对照组 0.311±0.012 0.454±0.011 0.583±0.007 0.614±0.006 0.835±0.003 miR-NC 组 0.312±0.013 0.455±0.012 0.584±0.011 0.668±0.011 0.801±0.007 miR-7-5p 组 0.312±0.011 0.356±0.009 0.382±0.010 0.423±0.009 0.596±0.011
表5 各组NCI-H1975细胞周期比较 (%,±s)
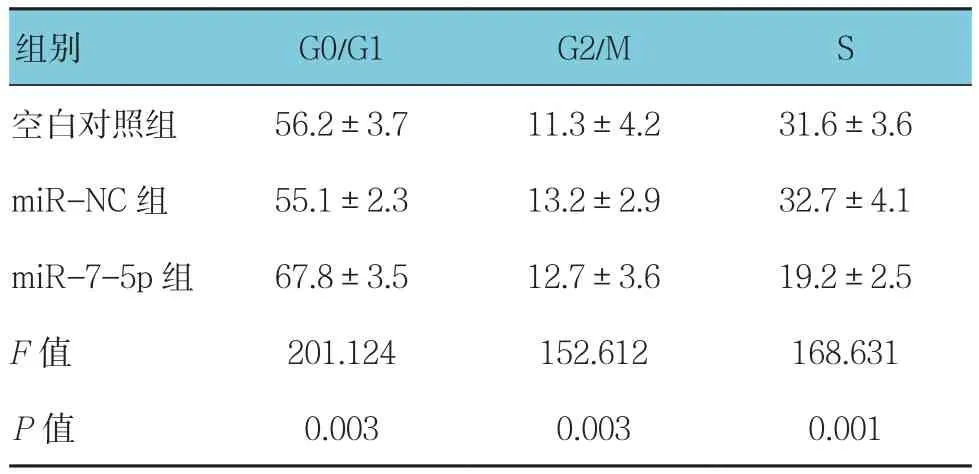
表5 各组NCI-H1975细胞周期比较 (%,±s)
组别 G0/G1 G2/M S空白对照组 56.2±3.7 11.3±4.2 31.6±3.6 miR-NC 组 55.1±2.3 13.2±2.9 32.7±4.1 miR-7-5p 组 67.8±3.5 12.7±3.6 19.2±2.5 F值 201.124 152.612 168.631 P值 0.003 0.003 0.001
2.6 各组NCI-H1975细胞的侵袭能力比较
空白对照组、miR-NC组和miR-7-5p组的侵袭细胞百分数分别为(99.312±12.452)%、(99.212±13.251)% 和(63.412±6.231)%, 经 方差分析,差异有统计学意义(F=16.327,P=0.002),miR-7-5p组低于空白对照组和miR-NC组(P<0.05);空白对照组与miR-NC组比较,差异无统计学意义(P>0.05)。见图4。
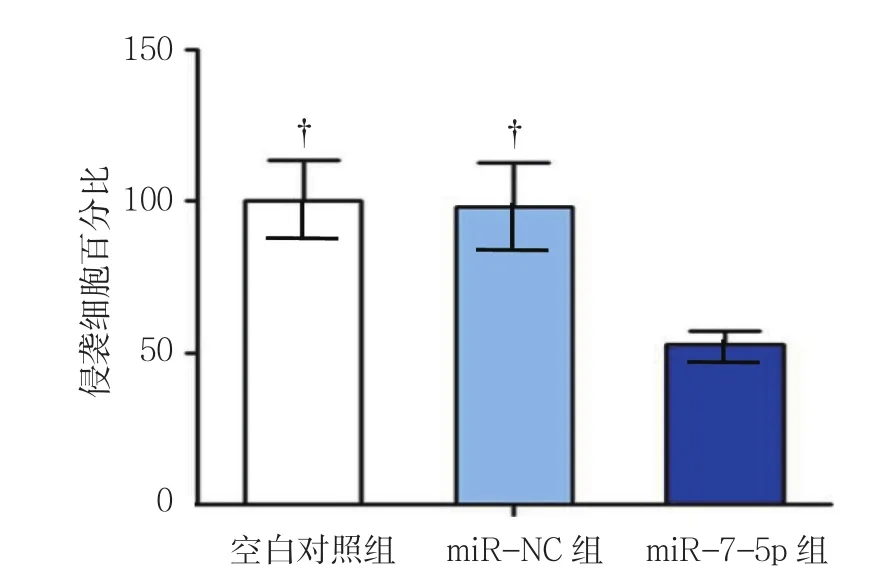
图4 各组NCI-H1975细胞的侵袭能力比较 (±s)
3 讨论
miRNA是一种内源性的小分子,仅仅只有21~24个核苷酸。其在功能上不具备编码功能,但是在细胞内的翻译阶段却可以通过靶向识别作用造成mRNA的沉默,甚至是降解。也就是miRNA可以在不完全碱基配对之后结合到mRNA的特异位点,造成翻译阶段被终止,降低功能蛋白的表达[6]。相关研究发现,miRNA的众多结合区域中,其3'UTR是miRNA最常见的结合位点区。miRNA对基因的调控作用相当普遍,在人体的众多基因当中,高达92%的基因受其调控[7]。
目前有关生物信息学的研究也指出,在表达p53的众多信使RNA碱基对当中,可能就潜藏着能与miR-7-5p相配对的靶向结合位点。另外,最近的科学研究也指明,在脑胶质细胞瘤与胃癌细胞的p53蛋白被翻译表达的过程中,miR-7-5p能够通过靶向作用对其进行调控[8-9],而这在本研究中得到了证实。首先,在实验当中,3'UTR位点在突变之前受到miR-7-5p的靶向作用,但是当发生突变后,这种调控效应就不再存在了;另外NCI-H1975的miR-7-5p组的mRNA和蛋白都比miR-NC组要高,这可能就是因为p53蛋白的表达翻译得到了miR-7-5p的正向调控。
在细胞增殖实验检测的结果当中,经转染的NCI-H1975细胞增殖能力表现出与miR-7-5p作用时间呈正相关,也就是说当作用时间延长,细胞增殖能力也会随之提高。结合细胞周期的检测结果,笔者发现转染miR-7-5p的NCI-H1975细胞,因为S期被缩短而拥有了更短的细胞周期,这可能就是miR-7-5p组具有更强细胞增殖能力的内因。另外,笔者在实验当中也发现,在miR-7-5p对p53起到正向调控的时候,细胞的增殖水平却表现出被削弱的现象。这可能是因为与增殖相关的蛋白在其表达过程中受到miR-7-5p的负面影响。有相关的体外实验研究结果显示,不管是胃癌细胞还是乳腺癌细胞都会因为p53的作用而被削弱了侵袭能力[10-11]。另外针对淋巴球性白血病的研究,也给出了相似的结果,当p53的表达受到miR-7-5p的靶向促进后,淋巴球性白血病的浸润能力降低[12]。这在本研究当中也得到了间接的证实,转染miR-7-5p的NCI-H1975细胞侵袭能力较miR-NC组弱。而恶性肿瘤的侵袭特征在其所有生物学特征中处于不容忽视的地位,患者往往因该侵袭过程导致病情恶化甚至是死亡[5]。所以这种能够对p53起到正向靶向调控的miR-7-5p可能成为新的治疗靶点。
综上所述,本文通过在人NSCLC细胞NCI-H1975中转染miR-7-5p发现,miR-7-5p通过靶向下调p53的表达,从而抑制NCI-H1975细胞的增殖和侵袭能力,再次证明miR-7-5p在肺癌中发挥作用,为miR-7-5p作为NSCLC的生物诊断标志物和新的治疗靶点提供更多的理论依据。
