碳青霉烯类耐药肺炎克雷伯菌药物敏感性及 blaKPC基因检出率
2017-06-05毕颖敏胡付品
毕颖敏, 沈 震, 董 栋, 吴 湜, 胡付品, 杨 帆
碳青霉烯类耐药肺炎克雷伯菌药物敏感性及 blaKPC基因检出率
毕颖敏, 沈 震, 董 栋, 吴 湜, 胡付品, 杨 帆
目的 了解复旦大学附属华山医院碳青霉烯类耐药肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae,CRKP)对常用抗菌药物的敏感性及 blaKPC基因的检出率。方法 收集 2014 年 1-12 月临床分离的 CRKP,微量肉汤稀释法测定 CRKP 对常用抗菌药物的敏感性 ;聚合酶链反应(PCR)扩增 blaKPC基因。结果 共收集 CRKP 205 株,主要分离自呼吸道标本(76.1%,156/205)和尿标本(18.5%,38/205)。药敏试验结果显示,CRKP 对大多数抗菌药物高度耐药,除对多黏菌素 E、替加环素、甲氧苄啶-磺胺甲唑和阿米卡星的耐药率分别为 1.5%、0.5%、51.0% 和 74.9% 外,对其他抗菌药物的耐药率在 85%~100% ;87.8%(180/205)菌株为 blaKPC基因阳性株。结论 CRKP 对多黏菌素和替加环素之外的多数临床常用抗菌药物呈高度耐药 ;产KPC 型碳青霉烯酶是CRKP 对碳青霉烯类耐药最主要的耐药机制。
碳青霉烯类耐药 ; 肺炎克雷伯菌 ; 敏感性 ; blaKPC基因
近年来肠杆菌科细菌尤其是肺炎克雷伯菌对碳青霉烯类的耐药率在全球迅速升高[1-4],给抗菌治疗带来严重挑战,其中碳青霉烯类耐药肺炎克雷伯 菌(carbapenem-resistant Klebsiella pneumoniae,CRKP) 更 被 美 国 CDC 列 为 紧 迫 的 威 胁(urgentthreat)(http ://www.cdc.gov/ drugresistance/threatreport-2013/)。产碳青霉烯酶是肠杆菌科细菌对碳青霉烯类药物耐药最主要的耐药机制, KPC 型碳青霉烯酶是我国临床分离肺炎克雷伯菌中最常见的碳青霉烯酶[5]。本文通过分析复旦大学附属华山医院 CRKP菌株对常用抗菌药物的敏感性及其blaKPC基因的检出率,为 CRKP 感染在现有条件下的治疗提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 收集2014年1-12月我院临床分离的碳青霉烯类耐药肺炎克雷伯菌(亚胺培南、美罗培南或厄他培南任一耐药者)。剔除同一患者同一部位分离的重复菌株。按常规方法进行菌种鉴定。药敏试验质控菌株为大肠埃希菌ATCC 25922。
1.1.2 仪器与试剂 抗菌药物标准品购自中国食品药品检定研究院。MH琼脂、MH肉汤、阳离子调节肉汤为英国OXOID公司产品;dNTPs(10 mmol/ L)、rTaq酶(5 U/μL)、10×Buffer、分子量Marker DL2000、10×Loading buffer购自TaKaRa 生物工程有限公司,基因扩增引物、琼脂糖购自上海生工生物工程技术有限公司。PCR扩增仪购自TaKaRa 生物工程有限公司,全自动凝胶成像分析系统购自美国Bio-Rad公司。
1.2 方法
1.2.1 药敏试验 采用微量稀释法进行药敏试验。多黏菌素E、替加环素药敏结果根据欧洲抗菌药物敏感性试验委员会(EUCAST)标准进行判读,其他抗菌药物药敏试验结果判断参照美国临床与实验室标准化协会(CLSI)2014 年标准执行。采用WHONET5.6 软件进行药敏数据分析处理。
1.2.2 blaKPC基因检测 煮沸法制备细菌 DNA 模板,PCR 法扩增 blaKPC基因。扩增 blaKPC基因通用引物序列为:KPC-F:5’-AGGACTTTGGCGGCTCCAT-3’,KPC-R :5’-TCCCTCGAGCGCGAGTCTA-3’;反应体系为:总体积 50 μL,上下游引物各 1 μL(10 μmol/ L),dNTPs(10 mmol/L)4 μL、10×Bufferr 为5 μL,rTaq 酶(5 U/μg)0.25 μL,高压灭菌 ddH2O 36.75 μL, 模 板 DNA 2 μL。 每 次 反 应 均 设 阴 性、阳性对照。PCR 扩增产物经 1% 琼脂糖凝胶电泳后使用全自动凝胶成像分析系统观察结果,阳性扩增产物进行DNA测序分析,根据所测序列与GenBank 中 BLAST 程序的序列进行比对(www. ncbi.nlm.nih.gov/blast/)以确定 blaKPC基因型。
2 结果
2.1 菌株分布
2014年 1-12 月共收集 205 株 CRKP 菌株。标本来源分别为呼吸道标本(76.1%,156/205)、尿 液(18.5%,38/205)、 脑 脊 液(2.0%,4/205)、伤口脓液和分泌物(2.0%,4/205)、血液(1.0%,2/205)、腹水(0.5%,1/205)。
科室分布分别为神经外科病区(49.8%,102/ 205)(其中创伤病区为 37.1%、其他病区为 12.2%)、老年病区(22.9%,47/205)、重症监护病区(ICU)(9.3%,19/205)、特需病房(6.3%,13/205)、永和分院(3.4%,7/205)、感染病区(3.4%,7/205)、神经内科(2.4%,5/205)、泌尿外科(1.0%,2/205)、急 诊 科(0.5%,1/205)、 肾 内 科(0.5%,1/205)、手 外 科(0.5%,1/205)。 在 分 离 出 CRKP 患 者 中,48.8%(100/205)系外院转入患者,其中神经外科病 区 有 60.8%(62/102)( 其 中 创 伤 病 区 有 63.2%,48/76 ;其他病区有 53.8%,14/26)由外院转入。
2.2 药敏试验结果
2.2.1 CRKP 菌株对抗菌药物的敏感性 CRKP 菌株对亚胺培南、美罗培南、厄他培南的耐药率分别为 97.6%、97.6%、98.5% ;对多黏菌素 E 和替加环素的耐药率分别为 1.5% 和 0.5%,MIC90均为1 mg/L ;对甲氧苄啶-磺胺甲唑、阿米卡星的耐药率分别为 51.0% 和 74.9%,对其他抗菌药物的耐药率在 85%~100%。见表1。
2.2.2 亚胺培南、美罗培南、多黏菌素和替加环素对CRKP的MIC的分布 205株CRKP对4种药物的MIC值分布见表2。CRKP对亚胺培南、美罗培南的MIC多处于较高值,亚胺培南MIC≤4 mg/ L的菌株仅2.9%(6/205),MIC≤16 mg/L的菌株亦仅24.9%(51/205);美罗培南MIC≤4 mg/ L的菌株仅2.0%(4/205),MIC≤16 mg/L的菌株仅有9.8%(20/205)。对多黏菌素E的MIC≤0.5 mg/L菌株占61.0%(125/205),对替加环素的MIC≤0.5 mg/L菌株占91.2%(187/205)。
2.3 blablaKPCKPC基因筛查
205 株 临 床 CRKP 菌株 通 过 PCR 扩 增, 有87.8%(180/205)检出 blaKPC基因。 blaKPC基因阳性株与阴性株对庆大霉素和头孢噻肟的耐药率均无差异,均为 100%,两者对其他常用抗菌药物相对比,耐药率均相近,见表3。
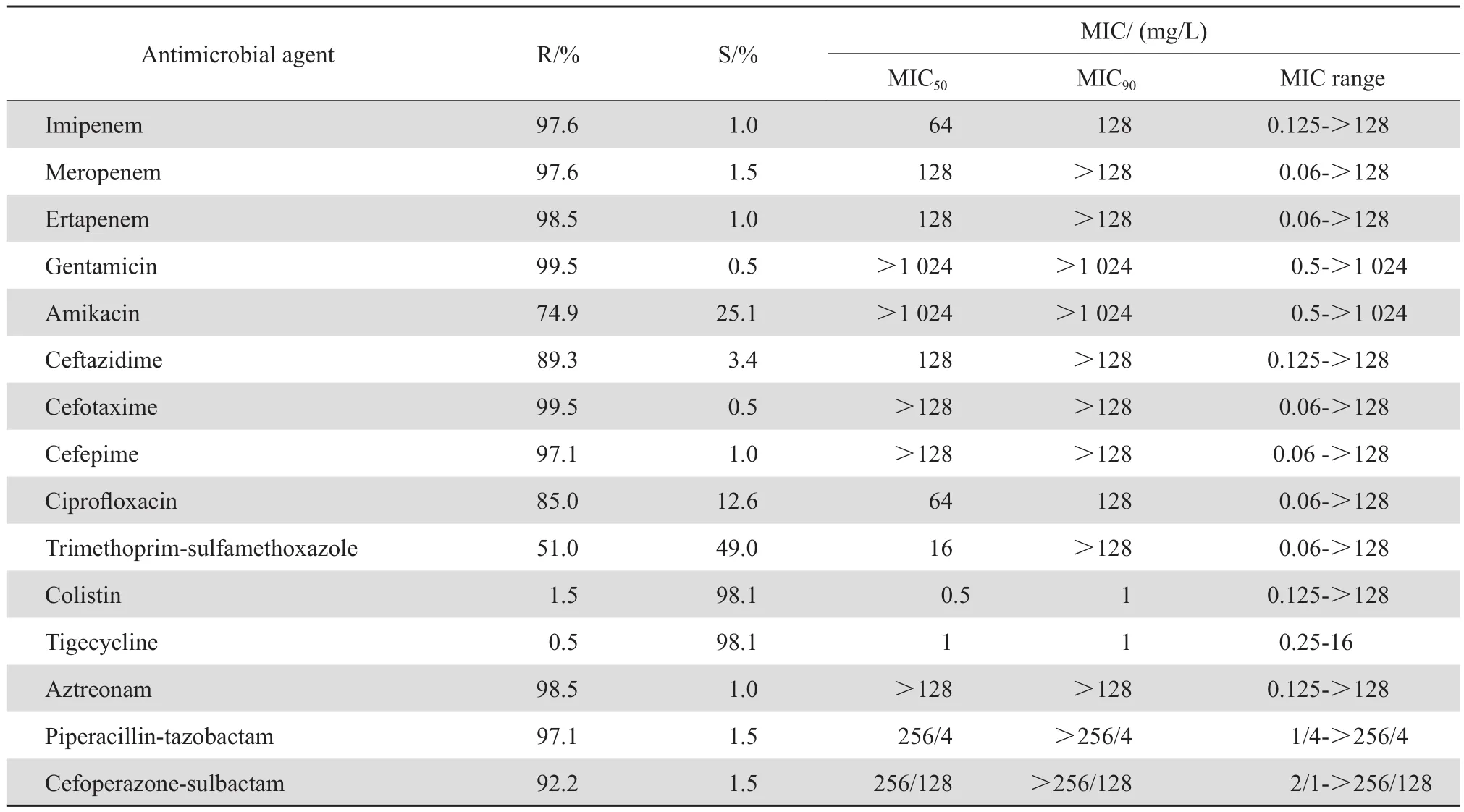
表1 CRKP 对临床常用抗菌药物的耐药率和敏感率Table 1 Susceptibility of carbapenem-resistant Klebsiella pneumoniae isolates to the commonly used antimicrobial agents
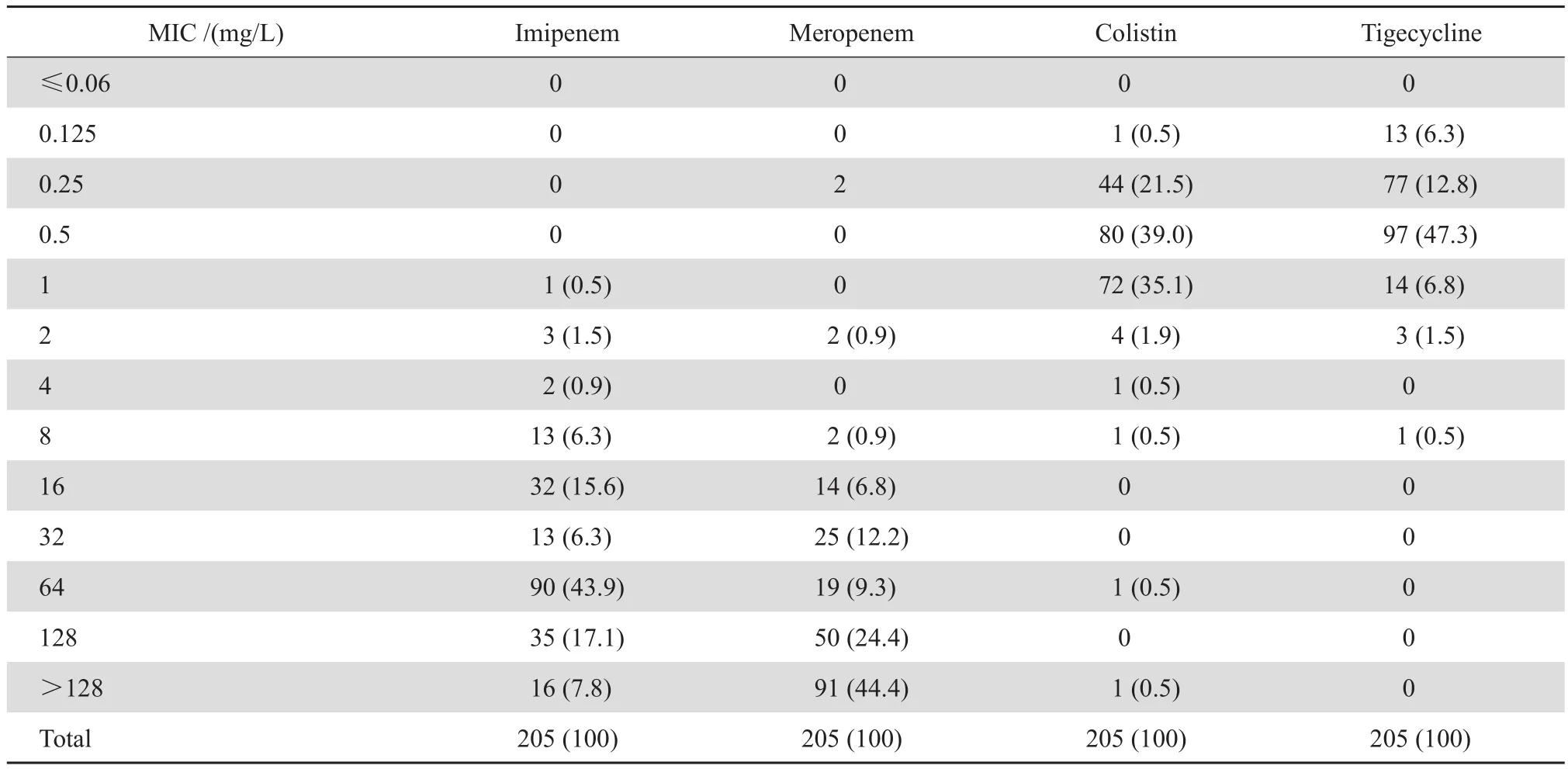
表2 亚胺培南、美罗培南、多黏菌素和替加环素对 CRKP 的 MIC 分布Table 2 Distribution of the MIC values of imipenem, meropenem, colistin and tigecycline against carbapenem-resistant Klebsiella pneumoniae [ n ( % ) ]
3 讨论
我院分离的 CRKP菌株主要来自神经外科、老年科、ICU 等科室。神经外科是我院的重点特色专科,知名度高,床位较多,有高比例的患者系由外院转入,神经外科创伤病区转入患者比例尤其高,且入院时常已有耐药菌感染。此外特需病区、永和分院(康复病区,收治较多神经外科创伤患者)、ICU 亦有相当比例外院转入神经外科患者。而老年科多为长期住院、反复使用抗菌药物患者。这提示我院CRKP防控应以神经外科及其关联病区、老年科为重点,除消毒、隔离等常规感控措施外,应着重于开展转院、转科患者耐药菌筛查以避免输入性耐药菌的传播,减少老年科患者的抗菌药物暴露。我院 CRKP多分离自痰等 呼 吸 道 标 本(76.1%) 和 尿 液(18.5%) 标 本,则提示CRKP感染主要见于呼吸道、尿路,呼吸机相关肺炎、导尿管相关尿路感染应为CRKP感染的预防重点[6]。
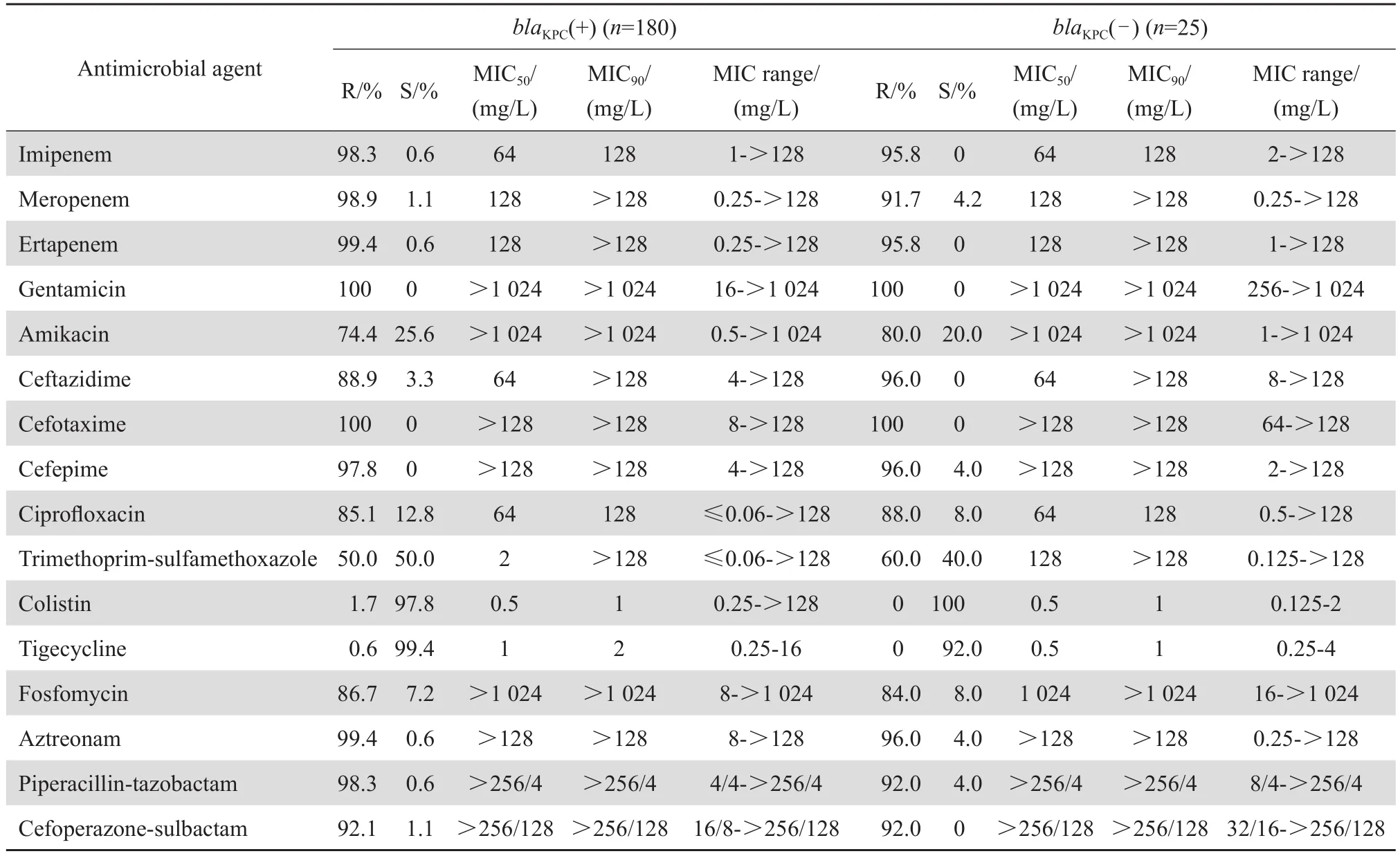
表3 blaKPC基因阳性与阴性 CRKP 菌株对临床常用抗菌药物的耐药率和敏感率Table 3 Susceptibility of carbapenem-resistant Klebsiella pneumoniae isolates to antimicrobial agents in terms of blaKPCgene status
碳青霉烯类药物这一肠杆菌科细菌感染的重要治疗药物出现耐药后,肠杆菌科细菌的治疗药物选择匮乏,在目前窘境下,基于体外药敏试验、少数病例报道和专家意见的推荐治疗策略主要为:①以多黏菌素、替加环素、碳青霉烯类等为核心药物的联合用药 ;②考虑药物组织浓度和 PK/PD特点,通过增加给药剂量、给药次数和延长滴注时间等给药方案优化,提高药效学达标概率;③雾化吸入、鞘内注射等局部用药提高感染部位组织的药物浓度[7-9]。
我院分离 CRKP菌株对多黏菌素 E 敏感率为 98.1%,表明多黏菌素是治疗 CRKP 感染的重要 选 择。 但 有 40.0% 菌 株 MIC 值>0.5 mg/L, 这些患者以多黏菌素单药治疗药效学达标概率低,兼以多黏菌素可能在治疗中发生诱导耐药,因此 宜 联 合 其 他 药 物[10]。 我 院 分 离 CRKP 菌 株 对替加环素敏感率亦高达 98.1%,且 91.2% 菌株的MIC≤0.5 mg/L, 提 示 多 数 菌 株 在 应 用 替 加 环 素50 mg,每天 2 次给药方案即可药效学达标,但亦有报道替加环素单药治疗碳青霉烯类耐药肠杆菌科细菌(CRE)感染病死率高于联合治疗,仍宜考虑联合其他药物[8]。
Monte Carlo 模拟显示在碳青霉烯类药物对肠杆 菌 科 细 菌 MIC≤4 mg/L 甚 至 更 高 至≤16 mg/ L,通 过 增 大 美 罗 培 南 剂 量 至 每 次 2 g、 每 8 小 时 1次,每次滴注时间延长至 3 h,其药效学达标概率仍可达 85% 以上。而临床病例报道荟萃分析显示MIC≤4 mg/L、8 mg/L 和>8 mg/L 时, 碳 青 霉 烯类单药治疗的疗效分别为 69%、60% 和 29%[10-11]。Daikos 等[11]因此认为,当碳青霉烯类对肠杆菌科细菌 MIC≤4 mg/L 时,碳青霉烯类单药治疗有效,但与其他种类抗生素(如氨基糖苷类、多黏菌素E、替加环素)联合应用可提高疗效;当碳青霉烯类耐药菌株的 MIC>4 mg/L 时,不能用碳青霉烯类单独治疗。Morrill等[12]则认为,碳青霉烯类MIC≤16 mg/L 时,可选择碳青霉烯类作为治疗药物之一 ;当碳青霉烯类 MIC>16 mg/L 时,应考虑用其他药物。本研究亚胺培南、美罗培南对CRKP菌 株 MIC 值≤16 mg/L 仅 分 别 占 24.9% 和 9.8%,≤4 mg/L 更 低 至 2.9% 和 2.0%, 表明 在 我 院 以 碳青霉烯类治疗CRKP感染的前景堪忧。
受 试 CRKP 对 阿 米 卡 星 的 敏 感 率 为 25.1%,且较我院 2005-2010 年分离 CRKP 敏感率(14.7%)有所上升[13];有报道阿米卡星单药治疗 CRE 所致尿路感染疗效佳,与其他药物联合治疗血流感染等可提高临床疗效和细菌清除率[12],因此在其药敏提示敏感时,亦可作为治疗药物之一,尤其是血液、尿路等氨基糖苷类药物浓度较高部位的感染。我院分离 CRKP 对甲氧苄啶-磺胺甲唑的敏感率为 49.0%,但鉴于该药为抑菌剂,目前仅有口服制剂供应,且缺乏治疗CRKP的循证医学证据,其治疗 CRKP感染的地位尚不明确。受试菌株对环丙沙星的敏感率为 12.6%,且环丙沙星在肺部等组织浓度亦较高,但鉴于环丙沙星治疗 CRE感染的临床经验缺乏,宜慎用环丙沙星等氟喹诺酮类治疗CRKP感染。
肠杆菌科细菌对碳青霉烯类抗生素耐药的主要机制是产碳青霉烯酶,其中以KPC 型碳青霉烯酶为主,且在全球广泛分布[14],少数菌株为产ESBL 和 /或 AmpC 酶合并外膜孔蛋白缺失等。本次实验 87.8%(180/205)菌株检出 blaKPC基因, 较我 院 2005-2010 年 CRKP 中 blaKPC基 因 检 出 率 70.6%(77/109) 进 一 步 升 高[13]。 一 项 对 国 内 13所医院分离的 95 株 CRKP 的研究结果显示[15],全部细菌均产生 KPC 型碳青霉烯酶。这些说明 KPC是碳青霉烯类耐药肠杆菌科细菌的主要耐药机制。提示头孢他啶-阿维巴坦等碳青霉烯酶抑制剂复方制剂有望在治疗CRKP感染中发挥重要作用,应尽快引进[16]。总之,在当前国内无多黏菌素、头孢他啶-阿维巴坦供应情况下,CRKP 的治疗选择有限、成本高且疗效不可靠,应着重防控其传播。
[1] 田磊,陈中举,孙自镛,等 . 2005—2014 年 CHINET 肠杆菌属细菌耐药性监测 [J]. 中国感染与化疗杂志,2016,16(3):275-283.
[2] 徐安,卓超,苏丹虹,等 . 2005—2014 年 CHINET 克雷伯菌属细菌耐药性监测 [J]. 中国感染与化疗杂志,2016,16(3):267-274.
[3] LEE C, LEE JH, PARK KS, et al. Global dissemination of carbapenemase-producing Klebsiella pneumoniae : epidemiology, genetic context, treatment options, and detection methods[J]. Front Microbiol,2016,7(895):12-41.
[4] VASOO S, BARRETO JN, TOSH PK. Emerging issues in gram-negative bacterial resistance[J]. Mayo Clin Procs,2015,90(3):395-403.
[5] 胡付品,朱德妹 . KPC 型碳青霉烯酶研究进展 [J]. 中国感染与化疗杂志,2011,11(1):76-80.
[6] TACCONELLI E, CATALDO MA, DANCER SJ, et al. ESCMID guidelines for the management of the infection control measures to reduce transmission of multidrug-resistant Gramnegative bacteria in hospitalized patients[J]. Clin Microbiol Infect,2014,20(Suppl 1):1-55.
[7] Chinese XDR Consensus Working Group. Laboratory diagnosis,clinical management and infection control of the infections caused by extensively drug-resistant Gram-negative bacilli: a Chinese consensus statement[J]. Clin Microbiol Infect,2016,22 (Suppl 1) 1 :s15-s25.
[8] ZAVASCKI AP, BULITTA JB, LANDERSDORFER CB. Combination therapy for carbapenem-resistant Gram-negative bacteria[J]. Expert Rev Anti Infect Ther,2013,11(12):1333-1353.
[9] GILBERT DN, CHANBERS HF, ELIOPOULOS GM, et al. The Sanford guide to antimicrobial therapy[M]. Antimicrobial Therapy Inc, 46th ed, Sperryville, 2016 :81.
[10] NATION RL, LI J, CARS O, et al. Framework for optimisation of the clinical use of colistin and polymyxin B : the prato polymyxin consensus[J]. Lancet Infect Dis,2015,15(2):225-234.
[11] DAIKOS GL, MARKOGIANNAKIS A. Carbapenemaseproducing Klebsiella pneumoniae : (when) might we still consider treating with carbapenems?[J]. Clin Microbiol Infect,2011,17(8):1135-1141.
[12] MORRILL HJ, POGUE JM, KAYE KS, et al. Treatment options for carbapenem-resistant Enterobacteriaceae infections[J]. Open Forum Infect Dise,2015,2(2):50-64.
[13] CHEN S, HU F, XU X, et al. High prevalence of KPC-2-type carbapenemase coupled with CTX-M-type extended-spectrum beta-lactamases in carbapenem-resistant Klebsiella pneumoniae in a teaching hospital in China[J]. Antimicrob Agents Chemother,2011,55(5):2493-2494.
[14] TZOUVELEKIS LS, MARKOGIANNAKIS A, PSICHOGIOU M, et al. Carbapenemases in Klebsiella pneumoniae and other Enterobacteriaceae : an evolving crisis of global dimensions[J]. Clin Microbiol Rev,2012,25(4):682-707.
[15] QI Y, WEI Z, JI S, et al. ST11, the dominant clone of KPC-producing Klebsiella pneumoniae in China[J]. J Antimicrob Chemother,2011,66(2):307-312.
[16] 杨帆,王明华 . 值得期待的新 β 内酰胺酶抑制剂阿维巴坦及其复合制剂 [J]. 第三军医大学学报,2013,35(3):2498-2501.
Susceptibility and prevalence of blaKPCgene in carbapenem-resistant Klebsiella pneumoniae
BI Yingmin, SHEN Zhen, DONG Dong, WU Shi, HU Fupin, YANG Fan.
(Institute of Antibiotics, Huashan Hospital, Fudan University, key Laboratory of Clinical Pharmacology of Antibiotics, Ministry of Health, Shanghai 200040, China)
Objective To examine the antimicrobial susceptibility and prevalence of blaKPCgene in carbapenem-resistant Klebsiella pneumoniae (CRKP) strains isolated in Huashan Hospital, Fudan University. Methods The CRKP strains isolated in Huashan Hospital from January to December of 2014 were included in this study. The MICs of antibiotics were determined using CLSI broth dilution method. The blaKPCgene was amplif i ed by polymerase chain reaction (PCR). Results A total of 205 CRKP strains were isolated, mainly from respiratory tract (76.1%, 156/205) and urine specimens (18.5%, 38/205). Antimicrobial susceptibility test indicated that CRKP isolates had higher resistance rates (85% - 100%) to the antimicrobial agents except colistin (1.5%), tigecycline (0.5%), trimethoprim-sulfamethoxazole (51.0%) and amikacin (74.9%). Most (87.8%, 180/205) of the CRKP strains were positive for blaKPCgene. Conclusions CRKP are mostly isolated from patients with lower respiratory tract infection and/or urinary tract infection in Huashan Hospital. The strains were highly resistant to the antibacterial agents tested except colistin and tigecycline. Production of KPC-type carbapenemase is the common mechanism of carbapenem resistance in these K. pneumoniae isolates.
carbapenem-resistant; Klebsiella pneumoniae; antimicrobial susceptibility; blaKPCgene
R378
:A
:1009-7708 ( 2017 ) 03-0298-05
10.16718/j.1009-7708.2017.03.014
2016-11-02
2016-11-21
复旦大学附属华山医院抗生素研究所,卫生部抗生素临床药理重点实验室,上海 200040。
毕颖敏(1989—),女,硕士研究生,主要从事细菌耐药性及耐药机制研究。
杨帆,E-mail:fanyang9@fudan.edu.cn。
