Duchenne型肌营养不良症中神经元型一氧化氮合酶和utrophin的表达水平
2016-11-10宋长栋刘恒方郭亚培吴世陶金东东
宋长栋, 刘恒方, 刘 方, 张 敏, 郭亚培, 吴世陶, 金东东
Duchenne型肌营养不良症中神经元型一氧化氮合酶和utrophin的表达水平
宋长栋1, 刘恒方1, 刘 方2, 张 敏1, 郭亚培1, 吴世陶1, 金东东1
目的 研究神经元型一氧化氮合酶(nNOS)和抗肌萎缩蛋白相关蛋白(utrophin) 在Duchenne型肌营养不良症(DMD)中的表达水平及与病情的关系,并探讨DMD中抗肌萎缩蛋白(dystrophin)、nNOS、utrophin 3者间的相关性。方法 收集DMD患者26例,并分为轻症组(19例)和重症组(7例),收集正常对照患者21例,利用免疫荧光方法检测nNOS和utrophin的表达并进行统计分析。结果 DMD患者中23例nNOS呈完全缺失、3例明显减少,22例DMD患者utrophin表达增多,4例患者utrophin阴性表达,正常对照中nNOS均为阳性、utrophin均为阴性,DMD患者nNOS表达减少而utrophin表达增多(Z=-6.557、-5.426,P<0.05)。轻症组与重症组比较nNOS、utrophin的表达水平均无统计学意义。相关分析DMD中utrophin与dystrophin的表达水平呈负相关(r=-0.419,P<0.05),而nNOS与utrophin、dystrophin均无相关性。结论 DMD患者中nNOS的表达减少、utrophin的表达增多,且两者可能参与DMD的病理过程。
Duchenne型肌营养不良症; 神经元型一氧化氮合酶; 抗肌萎缩蛋白相关蛋白
Duchenne型肌营养不良症(Duchenne muscular dystrophy,DMD)是假肥大型肌营养不良症的一种严重类型,因基因异常引起抗肌萎缩蛋白(dystrophin)表达缺失导致细胞膜结构的稳定性破坏而致病[1]。神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)在肌肉运动过程中产生一氧化氮(NO)扩张血管从而减少肌肉缺血,研究发现nNOS参与多种肌病的病理过程[2]。抗肌萎缩蛋白相关蛋白utrophin在正常肌细胞膜上仅在神经肌肉接头和肌肉肌腱接头处表达,utrophin在氨基酸序列上与dystrophin高度同源[3]。为进一步了解DMD的病理机制,我们利用免疫荧光方法检测DMD患者中nNOS和utrophin的表达,并探讨两种蛋白可能参与DMD的作用机制。
1 材料与方法
1.1 研究对象 DMD患者:收集从2013年1月~2015年5月来我院就诊并行肌肉活检的DMD患者26例,均为男性,并根据能否独立步行分为轻症组(19例)和重症组(7例),所有患者均经临床表现、血清肌酶、肌电图、肌肉病理及dystrophin免疫荧光诊断明确。 正常对照:选择排除神经肌肉病的急诊外伤患者8例和肌肉活检未见明显病理改变的患者13例。
研究符合人体试验的伦理学标准并获得郑州大学第五附属医院伦理委员会的批准,肌肉活检均获得患者和(或)家属的知情同意。
1.2 研究方法
1.2.1 冰冻切片制备及常规染色 活检肌肉为肱二头肌或股四头肌肌肉,新鲜肌肉标本用黄蓍树胶固定,迅速在经液氮预冷的异戊烷中冷冻,放入-80 ℃冰箱保存,肌肉标本在冰冻切片机上连续切片,厚度8 μm,常规做HE、改良Gomori、NADH、ATP酶染色和dystrophin的免疫荧光染色。
1.2.2 免疫荧光步骤 切片经4000 mg/L多聚甲醛固定20 min,PBS清洗后用体积分数为10%的山羊血清封闭30 min,一抗4 ℃孵育过夜,PBS清洗,二抗37 ℃避光孵育1 h,PBS清洗后用抗荧光猝灭剂封片,在荧光显微镜下观察。抗体来源:小鼠抗人dystrophin‐C单抗(1∶20,Novocastra),兔抗人nNOS多抗(1∶250,abcam),兔抗人utrophin多抗(1∶50,SANTA CRUZE),FITC标记山羊抗小鼠IgG(1∶200,SANTA CRUZE),FITC标记山羊抗兔IgG (1∶200,SANTA CRUZE)。
1.2.3 荧光强度分级 对于dystrophin和nNOS:+:正常阳性;±:轻度减少;-:明显减少;--:完全缺失。对于utrophin:-:正常阴性;±:轻度增加;+:中度增加;+ +:重度增加。每个患者肌肉标本选择3个非连续切片,每个切片随机选取5个视野分别进行强度分级,选择次数最多的分级作为该患者的荧光强度分级。

2 结 果
2.1 研究对象的一般资料 DMD患者的活检年龄为8.4±2.7岁,均表现为缓慢出现的行走不稳、蹲起费力和上下楼梯困难,均伴有腓肠肌假性肥大,检测血清CK值为7235.3±3941.2U/L,肌肉病理可见典型改变,dystrophin免疫荧光21例肌膜染色呈完全缺失、3例肌膜染色明显减少、2例染色轻度减少(见图1)。正常对照活检年龄8.0±3.2岁,临床表现为外伤性或缓慢出现的肌无力,均无腓肠肌假性肥大,血清CK值(105.1±99.0)U/L,肌肉病理和dystrophin免疫荧光染色正常(见图1)。
2.2 DMD患者和正常对照中nNOS和utrophin的表达水平 正常对照肌膜上nNOS染色均为阳性、utrophin均为阴性;DMD患者中nNOS染色:3例表达明显减少,23例完全缺失;utrophin染色:4例染色阴性,6例表达轻度增多,5例中度增多,11例表达重度增多(见图2)。与正常对照比较,DMD患者中nNOS表达减少、utrophin表达增多(Z=-6.557、-5.426,P<0.05)。
2.3 比较轻症组和重症组中nNOS和utrophin的表达水平 利用免疫荧光方法检测轻症组和重症组中nNOS、utrophin的表达水平(见表1),比较两组间nNOS和utrophin的表达水平,差异均无统计学意义(Z=-0.261、-0.770,P>0.05)。
2.4 DMD患者中dystrophin、nNOS和utrophin的相关性 DMD患者中nNOS、utrophin和dystrophin的表达水平均与活检年龄无关(P>0.05),utrophin与dystrophin的表达呈负相关(r=-0.419,P<0.05),nNOS与utrophin、dystrophin均无关,dystrophin缺失严重的患者utrophin表达明显增多,而nNOS变化不明显(见图3)。

A:DMD患者腓肠肌假性肥大;B:正常肌组织HE染色肌纤维大小均匀,呈网格状排列,核位于肌纤维的周边;C:DMD患者肌组织HE染色肌纤维大小不等、圆形化,大量变性和坏死;D:正常肌膜dystrophin染色呈均匀一致的环状条带;E:DMD患者肌膜dystrophin染色无着色。比例尺=50 μm
图1 DMD患者的临床表现、肌肉病理和dystrophin免疫荧光染色

A:正常肌膜nNOS染色呈强度均匀一致的环状荧光条带;B:正常肌膜utrophin染色条带完全缺失;C:DMD患者肌膜nNOS染色完全缺失;D:DMD患者utrophin染色呈强度均匀一致的环状荧光条带。比例尺=50μm
图2 正常对照和DMD患者中nNOS和utrophin免疫荧光染色

A:病例1 dystrophin完全缺失;B:病例1 utrophin表达重度增多;C:病例1 nNOS表达阴性;D:病例2 dystrophin部分表达;E:病例2 utrophin表达轻度增多;F:病例2 nNOS表达阴性。比例尺=50μm
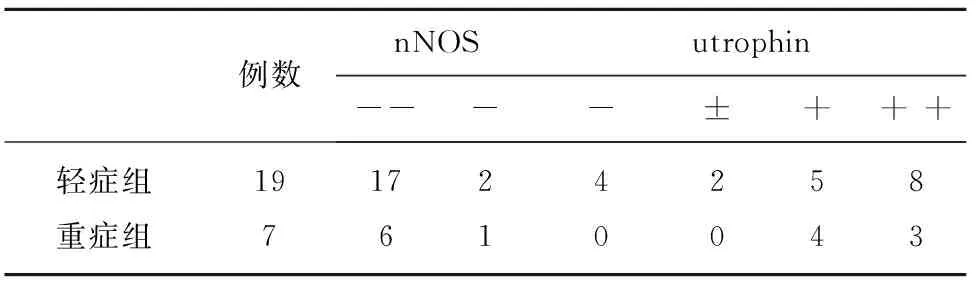
图3 DMD患者中dystrophin、nNOS和utrophin的相关性
对于nNOS:+正常阳性;±轻度减少;-明显减少;- -完全缺失。对于utrophin:-正常阴性;±轻度增加;+中度增加;+ +重度增加
3 讨 论
Duchenne型肌营养不良症是一种常见的遗传性肌病,致病基因位于Xp21,免疫荧光和基因检测发现dystrophin蛋白表达水平和基因结构异常有助于DMD的诊断[4]。nNOS通过dystrophin固定在肌膜上,nNOS的表达减少易产生运动不耐受现象[5,6]。Utrophin在结构上与dystrophin具有80%以上的同源性,再生肌细胞中utrophin大量表达并起到维持细胞膜稳定性的作用,且再生肌细胞成熟过程中两者表达呈现互补性[7]。基于nNOS、utrophin与dystrophin的密切关系,推测DMD中dystrophin的缺失可能会引起nNOS和utrophin的继发性改变,且这种改变可能参与DMD的病理过程。
该研究发现,DMD患者中nNOS不同程度的表达减少,绝大部分为完全缺失,少数为部分性缺失,22例DMD患者在起病初期伴有明显运动不耐受,说明DMD患者中nNOS缺乏时因NO减少而出现缺血性不耐疲劳症状。Dystrophin通过R16/17结构将nNOS固定到细胞膜上,假肥大型肌营养不良症中dystrophin缺失从而引起肌膜上nNOS表达减少,但本次研究并未发现胞浆内nNOS着色,与Lai等[8]认为DMD患者中nNOS由肌膜向胞浆内转移,胞浆内nNOS表达增多结论不一致。5例dystrophin部分表达的DMD患者中仅1例nNOS少量表达,其余4例均未表达,且相关分析dystrophin与nNOS无明显相关性,一方面可能因为部分表达的dystrophin蛋白R16/17结构异常不能固定nNOS,另一方面与nNOS在细胞膜上的表达同样受其他肌膜蛋白结构的影响有关,如DMD患者中肌细胞膜上肌聚糖蛋白等膜蛋白表达减少,而肌聚糖蛋白缺乏可以引起nNOS的表达减少[9]。
研究表明DMD患者肌纤维膜上utrophin表达增多,但仍有部分患者utrophin表达阴性,dystrophin完全缺失的患者中utrophin多为阳性表达而dystrophin部分缺失的患者中多无表达,utrophin与dystrophin的表达水平呈互补性。在mdx鼠(DMD鼠模型)的成熟肌细胞膜上utrophin表达上调,且上调的utrophin可以促进其他膜蛋白复合物的表达增多,并可以预防肌细胞坏死、减轻肌无力[10],说明utrophin的表达增加可能具有一定的代偿作用,utrophin可能参与DMD的病理过程。
研究结果显示DMD患者中utrophin表达明显增多而nNOS多无表达,utrophin的表达上调并未引起nNOS的表达增多,utrophin和dystrophin虽然结构高度同源,但utrophin仍不能完全替代dystrophin的功能,在动物实验中通过转基因即使增加鼠中utrophin的表达水平,而nNOS的表达水平也未见明显增多[11],说明utrophin可能不能固定nNOS,并且dystrophin和utrophin的区别主要在于棒状区,R16/17存在于棒状区[12]。因此,DMD患者中utrophin的代偿作用仍具有一定的局限性。
DMD患者中nNOS和utrophin的表达水平与病情严重程度无关,与Kleopa等[13]发现utrophin的表达水平与患者病情进展到不能行走时的年龄呈正相关结论不一致,目前关于DMD患者中nNOS、utrophin表达水平与病情严重程度的关系结论尚不一致,因遗传因素、治疗情况等都可能影响病情严重程度,且各种研究评价病情严重程度的指标不同导致结论可能不同,因此尚需进一步研究。
综上所述,该研究发现DMD患者中nNOS表达减少及utrophin表达增多,为进一步研究nNOS、utrophin参与DMD的可能机制,以及两种蛋白有望作为疾病的治疗靶点提供临床依据;但由于客观条件、研究水平有限,该研究中存在许多不足,研究的标本量较少,关于nNOS和utrophin之间的相互关系需要我们进一步深入研究。
[1]Abbs S,Tuffery-Giraud S,Bakker E,et al. Best practice guidelines on molecular diagnostics in Duchenne/Becker muscular dystrophies[J]. Neuromuscul Disord,2010,20(6):422-427.
[2]Lai Y,Thomas GD,Yue Y,et al. Dystrophins carrying spectrin-like repeats 16 and 17 anchor nNOS to the sarcolemma and enhance exercise performance in a mouse model of muscular dystrophy[J]. The Journal of Clinical Investigation,2009,119(3):624-635.
[3]Guiraud S,Chen H,Burns DT,et al. Advances in genetic therapeutic strategies for Duchenne muscular dystrophy[J]. Experimental Physiology,2015,10(12):1458-1467.
[4]张 宁,尹小玲,肖 波. Duchenne型进行性肌营养不良30例临床与病理分析[J]. 中风与神经疾病杂志,2011,28(2):145-147.
[5]Nieto CI,Cabildo MP,Cornago MP,et al. Fluorination Effects on nNOS Inhibitory Activity of Pyrazoles Related to Curcumin[J]. Molecules,2015,20(9):15643-15665.
[6]Lomonosova YN,Shenkman BS,Kalamkarov GR,et al. L-arginine Supplementation Protects Exercise Performance and Structureal Integity of Muscle Fibers after a Single Bout of Eccentric Exercise in Rats[J]. The Public Library of Science One,2014,9(4):e94448.
[7]Muthu M,Richardson KA,Sutherland-Smith AJ,et al. The crystal structures of dystrophin and utrophin spectrin repeats:implications for domain boundaries[J]. Public Library of Science One,2010,7(7):e40066.
[8]Lai Y,Zhao J,Yue Y,et al. Alpha2 and alpha3 helices of dystrophin R16 and R17 frame a microdomain in the alphal helix of sytrophin R17 for neuronal NOS binding[J]. Proceedings of the National Academy of Sciences of the United States of American,2013,110(2):525-530.
[9]Fanin M,Tasca E,Nascimbeni AC,et al. Sarcolemmal Neuronal Nitric Oxide Synthase Defect in Limb-Girdle Muscular Dystrophy[J]. Journal of Neuropathology & Experimental Neurology,2009,68(4):383-390.
[10]Bandi S,Singh SM,Mallela KMG. Inter-domain linker determines primarily the structural stability of dystrophin and utrophin tandem calponin-homology domains rather than their actin-binding affinity[J]. Biochemistry,2015,54:(35):5480.
[11]Li D,Bareja A,Judge L,et al. Sarcolemmal nNOS anchoring reveals a qualitative difference between dystrophin and utrophin[J]. Journal of Cell Science,2010,123(12):2008-2013.
[12]Belanto JJ,Mader TL,Eckhoff MD,et al. Microtubule binding distinguishes dystrophin from utrophin[J]. Proceedings of the National Academy of Sciences of the United States of American,2014,111(15):5723-5728.
[13]Kleopa KA,Drousiotou A,Mavrikiou E,et al. Naturally occurring utrophin correlates with disease severity in Duchenne muscular dystrophy[J]. Human Molecular Genetics,2006,15:1623-1628.
Expression levels of neuronal nitric oxide synthase and utrophin in patients with duchenne muscular dystrophy
SONGChangdong,LIUHengfang,LIUFang,etal.
(DepartmentofNeurology,TheFifthAffiliatedHospitalofZhengzhouUniversity,Zhengzhou,450052,China)
Objective To study the expression levels of neuronal nitric oxide synthase (nNOS) and dystrophin related protein (utrophin) in Duchenne muscular dystrophy (DMD) and their relationship with the disease,furthermore to analyze the correlation among dystrophin,nNOS and utrophin in DMD. Methods 26 cases of DMD being divided into mild group (19 cases) and severe group (7 cases) and 21 cases of control patients were collected and detected the expression levels of nNOS and utrophin by immunofluorescence. Results In DMD patients,the expression of nNOS was absent in 23 cases and reduced in 3 cases,and the expression of utrophin was increased in 22 cases and negative in 4 cases. While nNOS was positive and utrophin was negative in all cases of the control patients. The expression of nNOS was decreased and utrophin was increased in DMD patients (Z=-6.577,-5.426,P<0.05). Moreover,no statistically significant difference were found in the expression of utrophin or nNOS between the mild group and severe group. In DMD patients the expression of dystrophin was negatively correlated with utrophin (r=-0.419,P<0.05),while nNOS was not correlated with dystrophin or utrophin. Conclusion The expression level of nNOS was decreased in DMD patients,and the expression level of utrophin was increased,and the two proteins may be involved in the pathological process of DMD.
Duchenne muscular dystrophy; Neuronal nitric oxide synthase; Utrophin
1003-2754(2016)01-0018-04
2015-11-20;
2015-12-22
河南省医学科技攻关计划项目(2011020066);河南省科技攻关项目(132102310092)
(1.郑州大学第五附属医院神经内科,河南 郑州 450052;2.郑州大学第五附属医院护理部,河南 郑州 450052 )
刘恒方,E-mail:liuhf1965@163.com
R746.2
A
