粪肠球菌产伏尔加霉素E5的生物学特性研究
2013-08-14张永红李焕荣阮文科鲍宇晖崔德凤
张永红,李焕荣,阮文科,鲍宇晖,陆 彦,崔德凤,2*
(1.北京农学院动物科学技术学院,北京102206;2.兽医学(中医药)北京市重点实验室,北京102206)
很多微生物能够产生各种具有抗菌活性的物质。在这些抗菌物质组成中包括由乳酸菌产生的一类物质,称之为细菌素(bacteriocins)。细菌素是某些细菌在代谢过程中由核糖体合成机制产生的具有抑菌活性的多肽、蛋白质或蛋白质复合物,细菌素分泌到细胞外发挥抑菌或杀菌作用,具有天然、高效、无残留等优点。产生细菌素的细菌来自复杂的细菌群落,如胃肠道菌群、口腔黏膜、生殖道黏膜或者其他的上皮细胞表面,提示细菌素产生菌具有细菌生态系统群体动力学的调节作用。细菌素具有生物活性蛋白和杀菌作用,这一特性激发了人们从革兰阳性和革兰阴性细菌中筛选、分离、纯化和应用细菌素的兴趣[1],尤其是从益生性乳酸菌中寻找细菌素产生菌,因为它们大多数属于食品级的微生物,广泛应用于食品工业并且细菌素又赋予了作为食品保藏的应用前景。随着研究的深入,细菌素正在作为抗菌剂在医学中应用,预防某些传染病的发生、发展[2]。
产生细菌素的乳酸菌包括乳酸杆菌属、双岐杆菌属、粪肠球菌、屎肠球菌、乳酸乳球菌、乳酸片球菌、嗜热链球菌和芽胞乳杆菌属等。产生细菌素是肠球菌的一个重要生物学特性。多种肠球菌可以产生细菌素,粪肠球菌和屎肠球菌为主要的细菌素产生者,肠球菌产生的细菌素称之为伏尔加霉素(enterocin),具有多样性特征,在一些菌株已检测到enterocin A[3]、enterocin B[4]、enterocin P[5]及enterocin SE-K4[6]等,此类细菌素属于小分子量、热稳定型Ⅱa类细菌素,已成为目前细菌素研究的热点,这些细菌素产生菌大多来源于香肠、奶制品、橄榄等食物源肠球菌。du Toit M等[7]从实验用迷你猪粪便中分离到产细菌素肠球菌,屎肠球菌产生的细菌素特性与enterocin A相近,抑菌谱较窄,仅能抑制同属肠球菌、李斯特菌、梭状芽胞杆菌和丙酸菌属细菌,对革兰阴性细菌无抑菌活性。
随着抗生素耐药性问题的日益严重,研究和开发新型抗菌药物已迫在眉睫,细菌素在治疗细菌性疾病方面显示出巨大的潜力。如用乳酸菌的细菌素防治由幽门螺杆菌引起的胃溃疡[8],革兰阳性菌引起的牛乳腺炎[9]及细菌素对雏鸡感染鸡白痢的保护作用[10]。因此,筛选和鉴定pH活性范围广,耐热性强,抑菌谱广的细菌素尤为重要。本研究从北京健康黑猪胃肠道分离到具有抑菌活性的益生性粪肠球菌,对其所产细菌素enterocin E5进行pH活性范围、耐热性、对各种水解酶的敏感性以及畜禽常见病原菌抑菌活性的测定,为enterocin的进一步应用研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 粪肠球菌E5由微生物实验室分离筛选,27株指示菌,包括6株大肠埃希菌,1株鸡白痢沙门菌,4株鸡伤寒沙门菌,1株肠炎沙门菌,1株肺炎克雷伯杆菌,1株变形杆菌,2株多杀性巴氏杆菌,1株单核细胞增生李斯特菌,1株马腺疫链球菌,2株链球菌,2株金黄色葡萄球菌,2株炭疽芽胞杆菌,1株蜡样芽胞杆菌,1株屎肠球菌和1株粪肠球菌,均由兽医微生物实验室保存。
1.1.2 培养基 PYG培养基,MRS培养基,LB培养基,脑心浸液培养基,营养肉汤培养基略。
1.2 方法
1.2.1 细菌复壮 将在-20℃保存的肠球菌和指示菌分别接种在适宜培养基上,37℃培养24h,连传2代并接种斜面培养基4℃保存备用。
1.2.2 肠球菌上清液制备 取培养18h的肠球菌培养液接种于MRS液体培养基中,37℃培养24h,10 000r/min离心30min,取上清液备用。
1.2.3 pH对肠球菌细菌素的影响 肠球菌上清液分别用3mol/L的NaOH溶液或盐酸溶液调pH至pH 2至pH 12于37℃水浴2h后,再调回对照pH 6.5,检测抑菌活性。测定肠球菌上清液在不同pH条件下抑菌活性的变化,以上清液原液为对照。
1.2.4 蛋白酶对肠球菌细菌素的影响 评价肠球菌细菌素对各种蛋白酶的敏感性,取制备好的2mL肠球菌上清液,分别加入蛋白酶K、胰蛋白酶、胃蛋白酶、淀粉酶和脂肪酶终浓度分别为0.1、15g/L,于37℃水浴中温育2h后,65℃加热30min使残余酶失活,加样100μL/孔,加到已分别涂布3株指示菌的平板,37℃,24h培养后测定其抑菌圈直径,以未加蛋白酶的肠球菌上清液为对照,检测抑菌活性的变化。
1.2.5 耐热性试验 取制备好的肠球菌上清液进行以下热处理:121℃压、100℃ 、80℃和60℃水浴分别作用10min、20min,取100μL/孔,加到已分别涂布3株指示菌的平板,37℃,培养24h后测定肠球菌上清液抑菌活性,以未处理上清液作为对照,检测抑菌活性的变化。
1.2.6 抑菌谱的测定 为了检测肠球菌细菌素enterocin E5对畜禽病原菌的抑菌活性,采用以下指示菌做抑菌试验,包括动物源重要病原菌革兰阴性埃希菌属、沙门菌属、克雷伯菌属菌、变形杆菌属、多杀性巴氏杆菌,革兰阳性的金黄色葡萄球菌、链球菌,革兰阳性芽胞杆菌包括炭疽芽胞杆菌和蜡样芽胞杆菌,革兰阳性无芽胞杆菌如单核细胞增生李斯特菌,以及肠球菌属内的益生菌如B1屎肠球菌和B2粪肠球菌。
抑菌试验验采用琼脂扩散法,在涂布指示菌的PYG平板上,用打孔器在平板上打孔,孔径6mm、孔距2cm~3cm,用酒精灯加热封底,中央孔内,加入粪肠球菌E5上清液100μL,另设生理盐水对照孔,每株指示菌3个重复,待细菌上清液4℃冰箱静止扩散完后,倒置37℃培养24h,测定其抑菌圈直径。
2 结果
2.1 肠球菌细菌素对酸碱的耐受性
enterocin E5去细胞上清液对酸碱处理的耐受性如图1所示。enterocin E5经3mol/L的盐酸处理后对指示菌抑菌活性降低不显著,经3mol/L的NaOH处理后仍保留有较高活性。在pH 2~12处理后,对大肠埃希菌F41均有抑菌活性。在pH2和3时enterocin E5保持较高的抑菌活性;当pH4~6时显示出最强的抑菌活性;pH从中性7上升到碱性12时,抑菌活性逐渐减低,但pH为12时细菌上清液仍保留部分活性,这些说明enterocin E5对酸碱是比较稳定的,具有很宽泛的pH耐受范围。
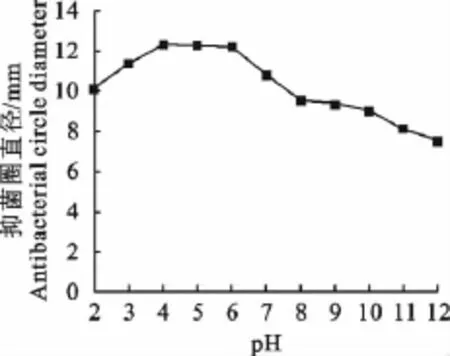
图1 enterocin E5对pH的耐受性Fig.1 pH tolerance of enterocin E5
2.2 肠球菌细菌素对蛋白酶的敏感性
由表1可见,经5种水解酶以不同浓度处理后,淀粉酶、脂肪酶对抑菌活性没有影响,蛋白酶组随着酶浓度的升高,enterocin E5对K88,F41和金黄色葡萄球菌的抑菌效果均有不同程度的减弱,尤其酶浓度达到5g/L时,对3株指示菌抑菌活性的减弱作用极显著(P<0.01),说明肠球菌产生的抑菌物质对蛋白酶敏感。
2.3 肠球菌细菌素对热的耐受性
由表2可以看出,enterocin E5对热具有一定的耐受性,60、80、100、121℃、处理10min和20min与对照组比较,对3株指示菌的抑菌活性几乎没有影响,仅121℃、处理20min组,抑菌活性略有下降,表明enterocin E5对热具有一定的抵抗力,属于耐热型细菌素。
2.4 肠球菌细菌素enterocin E5抑菌谱
肠球菌细菌素enterocin E5显示了广谱的抗菌活性,对23株指示菌具有抑制作用(包括21株动物源病原微生物和2株益生菌)。能够广泛抑制肠杆菌科的革兰阴性病原菌,对7株猪源肠毒素型大肠埃希菌和1株鸡源致病性大肠埃希菌抑制作用最强,抑菌圈直径达到16mm~18.5mm,对鸡白痢沙门菌、鸡伤寒沙门菌、变形杆菌和肺炎克雷伯也有较强的抑制作用,特别对产生广谱抗药性的鸡伤寒沙门菌LY1、鸡伤寒沙门菌LY2和肠炎沙门菌C4分离株具有明显的抑菌活性;能够抑制多杀性巴氏杆菌(分离自病死猪和鸡);抑制革兰阳性金黄色葡萄球菌、马腺疫链球菌、猪链球菌XY,对2株炭疽芽胞杆菌弱毒株和蜡样芽胞杆菌产生显著的抑菌活性;能够抑制同属的屎肠球菌、粪肠球菌;仅对4株菌没有抑制作用(单核细胞增生李斯特菌、金黄色葡萄球菌ND、链球菌ND和鸡伤寒沙门菌LY3)(表3)。
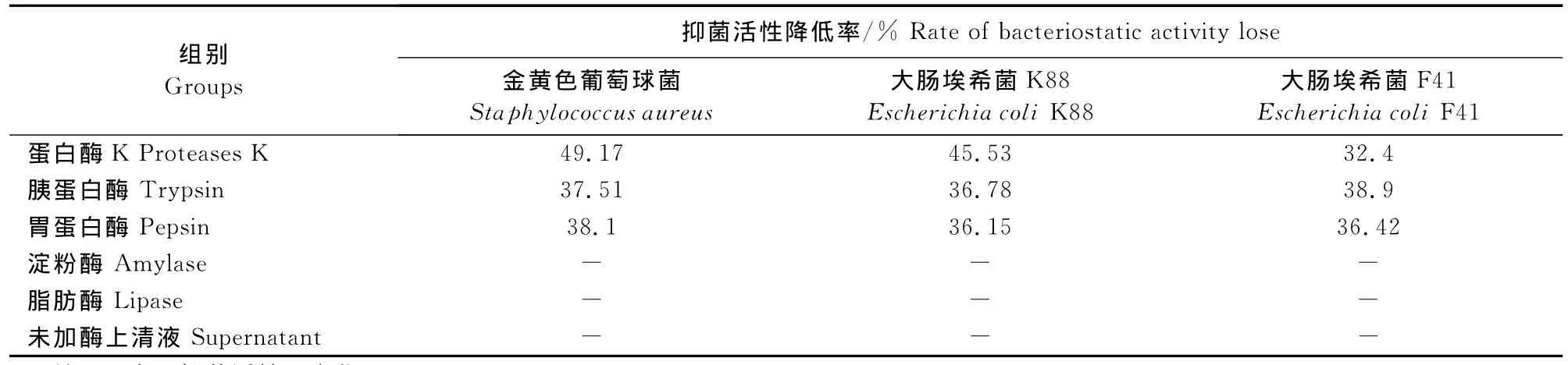
表1 Enterocin E5对酶的敏感性Table 1 Sensitivity of enterocin E5to enzymes

表2 Enterocin E5对热的稳定性Table 2 Heat stability of enterocin E5

表3 Enterocin E5对27株指示菌的抑菌作用Table 3 Inhibitory results of enterocin E5on 27indicator strains

续表3
3 讨论
根据细菌素的化学结构和作用方式通常分为4类:第1类硫醚抗生素(lantibiotics),分子质量小(2 ku~5ku),尼生素(Nisin)属于此类。第2类细菌素是小分子热稳定肽(small heat-stable peptide,SH SP),对热不敏感,分子质量3ku~6ku,又分为4个亚型,其中Ⅱa亚型细菌素是2类中研究最深入的,也是最大的一群。片球菌素(pediocin)属于此群。第3类是大分子热不稳定肽(large heat-labile protein,LHLP),分子质量大于10ku,对热不稳定,为蛋白类细菌素。第4类是复合细菌素,活性由脂类或碳水化合物组成的大分子复合物决定。
不同种类细菌素具有不同的pH活性范围、温度的稳定性和对水解酶的敏感性。环境pH发生改变,则细菌素的溶解性、稳定性和活性都随之变化。分离自发酵香肠的植物乳杆菌LP 31蛋白水解酶处理后失活,能够抵抗过氧化氢酶,最大活性pH范围为5.0~6.0。蜡样芽胞杆菌的细菌素80℃抑菌活性稳定,当温度达到90℃时失活,能够抵抗胰蛋白酶和木瓜蛋白酶,对蛋白酶K和链酶蛋白酶E敏感,pH活性范围6.0~9.0[11]。分离自戊糖片球菌Strain ST44AM产生的细菌素在pH 2.0~12处理2h,抑菌活性无变化,100℃经120min或121℃经20min处理仍然致敏感菌细胞溶解、酶和DNA裂解,蛋白水解酶处理失活,能够耐受淀粉酶、聚乙二醇辛基苯基醚、SDS等作用[12]。而植物乳杆菌G所产细菌素的pH活性范围为4.0~5.5。pH越低其抑菌活性越高,说明酸性条件下细菌素更容易发挥抑菌作用,此细菌素为酸依赖型细菌素[13]。
由于高温可以使蛋白质或多肽的高级构象和空间结构发生变化,从而导致蛋白质或多肽失活,而使得细菌素的抑菌活性降低。就对极端高温的敏感性而言,小分子多肽比蛋白质的抗性要强[14]。Helveticin J由瑞士乳酸杆菌481产生,分子质量37ku,属于大分子蛋白质,该细菌素对蛋白酶和高温处理敏感,100℃经30min失活,证明了大分子细菌素的抗热性较低,属于不耐热型细菌素[15]。本研究表明肠球菌产生的细菌素enterocin E5在不同pH处理后抑菌作用影响不同,在pH2~12时,均保留有抑菌活性;在pH2和pH3时enterocin E5具有较高的活性;当pH3~7时显示最强的抑菌活性;pH由中性到碱性时,抑菌活性逐渐减弱,细菌素部分失活,但pH为12时仍保留部分活性,说明enterocin E5具有很宽泛的pH活性范围。该细菌素能够抵抗121℃高温处理20min,对高浓度蛋白酶处理敏感,说明enterocin E5是一种热稳定性物质,由此可以初步判断细菌素enterocin E5为小分子蛋白多肽类物质,属于Ⅱa亚型[16]。
以前分离的乳酸菌产生的细菌素抑菌谱比较窄,主要对种内细菌有抑制作用,很少对其他种属的细菌有抑制作用。Nisin对大多数革兰阳性菌起作用,如肉毒梭菌、乳杆菌、李斯特菌和金黄色葡萄球菌等,但对革兰阴性菌、霉菌、酵母菌以及乳链菌肽产生菌无效。在一定条件下,Nisin与鳌合剂EDTA或柠檬酸盐同时作用,可以改变指示菌细胞壁的渗透性,使一些革兰阴性菌如大肠埃希菌和沙门菌对Nisin敏感[17]。近年来发现了对革兰阳性、革兰阴性均有抑制活性的细菌素[18-19]。
本文研究的enterocin E5细菌素抑菌谱较广,对革兰阳性菌、革兰阴性菌、抵抗力较强的芽胞杆菌均有抑菌活性。enterocin E5对21株动物源病原微生物具有抑制作用。能够广泛抑制肠杆菌科的病原菌,对7株猪源肠毒素型大肠埃希菌和1株鸡源致病性大肠埃希菌抑制作用最强,对鸡白痢沙门菌、鸡伤寒沙门菌、变形杆菌和肺炎克雷伯也有较强的抑制作用,特别对产生多重抗药性的3株鸡伤寒沙门菌具有明显的抑菌活性,能够抑制多杀性巴氏杆菌(分离自病死猪和鸡),抑制革兰阳性金黄色葡萄球菌、马腺疫链球菌、猪链球菌,对2株炭疽芽胞杆菌弱毒株和蜡样芽胞杆菌产生显著的抑菌活性。而分离自乳酪屎肠球菌产生的enterocin A显示了非常窄谱的抗菌活性,仅能够抑制同属的肠球菌和李斯特菌[20]。
Ⅱa细菌素具有独特的抗李斯特菌活性[21-22],绝大多数能够抑制李斯特菌的生长,而enterocin E5对李斯特菌无抑制作用,与多数肠球菌的特征不符[23]。抗李斯特菌活性检测通常作为不同来源肠球菌细菌素的评价方法[24-25]。也有报道证明暴露于高浓度细菌素后存活的指示菌获得了对相同细菌素的抵抗力[26]。某些李斯特菌株可以表现出对细菌素的天然或者获得耐受。Ennahar等比较了31株李斯特菌对4种Ⅱa细菌素enterocin A,mesentericin Y105,divercin V41和pediocin AcH的敏感性,结果显示4种Ⅱa细菌素对李斯特菌从完全抑制到没有活性作用相似,仅对1株李斯特菌没有抑菌活性[20]。本研究中Enterocin E5对李斯特菌的抑菌作用,与大多数Ⅱa细菌素的抑菌活性不同,李斯特菌对enterocin E5的抗性原因有待进一步研究。
本文首次报道产生enterocin E5细菌素的粪肠球菌分离自北京地方优良品种——北京黑猪胃肠道,enterocin E5能够广泛抑制产肠毒素型大肠埃希菌和具有多重耐药性的鸡伤寒沙门菌,这一特性与北京黑猪强大抗病力的相关性有待进一步研究。Ayeni等发现分离自奶制品的乳酸乳球菌、乳酸短杆菌对多重抗性尿道革兰阴性病原菌具有抑制活性[27],某些乳酸杆菌产生的广谱抑菌物质能够抑制大肠埃希菌的生长[28],还没有肠球菌产生的细菌素抑制多株肠毒素型大肠埃希菌和多重抗药性鸡伤寒沙门菌的报道。
enterocin E5广谱的抗菌特性在已发现的伏尔加霉素中显示了高效的抑菌作用,目前仅有少数乳酸菌产生的细菌素对抗革兰阴性菌[29]。对动物源病原微生物广谱抑制作用的能力,以及宽泛的pH活性范围和对高温的耐受性,提示enterocin E5无论在肠道微生态调节,还是抗菌药物领域的研究和应用上都很有潜力。特别对多重抗药性鸡伤寒沙门菌的抑菌作用,对家禽的饲养、疫病防控具有重要的意义。
[1] Jack R W,Tagg J R,Ray B.Bacteriocins of Gram-positive bacteria[J].Microbiol Rev,1995,59(2):171-200.
[2] Papagianni M.Ribosomally synthesized peptides with antimicrobial properties:biosynthesis,structure,function,and applications[J].Biotechnol Adv,2003,21(6):465-499.
[3] Aymerich T,Artigas M G,Garriga M,et al.Effect of sausage ingredients and additives on the production of enterocin A and B by Enterococcus faecium CTC492.Optimization of in vitro production and anti-listerial effect in dry fermented sausages[J].J Appl Microbiol,2000,88(4):686-694.
[4] Casaus P,Nilsen T,Cintas L M,et al.Enterocin B,a new bacteriocin from Enterococcus faecium T136which can act synergistically with enterocin A [J].Microbiology,1997,143(Pt7):2287-2294.
[5] Cintas L M,Casaus P,Havarstein L S,et al.Biochemical and genetic characterization of enterocin P,a novel sec-dependent bacteriocin fromEnterococcus faeciumP13with a broad antimicrobial spectrum [J].Appl Environ Microbiol,1997,63(11):4321-4330.
[6] Eguchi T,Kaminaka K,Shima J,et al.Isolation and characterization of enterocin SE-K4produced by thermophilic enterococci,Enterococcus faecalis K-4.[J].Biosci Biotechnol Biochem,2001,65(2):247-253.
[7] du Toit M,Franz C M,Dicks L M,et al.Preliminary characterization of bacteriocins produced by Enterococcus faecium and Enterococcus faecalis isolated from pig faeces[J].J Appl Microbiol,2000,88(3):482-494.
[8] Kim M H,Kong Y J,Baek H,et al.Optimization of culture conditions and medium composition for the production of micrococcin GO5by Micrococcus sp.GO5 [J].J Biotechnol,2006,121(1):54-61.
[9] Ryan M P,Meaney W J,Ross R P,et al.Evaluation of lacticin 3147and a teat seal containing this bacteriocin for inhibition of mastitis pathogens[J].Appl Environ Microbiol,1998,64(6):2287-2290.
[10] Audisio M C,Oliver G,Apella M C.Antagonistic effect of Enterococcus faeciumJ96against human and poultry pathogenic Salmonellaspp[J].J Food Prot,1999,62(7):751-755.
[11] Bizani D,Brandelli A.Characterization of a bacteriocin produced by a newly isolated Bacillus sp.Strain 8A[J].J Appl Microbiol,2002,93(3):512-519.
[12] Todorov S D ,Dicks L M.Bacteriocin production by Pediococcus pentosaceus isolated from marula Scerocarya birrea[J].Int J Food Microbiol,2009,132(2):117-126.
[13] MarekováM,LaukováA,DeVuyst L,et al.Partial characterization of bacteriocins produced by environmental strain Enterococcus faeciumEK13[J].J Appl Microbiol,2003,94(3):523-530.
[14] Abriouel H,Valdivia E,Gálvez A,et al.Influence of physico-chemical factors on the oligomerization and biological activity of bacteriocin AS-48[J].Curr Microbiol,2001,42(2):89-95.
[15] Thompson J K,Collins M A,Mercer W D.Characterization of a proteinaceous antimicrobial produced by Lactobacillus helveticus CNRZ450[J].J Appl Bacteriol,1996,80(3):338-348.
[16] 崔德凤,聂晓华,周 波,等.肠球菌产Enterocin基因的检测[J].中国兽医杂志,2011,47(9):21-23.
[17] Stevens K A,Sheldon B W,Klapes N A,et al.Nisin treatment for inactivation of Salmonella species and other gramnegative bacteria [J].Appl Environ Microbiol,1991,57(12):3613-3615.
[18] Worobo R W,Van Belkum M J,Sailer M,et al.A signal peptide secretion-dependent bacteriocin fromCarnobacterium divergens[J].J Bacteriol,1995,177(11):3143-3149.
[19] Yang R,Johnson M C,Ray B.Novel method to extract large amounts of bacteriocins from lactic acid bacteria [J].Appl Environ Microbiol,1995,58(10):3355-3359.
[20] Van Belkum M J,Stiles M E.Nonlantibiotic antibacterial peptides from lactic acid bacteria[J].Nat Prod Rep,2000,17(4):323-335.
[21] Ennahar S,Deschamps N.Anti-Listeriaeffect of enterocin A produced by cheese-isolated Enterococcus faecium EFM01,relative to other bacteriocins from lactic acid bacteria[J].J Appl Microbiol,2000,88(3):449-457.
[22] Ennahar S,Assobhel O,Hasselmann C,et al.Inhibition of Listeria monocytogenes in a smear-surface soft cheese by Lactobacillus plantarum WHE 92,apediocin AcH producer[J].J Food Prot,1998,61(2):186-191.
[23] Atrih A,Rekhif N,Moir A J,et al.Mode of action,purification and amino acid sequence of plantaricin C19,an anti-Listeria bacteriocin produced by Lactobacillus plantarum C19[J].Int J Food Microbiol,2001,68(1-2):93-104.
[24] Franz C M,Schillinger U,Holzapfel W H,et al.Production and characterization of enterocin 900,a bacteriocin produced by Enterococcus faeciumBFE 900from black olives[J].Int J Food Microbiol,1996,29(2-3):255-270.
[25] Giraffa G,Neviani E,Tarelli G T.Antilisterial activity by enterococci in a model predicting the temperature evolution of Taleggio,an Italian soft cheese[J].J Dairy Sci,1994,77(5):1176-1182.
[26] Giraffa G.Functionality of enterococci in dairy products[J].Int J Food Microbiol,2003,88(2):215-222.
[27] Rekhif N,Atrih A,Lefebvre G.Activity of plantaricin SA6,a bacteriocin produced by Lactobacillus plantarumSA6isolated from fermented sausage[J].J Appl Bacteriol,1995,78(4):349-358.
[28] Ayeni F A,Adeniyi B A,Ogunbanwo S T,et al.Inhibition of uropathogens by lactic acid bacteria isolated from dairy foods and cow's intestine in western Nigeria[J].Arch Microbiol,2009,191(8):639-648.
[29] De Kwaadsteniet M,Todorov S D,Knoetze H,et al.Characterization of a 3944Da bacteriocin,produced by Enterococcus mundtii ST15,with activity against Gram-positive and Gram-negative bacteria[J].Int J Food Microbiol,2005,105(3):433-444.
