鸡干扰素调节因子7的原核表达及多克隆抗体的制备
2013-08-14崔鹏飞邓国华韦良孟焦培荣
崔鹏飞,邓国华,韦良孟,焦培荣*,廖 明*
(1.华南农业大学兽医学院,广东广州510642;2.人兽共患病防控制剂国家地方联合工程实验室
农业部兽用疫苗创制重点实验室 广东省动物源性人兽共患病预防与控制重点实验室,广东广州510642;3.中国农业科学院哈尔滨兽医研究所,黑龙江哈尔滨150001)
干扰素调节因子7(interferon regulatory factor 7,IRF7)是干扰素调节因子家族的成员之一,在Ⅰ型干扰素的诱导表达过程中发挥着重要作用。最初IRF7因结合EB病毒编码基因EBNA-1的Qq启动子区域而被发现[1]。IRF7在大多数细胞中呈低水平表达,但当细胞受到病毒感染、脂多糖、干扰素、某些化学物质如丁酸钠刺激后,细胞内的IRF7表达水平会迅速升高,进而诱导Ⅰ型干扰素的表达[2]。IRF7除了参与调节干扰素介导的先天性免疫反应外,还参与调节细胞生长和凋亡、调节免疫细胞的分化和激活等过程[3-5]。目前,有关IRF7的研究主要集中在哺乳动物,而对于禽类IRF7的研究相对较少,本研究旨在通过原核表达系统表达鸡干扰素调节因子7(chIRF7)蛋白,并以其为免疫原制备鼠抗鸡干扰素调节因子7(chIRF7)蛋白多克隆抗体,为进一步研究家禽免疫调节过程中chIRF7的生物学功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株及实验动物 原核表达载体pET30a,感受态细胞JM109、BL21(DE3)均由本实验室保存,9日龄~11日龄SPF鸡胚与6周龄~8周龄Balb/c雌性小鼠购自广东省实验动物中心。
1.1.2 主要试剂 Phusion高保真DNA聚合酶,限制性内切酶EcoRⅠ、NotⅠ均购自NEB公司;Ligation High高效连接试剂盒购自Toyobo公司;RNA提取试剂盒购自Qiagen公司;质粒小提和胶回收试剂盒购自OMEGA公司;His·Bind Resin购自Novagen公司;M-MLV逆转录酶购自Promega公司;IPTG和DNA Marker购自宝生物工程(大连)有限公司;Protein Marker购自Fermentas公司;弗氏完全佐剂和弗氏不完全佐剂购自Sigma公司;FITC标记的羊抗鼠二抗购自Southernbiotech公司。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中登录的chIRF7的mRNA序列(登录号为205372.1),通过Primer Premier 5.0软件设计一对扩增chIRF7开放阅读框全长的特异性引物,引物序列如下:
chIRF7UP:5′-CCGGAATTCGCA GCACTGGACAGCGAG-3′(下划线处为EcoRⅠ酶切位点),
chIRF7Low:5′-ATAGTTTAGCGGCCGCTC-AGTCTGTCTGCATGTG-3′(下划线处为NotⅠ酶切位点)。
1.2.2 鸡胚成纤维细胞(CEF)总RNA的提取 以禽流感病毒感染CEF细胞,感染12h后收集CEF细胞,按照Qiagen公司RNA提取试剂盒说明,提取CEF细胞总RNA。
1.2.3 chIRF7的RT-PCR扩增 以提取的CEF细胞总RNA为模板,参照Promega公司的M-MLV逆转录酶说明书进行反转录合成cDNA。以反转制备的cDNA为模板,利用高保真Phusion DNA聚合酶,扩增chIRF7ORF全长,反应程序如下:98℃30 s;98℃10s,63℃30s,72℃50s,35个循环;72℃10min。
1.2.4 PET30a-chIRF7重组质粒的构建与鉴定将chIRF7的PCR纯化产物与原核表达载体PET30a分别用EcoRⅠ和NotⅠ进行双酶切,然后连接、转化至JM109感受态细胞,挑取卡那霉素抗性平板中单菌落过夜培养,提取质粒,通过PCR、酶切、测序筛选阳性重组质粒。
1.2.5 chIRF7蛋白的诱导表达与纯化 将测序正确的重组质粒PET30a-chIRF7转化至大肠埃希菌BL21(DE3),挑取单菌落,过夜培养后,以1∶100比例接种至新鲜卡那霉素抗性的液体LB中,待菌液OD 600达到0.6~1.0时,加入终浓度为0.2 mmol/L的IPTG,于37℃诱导表达4h,取菌液与2×SDS Loading buffer等体积混合,沸水煮5min后置于冰上冷却,通过SDS-PAGE检测重组蛋白的表达情况。对IPTG诱导浓度、诱导温度进行优化后,大量诱导表达重组蛋白,并利用Novagen公司的His·Bind Resin纯化重组蛋白。
1.2.6 鼠抗chIRF7蛋白多克隆抗体的制备 取纯化好的chIRF7蛋白与等体积弗氏完全佐剂乳化均匀后免疫接种6周龄~8周龄Balb/c小鼠,首免后每隔2周用chIRF7蛋白与等体积弗氏不完全佐剂乳化均匀后加强免疫接种两次,三免后10d,断尾采血通过间接ELISA测定血清抗体效价。
1.2.7 间接免疫荧光技术(IFA)检测chIRF7蛋白多抗的反应性 以禽流感病毒感染CEF细胞,分别于感染后0、4、8、12h,取细胞用40g/L多聚甲醛室温固定15min,5mL/L Triton X-100通透10min,然后将小鼠抗chIRF7蛋白多抗血清1∶500稀释作为一抗,37℃孵育1h,PBST洗涤3次后,加入1∶1 000稀释的FITC标记羊抗鼠二抗,37℃孵育1h,PBST洗涤3次后用荧光显微镜进行观察。
2 结果
2.1 chIRF7基因的扩增与克隆
以禽流感病毒(AIV)感染CEF细胞的总RNA为模板,利用RT-PCR技术,扩增出大小约为1 500 bp的chIRF7-ORF基因(图1),将PCR产物和原核表达载体PET30a分别用EcoRⅠ和NotⅠ双酶切后连接、转化至JM109感受态细胞,将菌液PCR检测疑似阳性重组质粒样品用EcoRⅠ和NotⅠ进行双酶切验证,结果可切出大小约为1 500bp的目的片段和5 400bp左右的载体片段(图2),与预期大小相符。测序结果显示,插入目的片段序列与Gen-Bank中公布的原始序列同源性为100%,表明重组质粒构建成功,将其命名为PET30a-chIRF7。
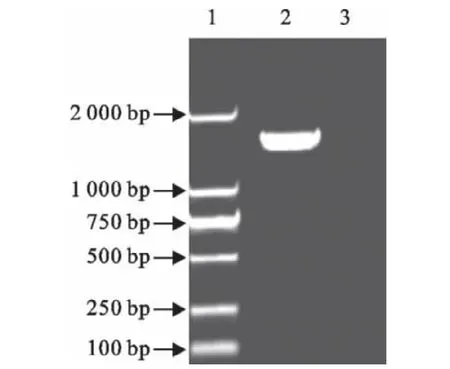
图1 chIRF7-ORF的PCR扩增Fig.1 Amplification of chIRF7ORF gene by PCR
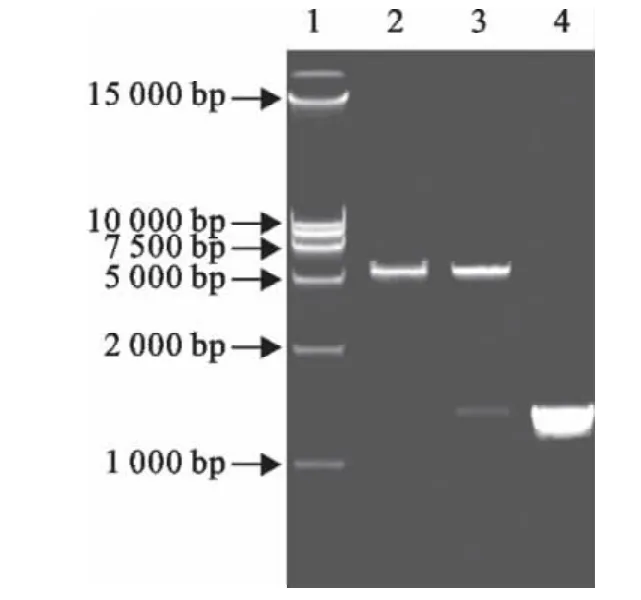
图2 重组质粒PET30a-chIRF7的酶切及PCR鉴定Fig.2 Identification of PET30a-chIRF7by enzyme digestions and PCR
2.2 chIRF7重组蛋白的诱导表达与纯化
将重组质粒PET30a-chIRF7转化至大肠埃希菌BL21(DE3),经IPTG诱导,SDS-PAGE检测结果显示,IPTG诱导后在60ku处有蛋白表达,与预期融合蛋白大小一致。而转化PET30a空载体的对照组,在此处无蛋白表达。对诱导条件优化结果显示,IPTG浓度对于目的蛋白的表达量影响不大,在25℃条件下进行诱导,目的蛋白能够大量可溶性表达。利用Novagen公司的His·Bind Resin对目的蛋白进行纯化,取纯化蛋白进行SDS-PAGE检测,结果在60ku处可见清晰的蛋白条带(图3)。
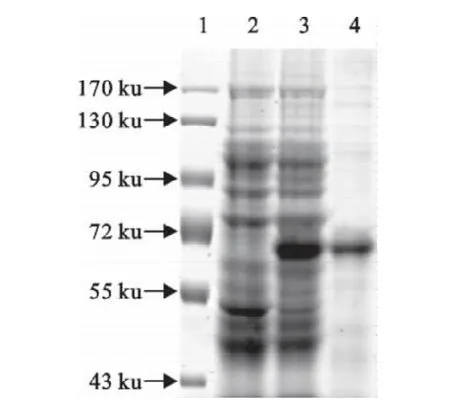
图3 SDS-PAGE分析纯化的重组chIRF7蛋白Fig.3 SDS-PAGE analysis of purified rchIRF7proteins
2.3 鼠抗chIRF7蛋白多克隆抗体效价测定
以纯化好的重组蛋白rchIRF7免疫6周龄~8周龄Balb/c小鼠,三免后10d断尾采集小鼠血液,分离血清,用间接ELISA测定血清抗体效价在1∶51 200以上。
2.4 IFA检测chIRF7蛋白多抗的反应性
通过IFA检测鼠抗chIRF7蛋白多抗血清与AIV感染CEF细胞内chIRF7蛋白的反应情况,结果未受禽流感病毒感染刺激的CEF细胞检测不到荧光,而禽流感病毒感染CEF细胞后4、8、12h均可检测到特异性荧光,并且产生荧光细胞的数目和荧光强度随着感染时间的延长而增加(图4)。
3 讨论
IRF3和IRF7具有高度的同源性,是干扰素调节因子家族中参与Ⅰ型干扰素表达调控的主要成员。IRF3在机体中呈组成性表达,以非活化的单体形式存在于细胞质中。与IRF3不同,IRF7在大多数细胞中的表达量很低,但它可以被Ⅰ型干扰素介导的信号通路激活并大量表达。在病原微生物入侵后,IRF3首先被活化,活化的IRF3移位至细胞核,与NF-kB和AP-1等转录因子协同作用,诱导早期IFN-β和IFN-α4的表达。这些快速而低水平表达的干扰素,可通过干扰素信号通路的正反馈调节诱导IRF7蛋白的大量表达[6]。因此,在通过IFA检测chIRF7蛋白多抗反应性时,未感染AIV的CEF细胞由于体内IRF7蛋白含量太低而检测不到荧光,而在AIV感染的刺激下CEF细胞内IRF7蛋白的表达量增加,所以AIV感染的CEF细胞可检测到荧光,并且荧光强度和产生荧光的细胞数目随着感染时间的增加而增加。
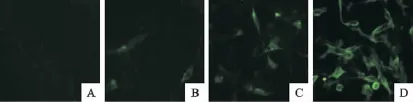
图4 IFA检测chIRF7蛋白多抗的反应性Fig.4 Identification the reactivity of chIRF7protein with polyclonal antibody by IFA
本研究在大肠埃希菌中成功地表达了chIRF7蛋白,将纯化的重组蛋白rchIRF7免疫小鼠,可诱导产生高滴度的多克隆抗体,间接ELISA测定抗体滴度在1∶51 200以上,该多克隆抗体可以识别AIV感染的CEF细胞内的chIRF7蛋白,表明制备的多克隆抗体具有良好的特异性,为进一步研究chIRF7的生物学功能奠定了物质基础。
[1] Zhang L,Pagano J S.IRF-7,a new interferon regulatory factor associated with Epstein-Barr virus latency[J].Mol Cell Biol,1997,17(10):5748-5757.
[2] Zhang L,Pagano J S.Structure and function of IRF-7[J].J Interferon Cytokine Res,2002,22(1):95-101.
[3] Ning S,Pagano J S,Barber G N.IRF7:activation,regulation,modification and function[J].Genes Immun ,2011,12(6):399-414.
[4] Santana-De Anda K,Gomez-Martin D,Diaz-Zamudio M,et al.Interferon regulatory factors:Beyond the antiviral response and their link to the development of autoimmune pathology[J].Autoimmun Rev,2011,11(2):98-103.
[5] Savitsky D,Tamura T,Yanai H,et al.Regulation of immunity and oncogenesis by the IRF transcription factor family[J].Cancer Immunol Immunother,2010,59(4):489-510.
[6] Bouttier M,Goncalves C,Journo C,et al.Viruses and interferon:mechanisms of interferon induction and strategies to escape interferon response[J].Virology,2008,12(3):159-173.
