细粒棘球绦虫G1型Eg95基因的原核表达及蛋白鉴定
2013-08-14曹利利杨美英张莹光商立民
徐 丹,曹利利,魏 峰,杨美英,张莹光,商立民,刘 全*
(1.吉林农业大学生命科学学院,吉林长春130118;2.军事医学科学院军事兽医研究所 吉林省人兽共患病预防与控制重点实验室,吉林长春130122;3.吉林省畜牧兽医科学研究院,吉林长春130062)
棘球蚴病(Echinococcosis)又称包虫病(Hydatid disease),是由棘球属绦虫的幼虫寄生于人或动物引起的呈世界分布的人兽共患寄生虫病[1]。猪、牛等中间宿主因误食虫卵污染的水或食物而感染,虫卵经胃液消化,在小肠内孵化为六钩蚴并沿血液循环通路进入肝、肺、脑等组织,导致牲畜体质下降,繁殖能力丧失,最后大批死亡,严重危害畜牧业发展[2]。目前公认的棘球属绦虫有4个种,即细粒棘球绦虫(Echinococcus granulosus)、多房棘球绦虫(E.multilocularis)、少节棘球绦虫 (E.oligarthrus)和褔氏棘球绦虫(E.vogeli),我国存在前2种,其中主要是细粒棘球绦虫[3]。根据细粒棘球绦虫细胞色素C氧化酶亚单位1、NADH脱氢酶1及核糖体DNA第一转录间隔区ITS1基因,将细粒棘球绦虫划分为10个基因型(G1~G10)[4]。我国已发现细粒棘球绦虫G1型(羊株)及G6型(骆驼株)[5],其中 G1型为流行株[6]。
细粒棘球绦虫Eg95蛋白在细粒棘球绦虫六钩蚴时期入侵小肠绒毛上皮过程中起重要作用。有研究表明,接种细粒棘球蚴Eg95重组抗原疫苗的羊可获得96%~100%的免疫保护,其中86%的羊得到完全的保护[7],Eg95抗原被认为是理想的保护性抗原。但不同种细粒棘球绦虫发育速度、宿主范围、致病性等存在较大差异[4],不同地域及不同宿主的Eg95基因之间也存在着差异[8],故应对不同种细粒棘球绦虫作针对性研究。
本研究以我国高发的细粒棘球绦虫G1型Eg95基因开放阅读框为研究对象,表达了细粒棘球绦虫Eg95蛋白,并对表达蛋白进行 Western blot鉴定,以期为我国细粒棘球绦虫病诊断防治提供参考。
1 材料与方法
1.1 材料
1.1.1 模板及血清 细粒棘球绦虫G1型Eg95抗原基因序列由上海旭冠生物科技发展有限公司合成,细粒棘球绦虫感染羊阳性血清由青海省动物疾病预防控制中心馈赠。
1.1.2 质粒与菌种 原核表达载体pET-28a、大肠埃希菌 DH5α、BL21(DE3)均由本实验室保存。pMD-18T载体购自宝生物工程(大连)有限公司。
1.1.3 酶与试剂 10×PCR buffer、MgCl2、dNTPs、Taq DNA聚合酶、T4DNA连接酶均购自Promega公司;6×Loading buffer、DNA Marker DL 2 000、DNA Marker DL10 000,购自宝生物工程(大连)有限公司;DNA快速纯化/回收试剂盒、质粒快速提取试剂盒,购自北京鼎国昌盛生物技术有限公司;IPTG筛选试剂,购自北京博润德生物科技发展中心;EcoRⅠ、XhoⅠ限制性内切酶、预染蛋白Marker,购自NEB公司;辣根酶标记山羊抗兔IgG(H+L),购自ZSGB-BIO公司;DAB显色试剂盒,购自MAIXIN-Bio公司;其他试剂均为国产分析纯。
1.1.4 引物的设计与合成 根据G1型细粒棘球绦虫Eg95抗原基因,利用Oligo软件设计了一对特异性引物,为使抗原基因正确克隆到pET-28a载体,上游引物加入EcoRⅠ酶切位点,下游引物加入XhoⅠ酶切位点,引物由北京鼎国昌盛生物技术有限公司合成。
引物 序 列 如 下:F1:5′-CCGGAATTCGCATTCCAGTTATGTCGCATC-3′;R1:5′-CGCTCGAGAGTAAGGACAACCACTATGC-3′。
1.2 方法
1.2.1 PCR扩增Eg95基因 以合成的Eg95基因序列为模板,F1和R1为引物扩增Eg95基因,反应体系如下:反应总体积25μL,其中10×PCR buffer 2.5μL,MgCl2(2.5mmol/L)2.5μL,dNTPs(10 mmol/L)0.6μL,F1(10μmol/L),R1(10μmol/L)各1μL,Taq DNA聚合酶(2.5U/μL)0.25μL,模板DNA 1μL,ddH2O 16.15μL。扩增条件为:94℃预变性3min;94℃60s,58℃30s,72℃60s,30个循环;72℃延伸5min。PCR产物经10g/L琼脂糖凝胶电泳观察结果。
1.2.2 pET-28a-Eg95原核表达载体的构建及鉴定利用DNA快速纯化/回收试剂盒回收PCR产物,将纯化的PCR扩增产物与pMD-18T载体连接,16℃连接过夜。连接产物转化至E.coli DH5α感受态细胞,涂布于含有氨苄青霉素(50μg/mL)的LB琼脂培养基上,37℃过夜培养,挑取单克隆培养后提取质粒,EcoRⅠ和XhoⅠ双酶切鉴定重组子。将鉴定正确的重组质粒和pET-28a载体分别用EcoRⅠ和XhoⅠ双酶切,回收抗原基因及载体片段,回收产物用T4DNA连接酶16℃连接过夜,连接产物转化至E.coli DH5α感受态细胞,在含卡那霉素(50μg/mL)的LB琼脂培养基上,37℃培养12 h,挑取单菌落培养后提取质粒,用EcoRⅠ和XhoⅠ双酶切鉴定,酶切产物经10g/L琼脂糖凝胶电泳观察结果。鉴定正确的pET-28a-Eg95质粒转化E.coli BL21感受态细胞。
1.2.3 重组蛋白的诱导表达 取单克隆阳性菌落pET-28a-Eg95质粒的BL21菌种,1%接种于含50 μg/mL卡那霉素的LB液体培养基中,37℃振荡培养至OD 600nm为0.4~0.6时,加入无菌IPTG至终浓度为1mmol/L,诱导表达4h后,表达产物进行SDS-PAGE分析,同时用终浓度为1mmol/L的IPTG诱导含空载体pET-28a的BL21(DE3)。
1.2.4 表达产物的SDS-PAGE检测 收集表达及对照组菌液,重悬于SDS-PAGE上样缓冲液中,煮沸变性5min,11 000r/min离心5min后电泳(130 g/L SDS-PAGE)。电泳后考马斯亮蓝R-250染色过夜,脱色液脱色至背景透明。
1.2.5 Western blot分析 表达产物经SDSPAGE电泳后,电转移至硝酸纤维素膜(NC膜)上(电压15V,30min),50g/L脱脂奶粉的PBS为封闭液封闭膜上的非特异性位点,室温孵育2h,用PBST(含体积比0.5mL/L Tween-20的PBS)漂洗5次,每次5min,膜上加入用封闭液以1∶1 500倍稀释的阳性血清,4℃孵育过夜,用PBST漂洗5次,加入用PBS以1∶3 000倍稀释的二抗(辣根酶标记山羊抗兔IgG)室温孵育2h,用PBST漂洗5次,DAB显色液显色。
2 结果
2.1 PCR扩增Eg95基因的结果
以合成Eg95基因为模板,经PCR扩增得到一条约480bp的基因片段,其大小与预期结果相符合(图1)。
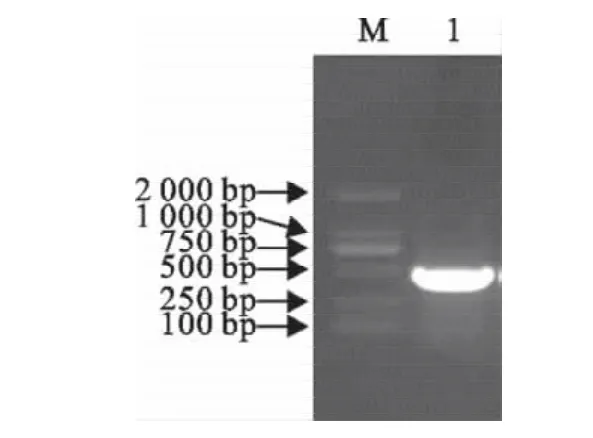
图1 Eg95基因PCR扩增产物Fig.1 Amplification of EG95gene by PCR
2.2 重组质粒的构建及鉴定
重组质粒pET-28a-Eg95经EcoRⅠ、XhoⅠ双酶切鉴定,可得到480bp和5 400bp左右的条带,与预期片段大小相符(图2),说明目的片段已插入到pET-28a载体中。
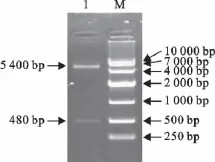
图2 重组质粒pET-28a-Eg95酶切鉴定Fig.2 Identification of the pET-28a-Eg95by enzyme digestion
2.3 表达产物的SDS-PAGE检测
结果显示,重组融合蛋白的相对分子质量约为16.5ku,大小与预期融合蛋白分子质量基本一致,对照无此条带(图3)。
2.4 表达产物的Western blot分析
表达蛋白经SDS-PAGE后,转移至NC膜上进行免疫学反应,结果显示(图4),重组蛋白可以被阳性血清识别,证明重组蛋白具有很好的反应原性。
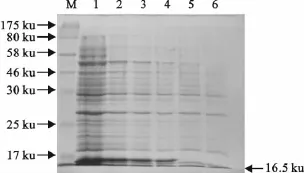
图3 重组蛋白的SDS-PAGE分析Fig.3 Analysis of the recombinant protein by SDS-PAGE

图4 重组蛋白的Western blot分析Fig.4 Western blot analysis of the recombinant protein
3 讨论
棘球蚴病呈世界性分布,我国以甘肃、新疆、宁夏、内蒙古、青海等省(区)流行严重。世界各国均投入大量的人力、物力、财力,通过各种途径开展棘球蚴病的防控研究[9],传统的利用化学药物治疗寄生虫病易使虫株产生耐药性,不利于长期性治疗[10]。早期利用重组抗原疫苗防控羊棘球蚴病获得良好免疫保护效果,疫苗防控成为控制棘球蚴病流行的有效方法[11]。
EG95是一种具有保护作用的抗原,为最具发展前景的棘球蚴病侯选疫苗。Lightowlers M W等[7]研究发现,用pGEX-3-EX表达EG95重组蛋白免疫的羊能够诱导出高水平的保护作用,约86%的羊得到完全的免疫保护。丁剑冰等[12]利用构建的pcDNA3-EG95核酸疫苗免疫小鼠,可诱发小鼠产生特异性免疫应答。贾海英等[13]对新西兰株细粒棘球绦虫EG95重组抗原蛋白进行血清学研究,试验结果表明细粒棘球绦虫病病人血清可与EG95重组抗原特异性反应,为EG95重组抗原应用于临床提供科学依据。
我国是棘球蚴病高发的国家,以G1型细粒棘球蚴感染最为流行[5-6],本研究根据已知的细粒棘球绦虫G1型EG95基因开放阅读框为研究对象,利用原核表达载体pET-28a在大肠埃希菌中高效表达细粒棘球绦虫G1型EG95蛋白,经SDS-PAGE后进行Western blot分析,检测结果表明,在16.5 ku左右出现一条特异性反应条带,表明G1型细粒棘球绦虫EG95蛋白在大肠埃希菌中高效表达,本研究下一步将对EG95重组蛋白进行纯化并鉴定其免疫原性,为疫苗制备奠定基础,以期为防控我国细粒棘球绦虫病提供有效的途径。
[1] Moro P,Schantz P M.Echinococcosis:a review[J].Int J Infect Dis,2009,13:125-133.
[2] 张先军.包虫病危害与预防[J].畜牧兽医杂志,2012,31(1):114-116.
[3] 金宁一,胡仲明,冯书章.新编人兽共患病学[M].北京:科学出版社,2007:833-843.
[4] Wang Z H,Wang X M,Liu X Q.Echinococcosis in China,a review of the epidemiology of Echinococcus spp [J].Eco Health,2008,5:115-126.
[5] 张亚楼,Bart J M,温 浩.新疆家犬体内存在细粒棘球绦虫G1(羊)株和G6(骆驼)株的分子证据(英文)[J].中国寄生虫病防治杂志,2005,18(5):333-335.
[6] Yang Y R,Rosenzvit M C,Zhang L H,et al.Molecular study of Echinococcus in west-central China [J].Parasitology,2005,131(4):547-555.
[7] Lightowlers M W,Jensen O,Fernandez E,et al.Vaccination trials in Australia and Argentina confirm the effectiveness of the EG95hydatid vaccine in sheep[J].Int J Parasitol,1999,29:531-534.
[8] Chow C,Gauci C G,Vural G,et al.Echinococcus granulosus:variability of the host-protective EG95vaccine antigen in G6and G7genotypic variants[J].Exp Parasitol,2008,119:499-505.
[9] 叶尔江·苏里唐,江 莉,柴君杰.我国棘球蚴病防治研究进展[J].中国寄生虫学与寄生虫病杂志,2000,18(3):179-181.
[10] Dalton J P,Mulcahy G.Parasite vaccines——a reality[J].Vet Parasitol,2001,98:149-167.
[11] Lightowlers M W,Flisser A,Gauci C G,et al.Vaccination against cysticercosis and hydatid disease[J].Parasitol Today,2000,16(5):191-196.
[12] 丁剑冰,马秀敏,魏晓丽,等.细粒棘球绦虫Eg95基因疫苗和重组抗原诱导小鼠免疫应答的比较研究[J].中国人兽共患病学报,2006,22(4):347-351.
[13] 贾海英,马秀敏,丁剑冰,等.细粒棘球蚴Eg95重组蛋白表达及其血清学反应的研究[J].中国人兽共患病学报,2009,25(4):344-347.
