伪狂犬病病毒EP0基因的克隆及原核表达
2013-08-14周慧英孙磊磊吉艺宽琚春梅
周慧英,程 艺,孙磊磊,王 雨,吉艺宽,任 涛,琚春梅
(华南农业大学兽医学院,广东广州510642)
伪狂犬病病毒(Pseudorabies viurs,PRV)属疱疹病毒科(Herpesviridae),α-疱疹病毒亚科(Alpha-herpesvirinae)。该病毒可感染多种动物,猪为其贮存宿主,且可引起潜伏感染[1]。早期蛋白0(early protein 0,EP0)是目前已知的3个PRV早期蛋白之一。研究表明,EP0可以促进PRV立即早期蛋白(immediate-early protein)基因IE180、糖蛋白G (glycoprotein G,gG)(gX)、胸苷激酶(thymidine kinase,TK)启动子的转录,在与IE180蛋白共同作用下,EP0蛋白激活TK和gG(gX)启动子转录的效率更高[2-3]。Ono等[2]研究表明EP0蛋白可提高病毒基因组DNA的感染性,有利于病毒粒子的复制。
对EP0蛋白结构域的研究表明,该蛋白中存在与锌指结构类似的环指结构域,是结合DNA、RNA及蛋白质-蛋白质相互作用的区域,但与EP0蛋白同源性很高的单纯疱疹病毒1型(Herpes simplex virus type 1,HSV-1)的ICP0、水痘-带状疱疹病毒(Varicella-zoster virus,VZV)的 ORF61和马疱疹病毒1型(Equine herpes virus 1,EHV-1)的基因63的产物已被证明并不结合DNA、RNA[4],因此EP0蛋白可能在蛋白质-蛋白质相互作用方面具有重要作用。对与PRV同属α-疱疹病毒的HSV-1ICP0的研究证实了该蛋白与病毒粒子中的ICP4、VP22等均存在相互作用[5]。Guo H 等[6]对EP0蛋白的研究发现它能够与至少6种核蛋白存在相互作用,推测EP0蛋白可能是通过与细胞的转录因子相互作用来发挥转录调控功能[7]。本研究拟在大肠埃希菌中对含有GST标签的伪狂犬病病毒EP0基因进行表达,为深入研究EP0蛋白与宿主细胞及PRV病毒粒子中其他蛋白的相互作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒及菌株 伪狂犬病病毒强毒株分离株,大肠埃希菌 TOP10及BL21(DE3),表达载体pGEX-4T-1,均由华南农业大学兽医微生物学与免疫学教研室保存。
1.1.2 试剂 LA Taq酶、限制性内切酶EcoRⅠ及NotⅠ、T4DNA连接酶,DNA Marker,IPTG、琼脂糖均购自宝生物工程(大连)有限公司;蛋白质Marker购自Fermentas公司;DNA凝胶回收试剂盒及质粒抽提试剂盒购自OMEGA公司;羊抗鼠IgG-HRP购自广州美津生物技术有限公司;伪狂犬病病毒EP0单克隆抗体由华南农业大学兽医微生物学与免疫学教研室制备并保存[8];LB肉汤培养基、琼脂粉、蛋白酶K、氨苄青霉素、DAB、EB、尿素、β-巯基乙醇、溴酚蓝、甘氨酸购自广州康龙生物技术有限公司;丙烯酰胺、N,N-亚甲叉双丙烯酰胺、SDS、四甲基乙二胺(TEMED)、过硫酸铵、考马斯亮蓝R-250,NC膜均购自北京鼎国生物技术有限责任公司。无水乙醇、甲醇、冰醋酸、氯仿、异戊醇、Tris碱、氯化钠、氢氧化钠等均为国产分析纯。
1.2 方法
1.2.1 PRV基因组DNA的提取 将PRV病毒液反复冻融3次后,取500μL病毒液加入蛋白酶K(10mg/mL)5μL,100g/L SDS 25μL,50℃作用2 h~3h,加等量的苯酚∶氯仿∶异戊醇(25∶24∶1)充分混匀,12 000r/min离心10min。取上清液,如此重复2次~3次。取上清液加入2倍体积的无水乙醇室温沉淀30min,12 000r/min离心10min弃上清,沉淀用750mL/L乙醇洗涤1次,风干后用100μL ddH2O或TE溶解,置-20℃保存备用。
1.2.2 PRV EP0基因引物的设计与合成 参考GenBank登录的伪狂犬病病毒EP0序列(AF298586),设计一对引物扩增EP0基因的完整编码区。引物序列如下:EP0-F:5′-TAGGAATTCATGGGCTGCACGGACTCT-3′(下划线部分为EcoRⅠ 酶 切 位 点),EP0-R:5′-TACGGCGGCCGCGTCGTCGTCCTGGGTGAG-3′(下划线部分为NotⅠ酶切位点)。引物由上海生工生物工程技术服务有限公司合成。
1.2.3 EP0基因的扩增与克隆 EP0基因PCR扩增条件为:95℃5min;95℃1min,56℃1min,72℃1.5min,35个循环;72℃ 10min。PCR 产物用DNA凝胶回收试剂盒进行回收。回收产物与pMD18-T载体连接,连接产物转化大肠埃希菌TOP10感受态细胞,经菌落PCR验证后挑取阳性克隆,扩大培养后提取质粒进行酶切鉴定,质粒命名为pMD-EP0。
1.2.4 重组质粒pGEX-EP0的构建 用限制性内切酶EcoRⅠ和NotⅠ对pMD-EP0进行双酶切,回收EP0基因后与经同样酶切回收的pGEX-4T-1在T4DNA连接酶作用下16℃连接过夜。将连接产物转化大肠埃希菌TOP10感受态细胞中,经菌落PCR验证后挑取阳性菌落接种于5mL含氨苄青霉素的LB中,37℃、200r/min摇床培养12h~16h,提取重组质粒,命名为pGEX-EP0,并对重组质粒进行酶切鉴定和序列测定。
1.2.5 重组质粒的诱导表达与样品处理 经酶切鉴定和测序分析正确后,将抽提的重组质粒转化感受态细胞BL21(DE3),挑取阳性菌落接种于含有氨苄青霉素的LB培养基中,37℃、200r/min摇床培养14h作为一级种子,取100μL菌液加入到新的5 mL含有氨苄青霉素的LB中,37℃、200r/min摇床培养至OD 600nm值为0.6~0.8,加入IPTG(100 mmol/L)50μL,使其终浓度为1mmol/L,28℃继续诱导5h。菌液12 000r/min离心1min,弃上清,再用PBS重悬菌体,加入等体积的2×SDS上样缓冲液,煮沸10min进行SDS-PAGE及 Western blot检测,同时设立pGEX-4T-1诱导对照、pGEX-4T-1未诱导对照及表达质粒pGEX-EP0未诱导对照。
1.2.6 表达蛋白的Western blot分析 将表达的重组蛋白经120g/L SDS-PAGE分离后,电转移至NC膜上,用50g/L脱脂奶粉4℃封闭过夜;TBST洗涤3次,每次15min,加入PRV EP0单克隆抗体(1∶300稀释),37℃孵育2h;TBST 洗涤3次,加入HRP(辣根过氧化物酶)标记的羊抗鼠IgG(1∶4 000)TBST洗涤3次,TBS洗涤2次,DAB显色,以蒸馏水终止反应。
1.2.7 表达条件的优化 为了使目的蛋白的表达量最高,采用不同的IPTG浓度、不同的时间进行诱导表达,以优化重组质粒pGEX-EP0的诱导表达条件。
2 结果
2.1 PRV EP0基因的PCR扩增
以抽提的PRV基因组DNA为模板进行PCR扩增,获得了特异性扩增条带,与预期扩增片段1 227bp大小一致,电泳结果见图1。
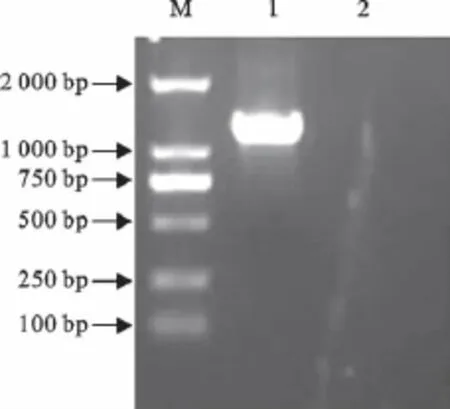
图1 PRV EP0的PCR扩增结果Fig.1 The amplification of EP0gene by PRV
2.2 重组质粒pGEX-EP0的酶切鉴定
将重组质粒pGEX-EP0转化大肠埃希菌TOP10,抽提重组质粒,然后用EcoRⅠ和NotⅠ进行双酶切鉴定,同时设立EP0PCR产物及pGEX-4T-1双酶切回收产物的对照。结果见图2。
2.3 pGEX-EP0表达产物的鉴定
将己构建的重组表达质粒转化大肠埃希菌BL21(DE3),经IPTG诱导后,通过SDS-PAGE电泳表明EP0与GST的融合蛋白大小约为71.4ku,而pGEX-4T-1载体诱导表达的GST蛋白大小为26ku(图3),Western blot结果显示融合蛋白可与PRV EP0单克隆抗体反应(图4)。
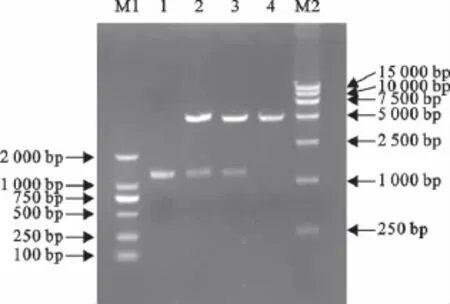
图2 重组质粒pGEX-EP0的鉴定Fig.2 Identification of recombinant plasmid pGEX-EP0
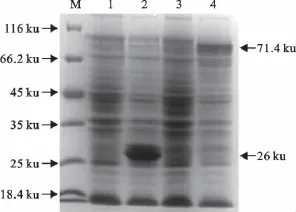
图3 表达蛋白的SDS-PAGE分析Fig.3 Analysis of the protein expression by SDS-PAGE
2.4 最佳诱导条件的确定
以不同IPTG浓度和时间对表达菌进行诱导,结果发现IPTG浓度和诱导时间均能明显地影响蛋白的表达量。由图5可知重组蛋白在1.0mmol/L和1.5mmol/L的IPTG浓度诱导下表达量最高,选择1.0mmol/L的IPTG浓度诱导可以减少ITPG的使用剂量,因此确定最佳诱导浓度为28℃,以1.0 mmol/L的IPTG浓度诱导。由图6可知重组蛋白在5h时表达量最高,因此确定最佳诱导时间为5h。

图4 表达蛋白的Western blot分析Fig.4 Analysis of protein expression by Western blot
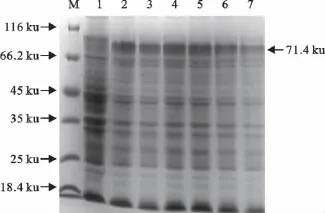
图5 不同浓度诱导表达蛋白的SDS-PAGE分析Fig.5 SDS-PAGE analysis of expression products of recombinant E.coli BL21(DE3)induced with different IPTG concentrations
3 讨论
PRV能感染多种家畜和野生动物,可引起母猪发生流产、死胎、产木乃伊胎,新生仔猪大量死亡,育肥猪出现呼吸道症状等;除猪以外的其他动物发病后通常具有发热、奇痒及脑脊髓炎等典型症状,均为致死性感染[9]。目前控制和消灭伪狂犬病所面临的主要困难是该病毒的潜伏感染问题[10]。对与PRV同属疱疹病毒科的HSV-1的研究证实,在潜伏感染期间,HSV-1ICP0蛋白可以使潜伏状态的病毒活化[11]。PRV EP0蛋白与HSV-1ICP0蛋白同源,因此推测EP0蛋白可能在PRV潜伏感染的激活中具有重要作用。
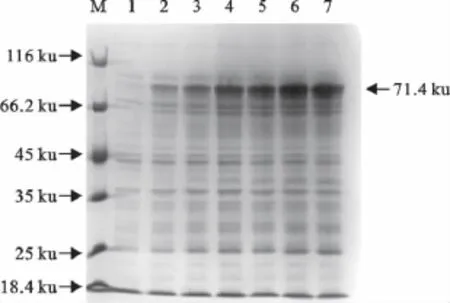
图6 不同时间诱导表达蛋白的SDS-PAGE分析Fig.6 SDS-PAGE analysis of expression products of recombinantE.coli BL21(DE3)induced with different time
EP0蛋白作为早期蛋白在病毒感染过程中发挥着复杂的功能,已有研究证实EP0蛋白具有抑制vhs[12]及gE基 因 启 动 子 的 作 用[13]。Tombácz D等[14]研究则显示,在病毒感染的整个过程中,EP0蛋白对病毒基因的作用是不断变化的,在感染早期EP0蛋白对IE180和其他早期基因的转录有促进作用,而在感染晚期对所有病毒基因的转录则有抑制作用,且抑制作用与反式激活蛋白存在剂量依赖性,如低浓度的IE180蛋白能促进病毒基因的表达,高浓度时则抑制表达,但在此过程中,EP0蛋白是直接发挥作用还是通过IE180等其他调控蛋白间接发挥作用有待进一步研究。此外,对PRV YS-81株的研究表明EP0蛋白能够促进IE180、TK、和gG基因启动子的转录[3],而对PRV Ea株和Fa株的研究则发现EP0蛋白对IE180和TK启动子的转录有抑制作用,究其原因可能与靠近环指结构域的两个氨基酸的不同有关[6]。
由于PRV DNA的G+C含量高达73%,给PCR扩增带来了很大困难,为获得较好的扩增结果,在借鉴文献[15]中程序的基础上适当改进,结果EP0蛋白基因扩增效果较好。
本试验选择pGEX原核表达系统来表达伪狂犬病病毒EP0蛋白,该系统所采用的Ptac启动子是一种最强的原核启动子,可以使目的蛋白获得高效表达,且表达的蛋白与谷胱甘肽-S-转移酶(GST)融合,便于表达蛋白的纯化。本研究利用该系统成功表达了PRV EP0蛋白,且摸索了EP0蛋白表达的最佳IPTG诱导浓度及最佳诱导时间为28℃,1 mmol/L诱导5h。该结果为深入研究EP0蛋白与宿主细胞及病毒蛋白的相互作用奠定了良好的基础。
[1] 范伟兴.PRV鲁A株的分离鉴定及表达EGFP和CSFV-E2的TK重组伪狂犬病毒的构建[D].江苏南京:南京农业大学,2002.
[2] Ono E,Watanabe S,Nikami H,et al.Pseudorabies virus(PRV)early protein 0activates PRV gene transcription in combination with the immediate-early protein IE180and enhances the infectivity of PRV genomic DNA[J].Vet Microbiol,1998,63:99-107.
[3] Watanabe S,Ono E,Shimizu Y,et al.Pseudorabies virus early protein 0transactivates the viral gene promoters[J].J Gen Virol,1995,76:2881-2885.
[4] Everett R D,Barlow P N,Milner A,et al.A novel arrangement of zinc-binding residues and secondary structure in the C3HC4motif of an alpha herpes virus protein family[J].J Mol Biol,1993,234:1038-1047.
[5] Gillian E,Wali H,Alison W,et al.Deletion of the herpes simplex virus VP22-encoding gene(UL49)alters the expression,localization,and virion incorporation of ICP0[J].J Virol,2005,79:9735-9745.
[6] Guo H,Zhou R,Chen H C,et al.Transcriptional suppression of IE180and TK promoters by the EP0of pseudorabies virus strains Ea and Fa[J].Virus Genes,2009,38:269-275.
[7] Ho T Y,Wu S L,Chang T J,et al.Pseudorabies virus early protein 0transactivates the TATA-associated promoter by stimulating the transcription initiation[J].Virus Res,1999,61(1):77-86.
[8] 孙磊磊.伪狂犬病毒EP0基因的原核表达及其单克隆抗体的制备[D].广东广州:华南农业大学,2012.
[9] 许雁峰,郭万柱,徐志文,等.伪狂犬病基因缺失疫苗SA215株gD基因的序列分析及其功能[J].中国兽医学报,2007,27(6):858-861.
[10] 熊 符.伪狂犬病病毒鄂A株EPO基因的克隆、表达及转移载体pUSKVP2的构建[D].湖北武汉:华中农业大学,2001.
[11] 李卫中,李琦涵.Ⅰ型单纯疱疹病毒ICP0蛋白:病毒与细胞间相互作用的重要调控因子[J].微生物与感染,2008,3(1):43-46.
[12] Chang Y Y,Lin H W,Wong M L,et al.Regulation of the vhs gene promoter of pseudorabies virus by IE180and EP0,and the requirement of a Sp1site for the promoter function[J].Virus Genes,2004,28(3):247-258.
[13] Chang Y Y,Wong M L,Lin H W,et al.Cloning and regulation of the promoter of pseudorabies virus(TNL Strain)glycoprotein E gene[J].Virus Genes,2002,24:235-241.
[14] Tombácz D,Tóth J S,Boldogköi Z.Effects of deletion of the early protein 0gene of pseudorabies virus on the overall viral gene expression[J].Gene,2012,493:235-242.
[15] 孙磊磊,程 艺,琚春梅,等.伪狂犬病毒EP0基因的克隆及其在大肠杆菌中的表达研究[J].中国畜牧兽医,2012,39(6):57-60.
