仿制药专利声明中1类声明数据分析及对仿制药研发的启示Δ
2024-05-14汪宇顾东蕾中国药科大学党委办公室南京211198中国药科大学图书与信息中心南京211198
汪宇 ,顾东蕾 (1.中国药科大学党委办公室,南京 211198;2.中国药科大学图书与信息中心,南京 211198)
药品专利早期纠纷解决机制,亦称药品专利链接制度,是指药品上市审评审批过程中,药品上市许可申请人与有关专利权人或者利害关系人,因申请注册的药品相关的专利权产生纠纷的,相关当事人可以向人民法院起诉,请求就申请注册的药品相关技术方案是否落入他人药品专利权保护范围作出判决。其目的是使药品审批程序与药品相关专利进行关联,降低可能发生的专利侵权风险。建立符合我国国情的药品专利链接制度,是平衡原研药企和仿制药企间利润分配、应对不同程度的公共卫生领域健康安全风险、促进新药研发、鼓励仿制药发展以及防止因专利侵权而造成的社会资源浪费等一系列问题的根本之举[1]。与国外相比,我国药品专利链接制度起步较晚,于2021年才正式实施,仍处于起步阶段,还有部分问题未能引起重视。
“药品专利声明”是药品专利链接制度的基本构成单元之一,指仿制药申请人在药物上市前的申请注册环节对仿制药物的基本信息和专利权利状态进行声明,其目的是不与其他药品专利内容产生冲突,由此造成专利纠纷[2]。2021年国家药品监督管理局和国家知识产权局出台的《药品专利纠纷早期解决机制实施办法(试行)》第六条将专利声明类型分成4类,其中的1类声明是指中国上市药品专利信息登记平台中没有登记被仿制药的相关专利信息,是我国仿制药研发面临最多的情形。因此,本文以仿制药的1类声明数据为切入点,探讨近几年1类声明制度施行的现状,并结合我国的医药市场实践,剖析我国仿制药的1类声明制度可能存在的问题,为完善中国药品专利链接制度,增强中国上市药品专利信息登记平台的功能提供依据,同时为仿制药企选择合适的仿制药品种提供参考。
1 数据来源及方法
1.1 数据来源
以国家药品监督管理局、中国上市药品专利信息登记平台、国家知识产权局等网站为数据源,以中国药品专利1类专利申明登记的药品名称及对应的药品专利号为关键词,检索相关数据。检索截止日期为2023年3月31日,部分信息的修正截止日期为2023年8月31日。
1.2 研究方法
对中国上市药品专利信息登记平台上的1类声明进行整体分析,即确定药品并根据专利信息声明事项进行逐一比对或适当描述,找出仿制药声明居多的品种,预判研发市场倾向以供仿制药企借鉴。整体分析亦是对1类声明数据的宏观把握和分析,可发现当前1类声明中存在的问题。
在此基础上,进一步对1类声明中数量综合排名靠前的品种进行剖析,包括其1类声明状态及获批状态,同时分析其市场销售情况,为仿制药企追踪仿制药品种提供线索。
2 结果
2.1 仿制药1类声明整体数据分析
在2021年7月9日-2023年3月31日登记的1类声明共涉及797种通用名药物,涉及976个不同仿制药厂家。不同药品注册类型的1类声明统计情况见表1。

表1 不同药品注册类型的1类声明统计情况
截至2023年3月31日,对仿制药1类声明数据的挖掘发现,由于药品专利声明制度对原研药专利权人初次登记的要求尚不全面,影响了仿制药企从登记声明中及时了解原研药研发、生产进展,会出现部分原研药品种在发布1类声明一段时间后,原研药专利权人对其专利信息进行补充登记公示的情况,导致仿制药企必须重新制定研发和生产方略,以规避发布的声明范围,避免法律纠纷。例如,四川科伦药业股份有限公司、宜昌人福药业有限责任公司和乐普制药科技有限公司分别于2021年的8月18日、12月11日及2022年的2月11日对辉瑞公司的枸橼酸托法替布缓释片(规格11 mg,批准文号为国药准字HJ20210071)提出了1类声明,但在批准等待过程中,作为原研专利人的辉瑞公司又于2022年11月22日对该药的专利信息进行了补充登记公示,而作为仿制药企的四川科伦药业股份有限公司和宜昌人福药业有限责任公司则只能重新提交声明,以避免陷入专利侵权纠纷。直到2023年8月15日,这2家仿制药企才获批药品生产批准文号。这种情形反映了药品专利声明制度设计的缺陷——尽管药品专利声明制度对仿制药企起到了很好的约束作用,但对原研药专利权人滥用权利的约束措施不完善,这可使原研药专利人利用中国上市药品专利信息登记平台录取信息登记不全的漏洞,将一批药品专利分不同批次报送,以此延长专利保护期,从而获得政策红利。这种行为无疑损害了仿制药企合法利用专利的权利。
笔者在对仿制药1类声明数据的挖掘中还发现另一种情况——个别药品在已具有原研药专利公示的情况下,仍公开仿制药1类声明。例如,山东京卫制药有限公司对H·隆德贝克有限公司的氢溴酸伏硫西汀片(规格分别为5、10 mg,批准文号分别为国药准字HJ20170381、国药准字HJ20170383)于2022年11月23日提出了1类声明,但原研药企H·隆德贝克有限公司已经于2021年7月5日进行了专利信息登记公示。这有可能是因为当前中国上市药品专利信息登记平台主要依赖《中国上市药品目录集》收集药品专利信息,但由于《中国上市药品目录集》仅对“特定药品”专利信息的基础内容实现了基本全面公开,而对于“其他药品”的专利信息只公开了基础信息,如专利号、类型、专利到期时间等,反而对一些能帮助仿制药企提前规避可能出现专利纠纷的药品专利法律状态并未进行收集,甚至还有一些药品在《中国上市药品目录集》中的专利信息一栏显示为空白。这直接影响了仿制药企的信息收集和判断,导致其无法提前规避侵权风险。故截至2023年8月15日,山东京卫制药有限公司对于该药的1类声明仿制药还未获批。
2.2 不同类型仿制药品的1类声明和市场分析
2.2.1 中药仿制药
截至2023年3月31日,涉及中药同名同方药的1类声明只有1件,由浙江佐力药业股份有限公司针对杭州中美华东制药有限公司的百令胶囊(批准文号为国药准字Z10910036)提出。百令胶囊从1997年至2011年获得了15年的中药品种保护期。截至2023年3月31日,浙江佐力药业股份有限公司仍未见获批。
2.2.2 生物制品仿制药
截至2023年3月31日,10家仿制药企对10家药品上市许可持有人的14款治疗用生物制品原研药提出了26件1类声明。截至2023年5月31日,已有6种生物类似药获批,详见表2。
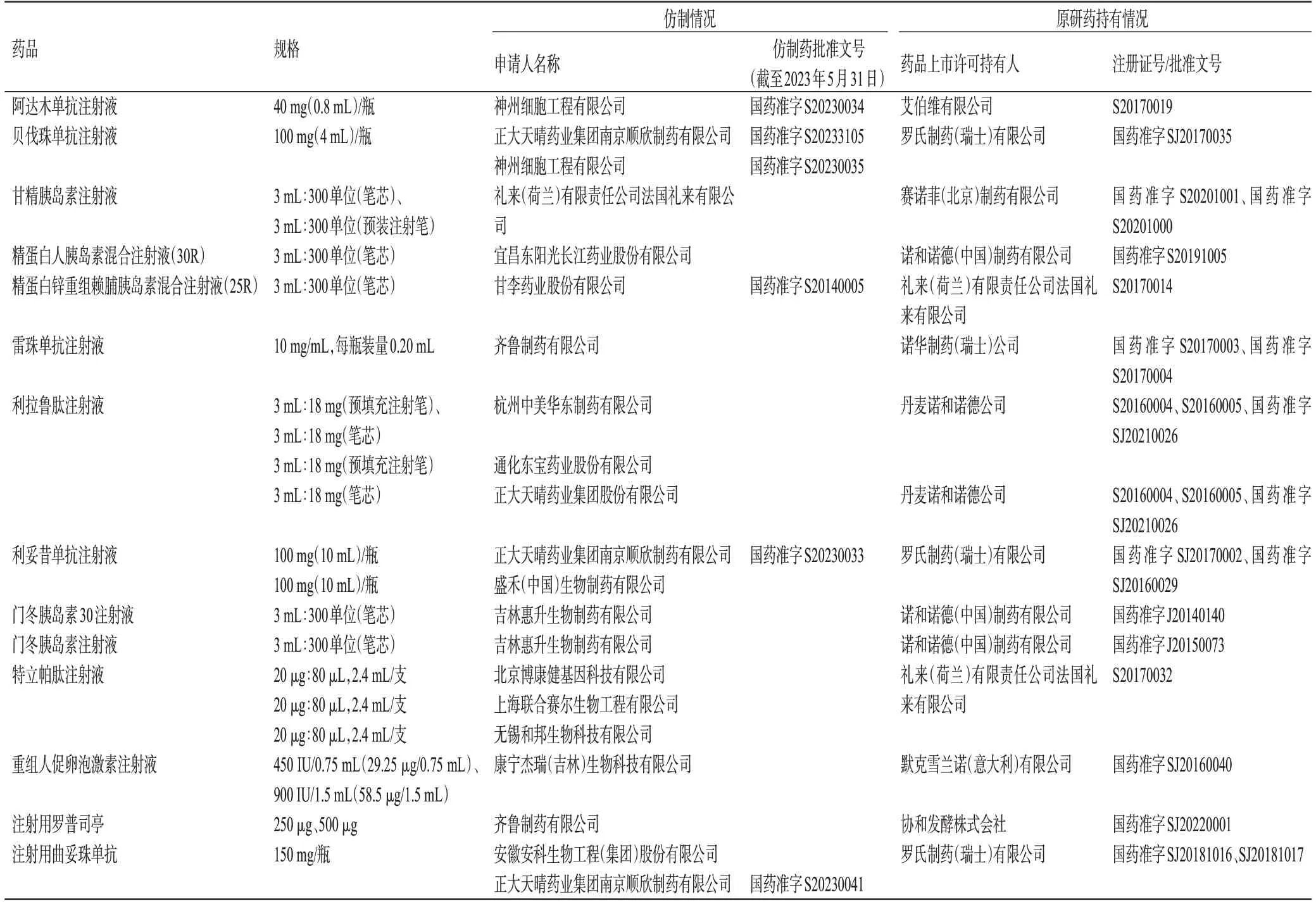
表2 治疗用生物制品1类声明数据
2.2.3 化学仿制药
从表1统计数据来看,化学仿制药1类声明占到总数的99%以上。因此,本研究选取化学仿制药1类声明件数排前5位的品种进行剖析,为仿制药企的品种筛选提供参考和借鉴。
(1)他达拉非片。他达拉非片是治疗男性勃起功能障碍的药物。据米内网数据统计的中国样本医院(包括城市公立、城市社区、县级公立、乡镇卫生医疗机构)年度销售数据显示:2019年至2021年他达拉非片的年度销售额依次为13 454万、10 239万、13 135万元;据中国城市实体药店年度销售数据显示,2019年至2021年他达拉非片的年度销售额依次为67 928万、76 711万、94 226万元;2022年他达拉非片在中国的销售额约为12.17亿元,跃居2022第一季度中国城市实体药店终端化学药前20位产品的第14位。
截至2023年6月30日,药品上市许可持有人美纳里尼(中国)投资有限公司在中国获批上市美国礼来制药有限公司生产的他达拉非片的规格有2.5、5、10、20 mg(H20170284、H20170285、H20170283、H20170286、国药准字H20170021、国药准字H20170022)。24家仿制药企对他达拉非片(规格为2.5、5、10、20 mg)提出了41件1类仿制药专利声明(截至2023年3月31日),其中已有4家企业获批,分别为海南卓力制药有限公司(国药准字H20233199,规格20 mg)、河南羚锐制药股份有限公司(国药准字H20233764,规格20 mg)、江苏联环药业股份有限公司(国药准字H20233231,规格20 mg)和上海汇伦江苏药业有限公司(国药准字H20233235、国药准字H20233240,规格为20、5 mg)。
(2)玻璃酸钠滴眼液。玻璃酸钠滴眼液是一种人工泪液,主要用于治疗干眼症以及角结膜上皮损伤修复等。米内网数据显示,玻璃酸钠滴眼液2022年在中国公立医疗机构的终端销售额超过7亿元。
截至2023年7月9日,药品上市许可持有人日本参天制药株式会社在中国获批上市玻璃酸钠滴眼液的规格有0.1%(10 mL∶10 mg)、5 mL∶15 mg(0.3%)、0.3%(0.4 mL∶1.2 mg)、0.1%(0.4 mL∶0.4 mg)(国药准字H20150150、国药准字H20171192、国药准字H20130587、国药准字H20130585)。23家仿制药企对玻璃酸钠滴眼液[0.1%(10 mL∶10 mg)、5 mL∶15 mg(0.3%)、0.3%(0.4 mL∶1.2 mg)、0.1%(0.4 mL∶0.4 mg)]提出了31件1类仿制药专利声明(截至2023年3月31日),目前还未见获批。
(3)磷酸奥司他韦胶囊。磷酸奥司他韦胶囊是神经氨酸酶抑制剂,只对甲型和乙型流感起预防和治疗两方面的作用。药融云数据库显示,磷酸奥司他韦胶囊2022年的国内销售额为8.6亿元,约占奥司他韦市场总额的38%。东阳光药业发布的2022年年报显示,磷酸奥司他韦胶囊2021、2022年的销售额分别为0.85亿、5.07亿元。
截至2023年7月10日,药品上市许可持有人上海罗氏制药有限公司在中国获批上市磷酸奥司他韦胶囊的规格有30、45、75 mg(国药准字H20140342、国药准字H20140344、国药准字H20140828、国药准字H20140343)。16家仿制药企对磷酸奥司他韦胶囊(规格有30、45、75 mg)提出了20件1类仿制药专利声明(截至2023年3月31日),其中已有4家企业获批,分别为北京双鹭药业股份有限公司(国药准字H20223918、国药准字H20223919,规格为30、75 mg)、重庆圣华曦药业股份有限公司(国药准字H20233404,规格75 mg)和珠海同源药业有限公司(国药准字H20233859,规格75 mg)。
(4)磷酸奥司他韦干混悬剂。磷酸奥司他韦干混悬剂是神经氨酸酶抑制剂,只对甲型和乙型流感起预防和治疗两方面的作用。米内网数据显示,2022年中国三大终端(公立医院终端、零售药店终端和公立基层医疗机构终端)六大市场(城市公立医院市场、县级公立医院市场、实体药店市场、网上药店市场、城区社区卫生中心市场和乡镇卫生院市场)的磷酸奥司他韦干混悬剂销售额合计近40亿元。其中,院内市场(公立医院终端+公立基层医疗机构终端)是主要销售渠道,增长超过160%;在院外市场(零售药店终端,城市实体药店+网上药店)的增速更大,超过200%。
截至2023年8月5日,药品上市许可持有人Hetero Labs Limited在中国获批上市磷酸奥司他韦干混悬剂的规格为0.36 g(国药准字HJ20210075),2家仿制药企对磷酸奥司他韦干混悬剂(规格0.36 g)提出了2件1类仿制药专利声明(截至2023年3月31日),目前还未见获批。
(5)盐酸乌拉地尔注射液。盐酸乌拉地尔注射液是高血压急症的一线治疗药物,在临床中被广泛应用于高血压危象、外科手术降压及预防血压峰值等各种降压治疗。根据医药魔方数据库的销售数据统计结果,盐酸乌拉地尔注射液2022年的市场容量在4 000万支左右,销售额超过12亿元。米内网数据显示,2022年中国公立医疗机构终端的盐酸乌拉地尔注射液销售额超过10亿元。
截至2023年7月11日,药品上市许可持有人武田制药有限公司在中国获批上市盐酸乌拉地尔注射液的规格为5 mL∶25 mg(国药准字HJ20160363)。20家仿制药企对盐酸乌拉地尔注射液(规格5 mL∶25 mg)提出了20件1类仿制药专利声明(截至2023年3月31日),其中已有3家企业获批,分别为石家庄四药有限公司(国药准字H20233626)、锦州奥鸿药业有限责任公司(国药准字H20233175)和江西青峰药业有限公司(国药准字H20233621)。
通过上述分析可知,1类声明件数排前5位的化学类药物品种,其原研药均是在公众健康、医疗市场、临床诊断等方面有不俗表现的主流药物。对公众而言,仿制药能够打破专利垄断,使其享受远远低于原研药的价格。对药品企业而言,专利声明制度以制度协作的方式实现了药品专利权人和仿制药企、社会公众与药品生产制造商、药品可及性与知识产权垄断权之间的平衡。
3 讨论及建议
本研究对2021年7月9日-2023年3月31日中国上市药品专利信息登记平台登记的1类声明的相关数据进行挖掘和分析,发现涉及3类、4类及5.2类化学药品,3.3类治疗用生物制品和4类中药等。依赖中国上市药品信息登记平台获得的原研药的实际信息资料,切实实现了规避因原研药专利情况不透明可能产生的早期纠纷的大部分设想,但因制度设计存在原生缺陷,还是有些问题无法避免。为了进一步完善我国的药品专利链接制度,笔者提出如下建议。
3.1 完善中国上市药品专利信息登记平台功能
笔者在整理1类声明数据时发现,尽管1类声明制度在规避仿制药品研制早期纠纷方面发挥了显著作用,但仍存在少量未能避免的纠纷:一类情形是部分品种在1类声明后,其原研药又进行了专利信息的登记公示,如前文所述的枸橼酸托法替布缓释片;另一类情形是部分品种在原研药已经作出专利信息登记公示的前提下,还提出了1类声明,如前文所述的氢溴酸伏硫西汀片。这2类情形可能会导致原研药企与仿制药企的后期纠纷,同时反映出当前我国药品专利链接制度尚有缺陷。对此,笔者建议药监部门在中国上市药品专利信息登记平台设立专门通知“登记”及“异议”的板块,即仿制药申请人在其申请被受理后规定的工作日内,不仅应当将其作出的最新专利声明及声明依据通知原研药的药品上市许可持有人,还应当将能够证明其已作出有效通知的相关证明材料登记在该平台上。此外,药监部门可以对已登记的存有异议的专利声明提供可申诉板块,让仿制药申请人提供相应证明和理由[3],供其他同类竞争企业查询。
3.2 建立知情权救济机制
药监部门可建立知情权救济机制,原研药的药品上市许可持有人或专利权人在接到通知后如有异议,应当在规定期限内在中国上市药品专利信息登记平台的相应板块向药监部门提出。因药品上市许可持有人的缘由致使专利权人未获知专利声明相关事宜的,应当根据实际情况减轻或免除仿制药申请人的责任,并对药品上市许可持有人作出相应的行政处罚。
3.3 建立依职权审查机制
药监部门可设置依职权审查机制,包括形式审查和实质审查。形式审查主要针对专利声明的各项格式,如专利号的书写、原研药批准文号的标注等;实质审查主要针对专利声明的准确性,如提出的1类声明所对应的品种在中国上市药品专利信息登记平台上是否登记。并且在追踪审查提出1类声明后原研药再被公示专利信息时,建议对仿制药企提出的1类声明有误的进行警示,对仿制药企故意不提出1类声明或故意提出有误的1类声明的依法处理。
3.4 加强仿制药企在批准等待期的数据跟踪
针对原研药药品上市许可持有人或专利权人持续登记外围专利对抗仿制药上市的情况,一方面建议仿制药企在提出1类声明前,应该进行平台全面检索,确认原研药企没有进行相关的专利信息公示。如除了检索在中国上市药品专利信息登记平台上登记的处方、工艺、用途等类型专利信息外,还应进一步检索其活性成分、剂型、晶体等专利信息。仿制药企在提出1类声明后,应该进行平台跟踪检索,确认原研药企后续没有进行相关的专利信息公示,以进一步规避专利侵权风险,确保仿制药顺利研发上市。
3.5 增设仿制药品种筛选功能
建议中国上市药品专利信息登记平台在自身建设时,可进一步主动增设关于仿制药品种筛选功能,增加市场销售数据收集和分析功能。此外,该平台可进一步跟踪化学仿制药1类声明的发展数据,同时结合国家药品监督管理局等五部委联合颁布的《第三批鼓励仿制药品目录》[4―5],跟踪其原研药企专利信息公示的进展,适时筛选仿制药品种以供参考。
综上,无论原研药是否在国内获批,以药品专利链接制度为依托的中国上市药品信息登记平台均可帮助仿制药企获得原研药的实际信息资料,切实发挥了规避可能产生的早期侵权纠纷的重要作用。我国应完善药品专利链接制度,通过建立知情权救济机制和建立依职权审查机制,完善中国上市药品专利信息登记平台功能,通过加强仿制药企在批准等待期的数据跟踪以及增设仿制药品种筛选功能,从而为仿制药企适时筛选仿制药品种提供参考。
