甲巯咪唑对甲状腺功能亢进症大鼠尿液代谢组学的影响研究Δ
2024-05-14卢旭李玲叶涛彭佑锋何佳馨张宁贵州中医药大学药学院贵阳550025贵州中医药大学第一附属医院药学部贵阳55000贵州中医药大学第一附属医院康复科贵阳55000贵州省大方县中医医院药剂科贵阳55699
卢旭 ,李玲 ,叶涛 ,彭佑锋 ,何佳馨 ,张宁 #(.贵州中医药大学药学院,贵阳 550025;2.贵州中医药大学第一附属医院药学部,贵阳 55000;.贵州中医药大学第一附属医院康复科,贵阳 55000;.贵州省大方县中医医院药剂科,贵阳 55699)
甲状腺功能亢进症(简称“甲亢”)是由多种病因导致的甲状腺功能增强、甲状腺激素分泌过多,以甲状腺肿大、多食易饥、体重减轻以及三碘甲腺原氨酸(triiodothyronine,T3)、四碘甲腺原氨酸(tetraiodothyronine,T4)分泌过多症候群(包括高代谢症候群及心血管、消化、骨骼肌肉系统症状)为主要临床表现,可见胫前黏液水肿、指端粗厚等症状[1]。甲亢是全球内分泌与代谢病领域较常见的疾病之一,仅次于糖尿病,在我国的发病率呈逐年上升趋势,给患者家庭和社会带来沉重负担[2]。
现代临床治疗甲亢主要以服用抗甲状腺药物和手术切除甲状腺为主[3]。甲巯咪唑是我国临床治疗甲亢的一线药物,可通过抑制T4合成的关键酶,即甲状腺过氧化物酶(thyroid peroxidase,TPO),从而减少T4的生成,进而有效减轻患者症状并恢复其甲状腺功能[4],但甲巯咪唑治疗甲亢的分子机制尚不明确。
代谢组学是系统生物学研究的重要方法,可鉴别生物体在特定刺激或某种因素影响下产生的潜在代谢物,并有助于确定代谢物及相关代谢通路的变化情况[5]。尿液可快速反映机体状态,同时对机体的正常生理活动至关重要,加之其检测简单、无创,故已成为临床常规的生物样本,被广泛用于非靶向代谢组学研究。基于此,本研究基于超高效液相色谱-飞行时间质谱(UPLC-TOFMS)技术,对甲巯咪唑干预后的甲亢大鼠进行尿液代谢组学分析,旨在从尿液角度揭示甲巯咪唑治疗甲亢的作用机制。
1 材料
1.1 主要仪器
本研究所用的主要仪器有AcquityTMUPLC仪、Premier LCT XE型TOF-MS仪(美国Waters公司),KDC-160HR型高速冷冻离心机(科大创新股份有限公司),Milli-Q型超纯水系统(美国Millipore公司),BT-3000型电子天平(启东友洺衡器有限公司)等。
1.2 主要药品与试剂
左甲状腺素钠片(批号H20140052,规格50 μg/片),甲巯咪唑片(批号010011428,规格10 mg/片)均购自德国Merck公司;T3检测试剂盒(批号190815)、T4检测试剂盒(批号190706)、促甲状腺激素(thyroid stimulating hormone,TSH)检测试剂盒(批号190302)、游离三碘甲腺原氨酸(free triiodothyronine,FT3)检测试剂盒(批号190518)、游离四碘甲腺原氨酸(free tetraiodothyronine,FT4)检测试剂盒(批号190621)均购自南京建成生物工程研究所有限公司。
1.3 实验动物
本研究所用动物为SPF级雄性SD大鼠,共30只,体重160~180 g,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号为SCXK(湘)2019-0004。大鼠自由摄食饮水,饲养于温度(22±1) ℃、相对湿度50%、每12 h光照/黑暗交替的环境下。本研究方案经江西中洪博元生物技术有限公司实验动物伦理委员会批准后实施(批准号为2021062701)。
2 方法
2.1 甲巯咪唑改善甲亢的药效学考察
2.1.1 动物分组、造模与给药
将30只SD大鼠置于代谢笼中适应性喂养7 d后,按体重均衡原则分为对照组、模型组和甲巯咪唑组,每组10只。模型组和甲巯咪唑组大鼠每天按160 mg/kg(剂量为临床等效剂量)灌胃左甲状腺素钠片混悬液,90 min后甲巯咪唑组大鼠按3.6 mg/kg(剂量为临床等效剂量)灌胃甲巯咪唑片混悬液,对照组大鼠灌胃等体积的生理盐水,每天1次,连续15 d。
2.1.2 大鼠基本情况变化考察
每天观察大鼠的精神状态、毛发色泽、饮食量、大便性状和死亡等情况,并记录其肛温、体重变化。
2.1.3 大鼠血清生化指标检测
末次给药24 h后,各组大鼠腹主动脉取血,离心(3 500 r/min,15 min)得血清,严格按照相关试剂盒说明书操作,检测各组大鼠血清中T3、T4、TSH、FT3、FT4水平。
2.2 大鼠尿液样品的代谢组学分析
2.2.1 尿液样本处理
于给药第15天收集各组大鼠24 h尿液,用于代谢组学分析。尿液样本于4 ℃下离心(12 000 r/min,10 min),取上清液至-80 ℃条件下储存。检测前,将冻融的尿液于4 ℃下离心(13 000 r/min,10 min),将上清液转移至1.5 mL离心管中,然后用0.22 μm微孔滤膜过滤,取滤液进行UPLC-TOF-MS检测。
2.2.2 色谱与质谱条件
以ACQUITY UPLC®BEH C18(2.1 mm×50 mm,1.7 μm)为色谱柱,以乙腈(A)-0.05%甲酸溶液(B)为流动相进行梯度洗脱(0~15 min,2%A→100%A;15~17 min,100%A;17~18 min,100%A→2%A;18~20 min,2%A);流速为0.4 mL/min;柱温为40 ℃;进样量为2 μL。
采用电喷雾离子源(electron spray ionization,ESI)进行正、负离子模式检测,并采用LockSprayTM校正系统进行在线质量校正。脱溶剂气温度和离子源温度分别为350.0、110.0 ℃;脱溶剂气流量为750.0 L/h;毛细管电压分别为1 300.0 V(ESI+)和1 500.0 V(ESI-);锥孔电压分别为60.0 V(ESI+)和70.0 V(ESI-);离子能量电压分别为35.0 V(ESI+)和34.0 V(ESI-)。
2.2.3 数据分析
将UPLC-TOF-MS分析所得数据导入Progenesis QI软件,并在每个分析步骤中可视化原始数据。采用主成分分析(principal component analysis,PCA)和正交偏最小二乘-判别分析(orthogonal partial least squaresdiscriminant analysis,OPLS-DA)对数据进行分析,然后以差异倍数(fold change,FC)≥2、P≤0.05和变量重要性投影(variable importance in projection,VIP)值>1为条件,筛选潜在差异代谢物[6],并采用MetaboAnalyst 5.0软件绘制热图将数据可视化,然后结合人类代谢组学数据库(HMDB,http://www.hmdb.ca/)、京都基因和基因组百科全书(KEGG,https://www.kegg.jp/)等对差异代谢物及其相关代谢通路进行分析。
2.3 统计学方法
实验数据采用SPSS 26.0软件进行分析处理。数据用±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 药效学实验结果
3.1.1 大鼠基本情况变化
造模7 d后,模型组大鼠出现毛色黄暗而不顺、脾气暴躁、便多等症状;与对照组相比,该组大鼠体重显著降低、肛温显著升高(P<0.01),表明造模成功。甲巯咪唑片干预15 d后,与模型组相比,甲巯咪唑组大鼠毛色柔顺、便量减少,脾气暴躁等症状也有所缓解,体重显著升高、肛温显著降低(P<0.01)。结果见表1。
表1 各组大鼠体温和体重变化(±s,n=10)

表1 各组大鼠体温和体重变化(±s,n=10)
a:与对照组比较,P<0.01;b:与模型组比较,P<0.01。
组别对照组模型组甲巯咪唑组体重/g 191.48±8.86 157.51±7.59a 176.03±7.24b肛温/℃35.57±0.45 38.46±0.41a 37.23±0.43b
3.1.2 大鼠血清生化指标检测结果
与对照组相比,模型组大鼠血清中T3、T4、FT3、FT4水平均显著升高,TSH水平显著降低(P<0.01)。与模型组相比,甲巯咪唑组大鼠血清中T3、T4、FT3、FT4水平均显著降低,TSH水平显著升高(P<0.05或P<0.01)。结果见表2。
表2 各组大鼠T3、T4、FT3、FT4和TSH的检测结果(±s,n=10)

表2 各组大鼠T3、T4、FT3、FT4和TSH的检测结果(±s,n=10)
a:与对照组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。
组别对照组模型组甲巯咪唑组T3/(ng/mL)0.62±0.08 0.78±0.09a 0.70±0.08b T4/(ng/mL)8.04±1.16 11.29±1.67a 8.95±1.23c FT3/(ng/mL)1.82±0.16 5.91±0.98a 4.32±0.84c FT4/(ng/mL)18.11±1.51 52.29±8.44a 35.24±6.97c TSH/(mIU/L)1.25±0.13 0.76±0.11a 0.92±0.12b
3.2 尿液代谢组学分析结果
3.2.1 PCA、OPLS-DA结果
PCA结果显示,对照组、模型组和甲巯咪唑组大鼠的PCA散点均能分开,且组内样品均能较好地聚集,说明各组间代谢物有明显差异。进一步OPLS-DA发现,甲巯咪唑组有向对照组回调的趋势,表明甲巯咪唑可改善甲亢大鼠机体异常代谢情况。结果见图1和图2。

图1 正负离子模式下各组大鼠尿液的PCA图

图2 正负离子模式下各组大鼠尿液的OPLS-DA图
3.2.2 差异代谢物的筛选
由图3可知,与对照组相比,模型组大鼠尿液中有22个代谢物表达显著下调,44个代谢物表达显著上调,196个代谢物表达差异无统计学意义;与模型组相比,甲巯咪唑组大鼠尿液中有3个代谢物表达显著下调,23个代谢物表达显著上调,30个代谢物表达差异无统计学意义。进一步分析发现,上述3组样品取交集后,共有5个差异代谢物(见表3)。与对照组相比,模型组大鼠尿液中2-氧代-4-甲硫基丁酸和脱氧胞苷显著下调,癸二酸、利胆酸3-O-葡萄糖醛酸和N6,N6,N6-三甲基-L-赖氨酸表达显著上调(P<0.01);与模型组相比,甲巯咪唑组大鼠尿液中癸二酸、利胆酸3-O-葡萄糖醛酸和N6,N6,N6-三甲基-L-赖氨酸表达均显著下调(P<0.05或P<0.01),2-氧代-4-甲硫基丁酸、脱氧胞苷表达均显著上调(P<0.05或P<0.01),结果见图4、表4。

图3 各组大鼠尿液中代谢物的火山图
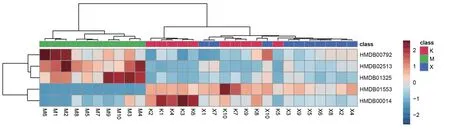
图4 各组大鼠尿液中5个共有差异代谢物的相对强度分析热图
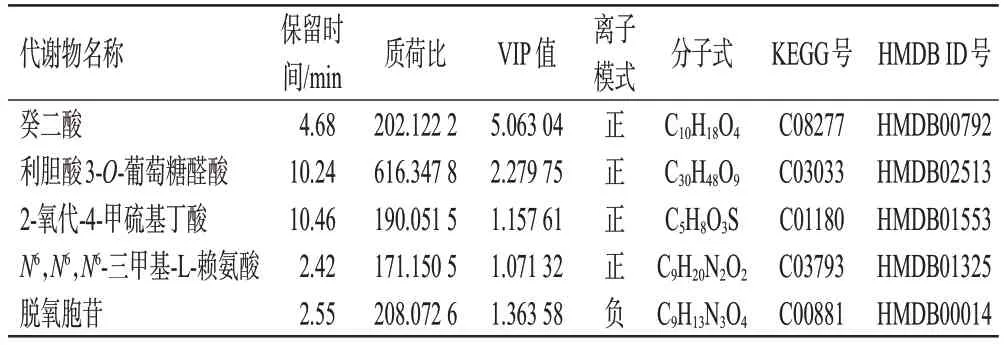
表3 5个共有差异代谢物的具体信息
表4 各组大鼠尿液中5个差异代谢物的表达情况(±s,n=10)
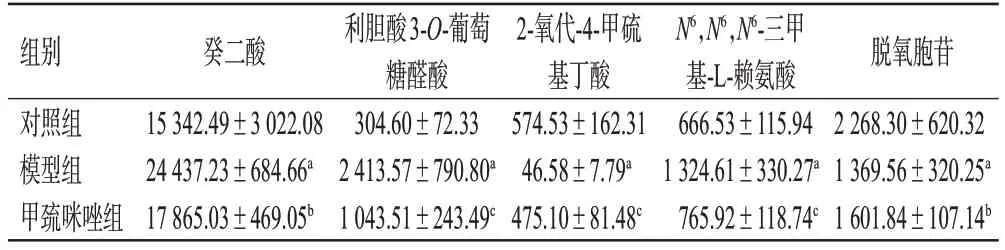
表4 各组大鼠尿液中5个差异代谢物的表达情况(±s,n=10)
a:与对照组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。
组别对照组模型组甲巯咪唑组癸二酸15 342.49±3 022.08 24 437.23±684.66a 17 865.03±469.05b利胆酸3-O-葡萄糖醛酸304.60±72.33 2 413.57±790.80a 1 043.51±243.49c 2-氧代-4-甲硫基丁酸574.53±162.31 46.58±7.79a 475.10±81.48c N6,N6,N6-三甲基-L-赖氨酸666.53±115.94 1 324.61±330.27a 765.92±118.74c脱氧胞苷2 268.30±620.32 1 369.56±320.25a 1 601.84±107.14b
3.2.3 代谢通路的富集分析
5个共有差异代谢物结合HMDB、KEGG数据库分析发现,甲巯咪唑改善甲亢大鼠代谢紊乱主要涉及戊糖和葡萄糖醛酸相互作用、赖氨酸降解、半胱氨酸和甲硫氨酸代谢以及嘧啶代谢这4条代谢通路。结果见表5。

表5 差异代谢物涉及的代谢通路
4 讨论
4.1 甲巯咪唑改善甲亢的药效学变化
左甲状腺素钠片为化学合成的T4精制剂,其吸收稳定、作用时间长,在体内转变成T3而活性增强,具有促进代谢、增加产热和增强交感-肾上腺髓质系统感受性等作用,可很好地模拟甲亢的临床表现[7―8]。因此,本研究采用左甲状腺素钠片建立甲亢模型。本研究结果显示,灌服左甲状腺素钠片后,模型大鼠出现了典型的甲亢表现,且血清中T3、T4、FT3、FT4水平和肛温均显著升高,TSH水平和体重均显著降低,与甲亢的生化指标变化一致。经甲巯咪唑干预后,模型大鼠血清中上述指标均显著逆转,甲亢症状明显改善。
4.2 甲巯咪唑改善甲亢的代谢通路分析
本研究通过UPLC-TOF-MS技术对甲巯咪唑干预后的甲亢大鼠进行尿液代谢组学分析,结果显示,甲巯咪唑对左甲状腺素钠片引起的脱氧胞苷和2-氧代-4-甲硫基丁酸下调,癸二酸、利胆酸3-O-葡萄糖醛酸和N6,N6,N6-三甲基-L-赖氨酸上调,均具有显著的逆转作用,主要代谢通路涉及戊糖和葡萄糖醛酸相互作用、赖氨酸降解、半胱氨酸和甲硫氨酸代谢以及嘧啶代谢。
4.2.1 作用于戊糖和葡萄糖醛酸代谢通路
戊糖和葡萄糖醛酸代谢通路用是糖代谢通路中的一部分,其可参与碳水化合物的代谢和能量产生[9]。研究表明,甲亢患者戊糖和葡萄糖醛酸代谢通路发生了变化,表现为戊糖和葡萄糖醛酸之间的转化速率增加、戊糖的消耗增加、葡萄糖醛酸的产生增加[10―11]。利胆酸3-O-葡萄糖醛酸是由胆汁酸和葡萄糖醛酸结合形成的化合物,可参与戊糖和葡萄糖醛酸之间的相互转化[12]。本研究结果发现,经甲巯咪唑干预后,甲亢大鼠尿液中利胆酸3-O-葡萄糖醛酸水平下调。由此推测,甲巯咪唑可能通过下调利胆酸3-O-葡萄糖醛酸水平,抑制戊糖和葡萄糖醛酸之间的相互转化,从而间接抑制甲亢大鼠糖代谢,进而改善甲亢。
4.2.2 作用于赖氨酸降解通路
赖氨酸是一种人体必需的氨基酸,对蛋白质合成和细胞功能至关重要,其降解后可以产生能量和其他代谢产物,然后在甲状腺激素合成过程中被利用[13―14]。研究表明,甲亢患者可能会出现赖氨酸降解增加的情况,从而导致赖氨酸稳态失衡[15]。N6,N6,N6-三甲基-L-赖氨酸是赖氨酸的一种修饰形式,可调节蛋白质功能和细胞代谢,从而影响赖氨酸降解的速率[16]。在甲亢患者中,甲状腺激素的过度分泌可能会上调N6,N6,N6-三甲基-L-赖氨酸表达,进而影响赖氨酸的降解过程[17]。本研究结果发现,经甲巯咪唑干预后,甲亢大鼠尿液中N6,N6,N6-三甲基-L-赖氨酸下调。由此推测,甲巯咪唑可能通过下调N6,N6,N6-三甲基-L-赖氨酸表达,抑制赖氨酸降解,从而减少甲状腺激素的合成和释放,进而改善甲亢。
4.2.3 作用于半胱氨酸和甲硫氨酸代谢通路
半胱氨酸和甲硫氨酸代谢是维持细胞内半胱氨酸和甲硫氨酸水平的重要途径,甲亢患者过度分泌甲状腺激素也会影响半胱氨酸和甲硫氨酸的代谢[18]。2-氧代-4-甲硫基丁酸是半胱氨酸和甲硫氨酸代谢通路中的中间产物,其可作为甲硫氨酸的前体,参与甲硫氨酸的合成[19]。甲巯咪唑作为抗甲亢药物,主要通过抑制TPO来阻碍甲状腺激素T4和T3的合成,半胱氨酸在甲状腺激素合成过程中参与碘化反应,甲硫氨酸在甲状腺激素合成过程中参与甲基化反应[20—21],这提示甲巯咪唑可能会通过抑制半胱氨酸的碘化和甲硫氨酸的甲基化反应,影响甲状腺激素的合成。本研究也发现,甲巯咪唑可显著上调甲亢大鼠2-氧代-4-甲硫基丁酸的水平,故推测甲巯咪唑可通过抑制TPO来阻碍甲状腺激素的合成,改善甲亢大鼠半胱氨酸和甲硫氨酸代谢,促进甲硫氨酸的合成。这种上下游的衔接使得甲巯咪唑能够有效地改善机体蛋白质合成和其他相关生物过程,进而防治甲亢。
4.2.4 作用于嘧啶代谢通路
嘧啶核苷酸是构成DNA和RNA的重要组成部分,因此嘧啶代谢对于维持细胞功能、传递遗传信息至关重要[22]。甲状腺激素可通过促进嘧啶核苷酸的合成和降解,从而影响嘧啶代谢的平衡[23]。脱氧胞苷是一种嘧啶核苷酸,可通过酶的催化作用转化为脱氧胞苷酸,进而参与DNA的合成和修复过程[24]。研究发现,甲亢患者脱氧胞苷水平下调,这可能是由于甲状腺激素过度分泌导致嘧啶代谢紊乱,进而影响脱氧胞苷的合成和降解[25]。本研究结果发现,经甲巯咪唑干预后,甲亢大鼠尿液中脱氧胞苷水平上调。由此推测,甲巯咪唑可能通过上调脱氧胞苷表达,调节甲亢大鼠嘧啶代谢紊乱,进而改善甲亢。
综上所述,甲巯咪唑可能是通过调节戊糖和葡萄糖醛酸相互作用、赖氨酸降解、半胱氨酸和甲硫氨酸代谢以及嘧啶代谢,从而发挥改善甲亢的作用。
