脑震宁颗粒调节三重脑震荡大鼠线粒体能量代谢的机制研究Δ
2024-05-14高丽赵乐魏楠楠武立雅王恬恬张唯依王永辉山西中医药大学基础医学院山西晋中030619
高丽,赵乐,魏楠楠,武立雅,王恬恬,张唯依,王永辉 (山西中医药大学基础医学院,山西 晋中 030619)
创伤性颅脑损伤是由于机械外力作用于颅脑内容物导致脑组织结构损伤或功能中断,从而引起一系列分子损伤的连锁反应[1―2]。脑震荡属于轻型创伤性颅脑损伤,主要表现为记忆下降、情志异常、认知障碍等症状,多呈现出脑组织挫伤、神经性血管损伤、颅内压升高、血脑屏障破坏等原发或继发性病理特点[3]。目前脑震荡的发病率在逐年增高[4],严重影响患者的日常生活,并给社会带来巨大的经济损失,已经成为一个亟待解决的公共卫生问题。
脑震宁颗粒由生地黄、当归、丹参、丹皮、川芎、地龙、炒酸枣仁、柏子仁、茯苓、陈皮、竹茹11味药组成,共奏活血通络、宁心安神、除烦止呕之功效。有研究表明,脑震宁颗粒对于脑震荡、创伤性综合征、神经血管性疾病等所致的头痛头晕相关症状有很好的疗效[5]。本课题组前期研究发现,脑震宁颗粒可以增加线粒体三磷酸腺苷(adenosine triphosphate,ATP)和呼吸链复合物Ⅰ的含量,改善线粒体结构和功能,从而促进神经元的修复再生[6―7],但其具体的作用机制尚未完全明确。Wnt信号通路可以促进脑组织的神经发生和保护,并与线粒体分布、代谢及相关动力学改变密切相关[8]。因此,本实验以Wnt信号通路为出发点,探究脑震宁颗粒调节三重脑震荡(multiple cerebral concussion,MCC)模型大鼠海马组织线粒体能量代谢的作用机制,以期为脑震宁颗粒的临床应用提供一定的科学依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有:XR-XZ301型旷场及分析系统(上海欣软信息科技有限公司),R540IE型呼吸麻醉机(深圳市瑞沃德生命科技有限公司),UC7型超薄切片机(德国Leica公司),HT7800型透射电子显微镜(日本株式会社日立制作所),Pannoramic MIDI型扫描仪(济南丹吉尔电子有限公司),KZ-Ⅲ-FP型研磨仪(武汉赛维尔生物科技有限公司),A51119600C型酶标仪(瑞士SGS集团),Mini MP4型电泳仪、Mini TBT型转印仪[莫纳(苏州)生物科技有限公司],ImageQuant LAS 500型一体化成像仪(美国GE公司)。
1.2 主要药品与试剂
脑震宁颗粒(批号20200701)购自山西振东安特生物制药有限公司;吡拉西坦片(批号4201008,规格0.4 g)购自东北制药集团沈阳第一制药有限公司;异氟烷(批号20221102)购自深圳市瑞沃德生命科技有限公司;ATP含量检测试剂盒(批号20230329)购自南京建成生物工程研究所;电镜固定液、组织自发荧光淬灭剂、DAPI染色试剂(批号分别为G1102、G1221、G1012)均购自武汉赛维尔生物科技有限公司;BCA蛋白浓度测定试剂盒、辣根过氧化物酶(HRP)标记的羊抗兔IgG抗体(批号分别为18C13B46、BST15D07AE54)均购自武汉博士德生物工程有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶试剂盒(批号BB1207)购自陕西中晖赫彩生物医药科技有限公司;兔源过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator activated receptor gamma coactivator-1α,PGC-1α)单克隆抗体、兔源核呼吸因子1(nuclear respiratory factor-1,NRF-1)单克隆抗体、兔源线粒体转录因子A(mitochondrial transcription factor A,TFAM)单克隆抗体、兔源Wnt-3a多克隆抗体、兔源β-连环蛋白(β-catenin)单克隆抗体、兔源β-肌动蛋白(β-actin)单克隆抗体(批号分别为3523010313、0206040201、5500022039、00084249、4000000136、3500026050)均购自武汉爱博泰克生物科技有限公司;兔源动力蛋白相关蛋白1(dynamin-related protein 1,Drp1)单克隆抗体、兔源线粒体裂变蛋白1(mitochondrial fission protein 1,Fis1)单克隆抗体、兔源线粒体融合蛋白1(mitochondrial fusion 1,Mfn1)单克隆抗体、兔源视神经萎缩蛋白1(optic atrophy protein 1,Opa1)单克隆抗体(批号分别为12957-1-AP、10956-1-AP、13798-1-AP、27733-1-AP)均购自武汉三鹰生物技术有限公司。
1.3 实验动物
SPF级Wistar大鼠,共52只,体重(220±10) g,雌雄各半,由维通利华实验动物技术有限公司提供,动物生产许可证号为SCXK(京)2021-0006。大鼠饲养于山西中医药大学实验动物房,环境温度(22±2) ℃,相对湿度(50±10)%,自由昼夜光照,自由进食、进水。本实验通过山西中医药大学实验动物伦理审查委员会批准,伦理编号为2021DW031。
2 方法
2.1 分组、造模与给药
实验大鼠分为正常组(n=8)和造模组(n=44)。大鼠适应性喂养7 d后,造模组采用“自由落体撞击法”制备MCC大鼠模型,每日撞击1次,连续3 d,撞击部位为大鼠额颞叶部,撞击条件为:高度100 cm,撞击物质量150 g。每次撞击后若符合下列条件则视为造模成功[7]:(1)撞击后动物立刻出现一过性呼吸暂停,但不超过20 s即恢复正常呼吸节律;(2)动物出现短暂的角膜反射、针刺疼痛反应、翻正反射消失,但不超过3 min,恢复后无任何行动障碍。
将造模成功的大鼠采用随机数字表法分为模型组、吡拉西坦组(阳性对照药)和脑震宁颗粒低、中、高剂量组,每组8只。通过人/大鼠体表面积换算后,计算出药物等效剂量(70 kg的人,以每日50 g药物的临床剂量标准为中剂量,1/2中剂量为低剂量,2倍中剂量为高剂量)。各给药组大鼠按吡拉西坦组0.324 g/kg,脑震宁颗粒低、中、高剂量组2.25、4.5、9 g/kg的剂量灌服相应药物。正常组和模型组大鼠灌服等体积生理盐水。所有大鼠每天灌服1次,连续14 d。
2.2 大鼠运动探索能力的评估
采用旷场实验进行评估。给药14 d之后,首先清理实验箱,消除气味的影响,之后将大鼠快速放入实验箱的中央,打开录像系统,记录其在5~10 min内的旷场活动轨迹,计算大鼠的水平运动总路程、中央格进入次数、静止时间、直立次数,评估其运动探索能力。
2.3 大鼠学习记忆能力的评估
采用新物体识别实验进行评估。在给药的最后3 d,每天抚摸大鼠1~2 min。测试时,将A、B两个球形物体放入正方形箱子中,开启录像设备,记录10 min内大鼠与A、B两物体的接触情况,结束后放入饲养笼;1 h之后,将B物体换成立方体形状的C物体,记录2~5 min内大鼠与A、C两物体的接触情况。运用新物体识别指数来评估大鼠的学习记忆能力。新物体识别指数=tC/(tB+tC)×100%,其中tB为探索旧物体B的时间,tC为探索新物体C的时间。
2.4 大鼠海马组织线粒体ATP含量的检测
给药14 d之后,大鼠麻醉后腹主动脉取血,开颅取脑,冰上剥离组织,取100 mg海马组织块,按质量(g)∶体积(mL)=1∶9的比例加入9倍体积的冷双蒸水,匀浆后制成匀浆液,水浴煮沸后离心取上清进行后续操作。按照试剂盒说明书制备相应试剂,采用酶标仪检测吸光度(A)值,并根据以下公式计算组织中的ATP含量:ATP含量(μmol/g prot)=(A测定-A对照)/(A标准-A空白)×c标准×N÷cpr。c标准:标准品浓度,1 000 μmol/L;N:样本测定前稀释倍数;cpr:匀浆蛋白浓度。
2.5 大鼠海马组织线粒体结构的观察
采用透射电镜观察。取“2.4”项下各组大鼠海马组织约1 mm3为检测样本,置于电镜固定液(4 ℃)中。取出海马组织先用0.1 mol/L PBS漂洗3次,每次15 min。之后滴加1%锇酸避光室温固定2 h,再用0.1 mol/L PBS漂洗3次,每次15 min。漂洗结束后将组织以30%、50%、70%、80%、95%、100%、100%的梯度依次进行乙醇脱水,每次20 min,继续用丙酮脱水2次,每次15 min。然后进行渗透包埋和聚合,用超薄切片机切片,再用2%醋酸铀饱和乙醇溶液避光染色8 min,用2.6%枸橼酸铅溶液避CO2染色8 min。等室温干燥后通过透射电镜观察线粒体结构,并采集图像进行分析。
2.6 大鼠海马组织线粒体分裂、融合蛋白表达的检测
采用免疫荧光法检测。取“2.5”项下透射电镜所剩的石蜡切片,每组各取6个样本,脱蜡至水后进行抗原修复,修复完成后,自然冷却。切片置于PBS中洗涤3次,每次5 min。干燥后用组化笔圈出脑组织范围,滴加牛血清白蛋白,封闭30 min。滴加一抗(线粒体分裂蛋白Drp1、Fis1和线粒体融合蛋白Mfn1、Opa1稀释度均为1∶200),4 ℃孵育过夜。切片于PBS中洗涤3次,每次5 min,滴加二抗(稀释度均为1∶300),避光室温孵育50 min。采用DAPI复染细胞核后,加入自发荧光淬灭剂5 min,流水冲洗10 min。室温晾干,抗荧光淬灭封片剂封片。电子显微镜下观察并采集图像,采用Image J软件对其荧光强度进行统计分析,以荧光强度反映蛋白表达水平,荧光强度值越高表明蛋白表达水平越高。
2.7 大鼠海马组织线粒体生物合成和通路蛋白表达的检测
采用Western blot法检测。取“2.4”项下大鼠海马组织,每组各取6个样本,用RIPA裂解液提取蛋白,BCA试剂盒测定组织蛋白浓度,加入5×蛋白上样缓冲液后加热变性,制胶加样进行电泳、转膜,脱脂奶粉封闭2 h,加入TBST稀释的一抗(PGC-1α、NRF-1、TFAM、Wnt-3a、β-catenin的稀释度均为1∶1 000,β-actin的稀释度为1∶30 000),4 ℃孵育12~18 h过夜。次日用TBST洗脱3次,每次10 min,加入稀释后的二抗(稀释度为1∶10 000或1∶5 000),常温孵育60 min。TBST洗脱后,加入ECL发光染液显影,凝胶成像分析仪拍摄图像,采用Image J软件进行灰度值检测和数据分析,以目的蛋白灰度值与内参β-actin灰度值的比值表示目的蛋白的表达水平。
2.8 统计学分析
采用SPSS 27.0软件进行统计分析,计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 脑震宁颗粒对大鼠运动探索能力的影响
与正常组比较,模型组大鼠的运动总路程、中央格进入次数和直立次数均显著降低(P<0.01),静止时间显著升高(P<0.01)。与模型组比较,吡拉西坦组和脑震宁颗粒中、高剂量组大鼠的运动总路程、中央格进入次数和直立次数均显著升高(P<0.05或P<0.01),静止时间显著降低(P<0.01);脑震宁颗粒低剂量组大鼠的运动总路程和直立次数均显著升高(P<0.01),静止时间显著降低(P<0.05)。结果见表1。
表1 各组大鼠运动探索能力相关指标结果比较(±s,n=8)

表1 各组大鼠运动探索能力相关指标结果比较(±s,n=8)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。
组别正常组模型组吡拉西坦组脑震宁颗粒低剂量组脑震宁颗粒中剂量组脑震宁颗粒高剂量组运动总路程/m 86.86±7.91 55.03±10.27a 71.58±7.10b 72.89±8.83c 75.15±8.94c 70.98±7.11b静止时间/s 10.50±5.50 29.44±3.90a 16.00±3.17c 21.25±3.68b 16.13±3.71c 19.00±1.57c中央格进入次数/次4.88±0.64 1.38±0.92a 3.13±0.83c 2.00±0.76 2.50±0.93b 2.88±0.99c直立次数/次18.25±2.50 9.00±1.41a 14.25±1.26c 13.50±1.29c 14.50±1.29c 14.25±2.63c
3.2 脑震宁颗粒对大鼠学习记忆能力的影响
正常组、模型组、吡拉西坦组和脑震宁颗粒低、中、高剂量组大鼠的新物体识别指数分别为(68.67±8.42)%、(42.20±6.00)%、(51.29±10.81)%、(51.89±7.19)%、(55.74±7.63)%、(49.92±8.78)%。与正常组比较,模型组大鼠的新物体识别指数显著降低(P<0.01)。与模型组比较,吡拉西坦组和脑震宁颗粒低、中剂量组大鼠的新物体识别指数显著升高(P<0.05或P<0.01)。
3.3 脑震宁颗粒对大鼠海马组织线粒体ATP含量的影响
正常组、模型组、吡拉西坦组和脑震宁颗粒低、中、高剂量组大鼠海马组织的线粒体ATP含量分别为(4.27±0.30)、(2.54±0.53)、(2.86±0.49)、(3.20±0.57)、(3.58±0.56)、(3.47±0.40) μmol/mg。与正常组比较,模型组大鼠海马组织的线粒体ATP含量显著降低(P<0.01)。与模型组比较,脑震宁颗粒中、高剂量组大鼠海马组织的线粒体ATP含量显著升高(P<0.05);吡拉西坦组和脑震宁颗粒低剂量组大鼠海马组织的线粒体ATP含量升高,但差异无统计学意义(P>0.05)。
3.4 脑震宁颗粒对大鼠海马组织线粒体结构的影响
透射电镜扫描结果(图1)显示,正常组大鼠海马组织神经元细胞膜完整清晰,细胞核的核膜结构清晰,染色质均匀,线粒体数量可、膜完整,粗面内质网未见明显扩张、数量尚可。模型组大鼠海马组织神经元细胞中度水肿,胞内基质稀疏,细胞器大多中度肿胀,以线粒体肿胀为主,线粒体数量丰富,嵴大量断裂、减少,膜内基质局部溶解、变淡,部分线粒体膜内髓样变(图1B红色箭头),粗面内质网局部区域模糊断裂。吡拉西坦组大鼠海马组织细胞膜完整,线粒体中度肿胀(图1C绿色箭头),个别体积变大,嵴断裂、减少,基质溶解或呈空泡样,粗面内质网数量较少,局部区域模糊断裂。脑震宁颗粒低剂量组大鼠海马组织细胞核的核膜结构完整,线粒体肿胀明显、数量尚可、大多膜完整,膜内基质溶解、变淡,部分线粒体膜内髓样变(图1D红色箭头),粗面内质网数量丰富、未见明显扩张。脑震宁颗粒中剂量组大鼠海马组织细胞核的核膜结构清晰,染色质均匀,线粒体轻、中度肿胀(图1E绿色箭头),膜完整,嵴少量断裂、减少,粗面内质网数量较多。脑震宁颗粒高剂量组大鼠海马组织细胞核呈椭圆形,染色质均匀,线粒体中度肿胀,膜完整,嵴大量断裂、减少,膜内基质局部溶解、变淡,粗面内质网局部轻度扩张(图1F蓝色箭头)、数量较多。其中以脑震宁颗粒中剂量组的损伤程度最轻。

图1 各组大鼠海马组织线粒体透射电镜扫描图(×2 500)
3.5 脑震宁颗粒对大鼠海马组织线粒体分裂、融合蛋白表达的影响
与正常组比较,模型组大鼠海马组织Drp1、Fis1的荧光强度均显著升高(P<0.01),Mfn1、Opa1的荧光强度均显著降低(P<0.01)。与模型组比较,各给药组大鼠海马组织Drp1、Fis1的荧光强度均显著降低(P<0.01),Mfn1、Opa1的荧光强度均显著升高(P<0.05或P<0.01)。结果见表2。
表2 各组大鼠海马组织Drp1、Fis1、Mfn1、Opa1的荧光强度结果比较(±s,n=6,AU)
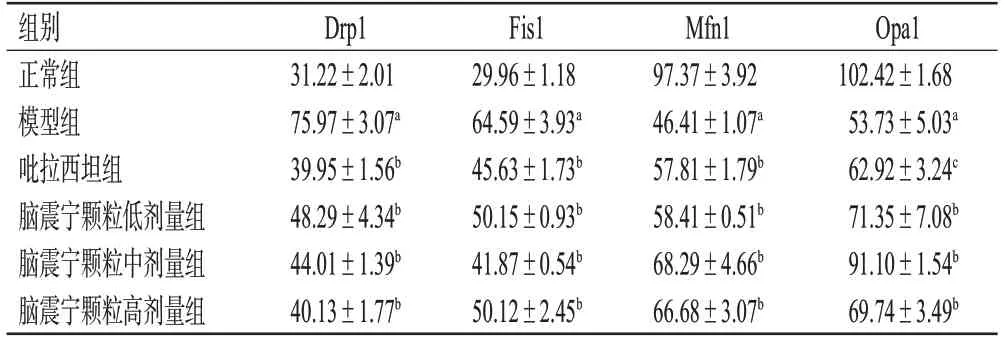
表2 各组大鼠海马组织Drp1、Fis1、Mfn1、Opa1的荧光强度结果比较(±s,n=6,AU)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.01;c:与模型组比较,P<0.05。
Opa1 102.42±1.68 53.73±5.03a 62.92±3.24c 71.35±7.08b 91.10±1.54b 69.74±3.49b组别正常组模型组吡拉西坦组脑震宁颗粒低剂量组脑震宁颗粒中剂量组脑震宁颗粒高剂量组Drp1 31.22±2.01 75.97±3.07a 39.95±1.56b 48.29±4.34b 44.01±1.39b 40.13±1.77b Fis1 29.96±1.18 64.59±3.93a 45.63±1.73b 50.15±0.93b 41.87±0.54b 50.12±2.45b Mfn1 97.37±3.92 46.41±1.07a 57.81±1.79b 58.41±0.51b 68.29±4.66b 66.68±3.07b
3.6 脑震宁颗粒对大鼠海马组织线粒体生物合成和通路蛋白表达的影响
与正常组比较,模型组大鼠海马组织PGC-1α、NRF-1、TFAM、Wnt-3a、β-catenin蛋白表达水平均显著降低(P<0.01)。与模型组比较,吡拉西坦组和脑震宁颗粒低、中剂量组大鼠海马组织PGC-1α、NRF-1、TFAM、Wnt-3a、βcatenin蛋白表达水平均显著升高(P<0.01),脑震宁颗粒高剂量组大鼠海马组织PGC-1α、TFAM、Wnt-3a、β-catenin蛋白表达水平均显著升高(P<0.01)。结果见表3、图2。

图2 各组大鼠海马组织线粒体生物合成和通路蛋白表达的电泳图
表3 各组大鼠海马组织线粒体生物合成和通路蛋白表达水平比较(±s,n=6)
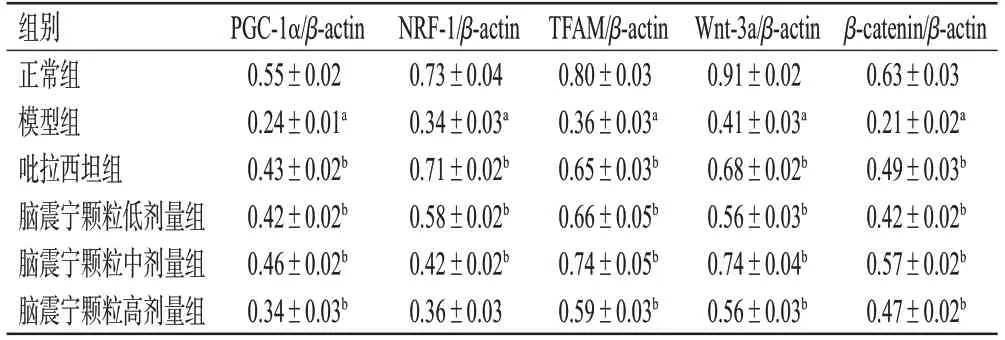
表3 各组大鼠海马组织线粒体生物合成和通路蛋白表达水平比较(±s,n=6)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.01。
组别正常组模型组吡拉西坦组脑震宁颗粒低剂量组脑震宁颗粒中剂量组脑震宁颗粒高剂量组β-catenin/β-actin 0.63±0.03 0.21±0.02a 0.49±0.03b 0.42±0.02b 0.57±0.02b 0.47±0.02b PGC-1α/β-actin 0.55±0.02 0.24±0.01a 0.43±0.02b 0.42±0.02b 0.46±0.02b 0.34±0.03b NRF-1/β-actin 0.73±0.04 0.34±0.03a 0.71±0.02b 0.58±0.02b 0.42±0.02b 0.36±0.03 TFAM/β-actin 0.80±0.03 0.36±0.03a 0.65±0.03b 0.66±0.05b 0.74±0.05b 0.59±0.03b Wnt-3a/β-actin 0.91±0.02 0.41±0.03a 0.68±0.02b 0.56±0.03b 0.74±0.04b 0.56±0.03b
4 讨论
脑震荡属于中医“头痛”“外伤性脑病”范畴,其证初期多实,后期多虚实夹杂。《黄帝内经》记载“若有所坠堕,恶血留内而不去”[9]。机械外力作用于脑络,致气血逆乱、瘀血阻滞、元神失养,日久或痰瘀阻窍,或气血耗损,出现昏胀头晕、记忆模糊等精神障碍。脑震宁颗粒中川芎、当归、地龙、丹参用以除离经之血,行气血,缓头痛;炒酸枣仁、柏子仁以养心安神、宁心定志;生地黄、丹皮清血分之热;生地黄、当归补血分之不足;茯苓、陈皮、竹茹降逆和胃,化神窍之痰。现代药理学研究证明,川芎、炒酸枣仁等药物可以减少细胞凋亡,提高ATP含量,减轻线粒体结构和功能损伤,改善机体症状[10―11]。王学建等[12]通过临床研究表明,脑震宁颗粒可以缓解脑外伤后头痛症状,纠正神经功能紊乱。基于以上药物的神经保护作用,笔者进一步探讨了脑震宁颗粒对MCC模型大鼠线粒体能量代谢的调节机制。
线粒体是一种多功能的半自主性细胞器,它通过三羧酸循环和氧化磷酸化反应还原氧气,维持机体的氧化平衡,合成ATP,释放能量,在参与机体细胞程序性死亡、氧化应激、细胞增殖与代谢等方面发挥着重要作用[13]。颅脑作为机体的生命中枢,与线粒体的关系十分密切。有研究表明,在帕金森病小鼠模型中,小鼠中脑的神经元数量减少,炎性因子表达增加,同时线粒体分裂、融合蛋白失衡[14]。可见,颅脑损伤类疾病多伴随线粒体和神经元的异常,且二者多相互影响。本课题组前期研究表明,脑震宁颗粒可以通过改善线粒体结构和功能,增加ATP含量,对MCC模型大鼠发挥神经保护作用,并提高其学习记忆能力[7],但并未深入探究其核心靶点和机制。在本实验中,模型组大鼠海马组织线粒体ATP含量显著降低,线粒体出现明显肿胀,嵴大量断裂、减少,部分线粒体膜内髓样变,同时大鼠的运动探索能力和学习记忆能力下降。给予脑震宁颗粒干预后,脑震宁颗粒各剂量组大鼠海马组织线粒体ATP含量显著升高,神经元内线粒体结构明显改善,大鼠的运动探索和学习记忆能力有所提高。可见,脑震宁颗粒可以修复神经元线粒体损伤,提高大鼠运动探索和学习记忆能力。
Wnt信号通路是一组由蛋白质Wnt和受体蛋白结合激发,多种蛋白参与,高度保守的信号转导途径[15]。它在胚胎发育、器官发生、组织再生与稳态中起着关键作用[16―17]。有研究表明,缺血再灌注损伤中,Wnt通路的关键分子糖原合成酶激酶3β表达增加,β-catenin被降解,诱导神经元细胞发生凋亡,提示Wnt信号通路对神经元细胞的增殖分化起重要作用;当Wnt信号激活时,Wnt与其受体结合激活蓬乱蛋白Dsh,抑制了糖原合成酶激酶3β,促进β-catenin与下游基因的转录[18]。研究发现,Wnt信号通路通过与线粒体生物合成及融合与分裂的相互作用来影响神经元细胞的正常发育和功能发挥[19]。线粒体生物合成、融合与分裂是线粒体质量控制过程中的重要环节。PGC-1α、NRF-1、TFAM是线粒体生物合成的3个关键蛋白,PGC-1α作为调控系统的中心环节,可以通过诱导NRF-1的转录,增加TFAM的表达,从而促进线粒体生物合成[20]。同时,上调Opa1、下调Drp1可以调控线粒体融合分裂平衡,保护线粒体形态,减少神经元凋亡[21―22]。有研究发现,激活Wnt/β-catenin通路可以促进线粒体生物合成,调节融合分裂平衡[8]。Mori等[23]研究显示,给脂肪细胞孵育Wnt-3a可以促进PGC-1α、TFAM的表达增加;而Godoy等[24]研究发现,在海马神经元细胞中孵育Wnt-5a可以促进线粒体先分裂后融合。以上研究均表明,Wnt信号通路和线粒体生物合成、融合与分裂及神经元关系密切。本实验中,模型组大鼠海马组织PGC-1α、NRF-1、TFAM、Wnt-3a、β-catenin蛋白表达水平均显著降低,线粒体分裂蛋白Drp1、Fis1的荧光强度显著升高,融合蛋白Mfn1、Opa1的荧光强度显著降低。在给予脑震宁颗粒干预后,PGC-1α、NRF-1、TFAM、Wnt-3a、β-catenin蛋白表达水平均有不同程度的上升,同时Drp1、Fis1的荧光强度均显著降低,Mfn1、Opa1的荧光强度均显著升高。可见脑震宁颗粒可以通过激活Wnt/β-catenin信号通路,调控线粒体分裂融合平衡,促进生物合成,从而减少细胞凋亡,保护神经功能,改善脑震荡的相应症状。
综上所述,脑震宁颗粒可以提高MCC模型大鼠的运动探索和学习记忆能力,修复神经元损伤,发挥神经保护作用;其机制可能与激活Wnt/β-catenin信号通路,维持线粒体融合分裂平衡,促进线粒体生物合成相关。后续的研究将进一步探讨Wnt/β-catenin信号通路调节线粒体生物合成的具体方式和相关作用机制。
