杀菌技术和保藏温度对河鲀发酵鱼酱保藏期品质的影响
2024-04-01于俊娟
王 蓓,于俊娟
(江苏旅游职业学院烹饪科技学院,江苏扬州 225000)
河鲀为鲀形目鲀科鲀鱼(Spheroides ocellatus(Osbeck)),在我国主要分布于东海、黄海和渤海等水域,其肉质鲜美、营养丰富,在我国水产养殖中占有一定的地位[1]。河鲀鱼富含蛋白质,经发酵可以分解为更易被人体吸收利用的氨基酸,因此河鲀发酵鱼酱富含多种氨基酸,包括丙氨酸、甲硫氨酸、亮氨酸、谷氨酸、甘氨酸等[2]。此外,在发酵过程中,鱼酱总活菌数逐渐增加,微生物群落组成逐渐丰富[3]。但是,由于河鲀发酵鱼酱的不饱和脂肪酸含量[4]和水分活度较高,其在保藏过程中易发生脂肪氧化酸败,给产品带来不良气味[5]。为了延长河鲀类食品的保藏期,应选用合适的杀菌技术。
在目前的工艺流程中,鱼酱制品可以通过辐照杀菌[6]、等离子体杀菌[7]和高温高压杀菌[8]等技术延长保藏期,但单一技术的处理不能充分保证产品的品质稳定,所以有必要将各项技术有效结合起来,形成复合技术体系来更好地延长产品货架期。
目前,针对杀菌技术对河鲀发酵鱼酱保藏期品质影响的研究较少,本研究使用不同的杀菌技术和保藏温度处理河鲀发酵鱼酱,观察其在保藏过程中氨基酸态氮(AAN)、挥发性盐基氮(TVB-N)、pH、水分活度(Aw)、硫代巴比妥酸(TBA)和菌落总数的变化规律,以期找到更好的延长河鲀发酵鱼酱保藏期的技术体系,为后续河鲀发酵鱼酱的商业化保藏提供理论基础。
1 材料与方法
1.1 材料与仪器
植物乳杆菌L003(Lactobacillus plantarumL003)、木糖葡萄球菌C07(Staphylococcus xylosusC07)、酿酒酵母Y04(Saccharomyces cerevisiaeY04) 均由本实验室保存;河鲀鱼肉、食盐、植物油、香辛料 扬州市邗江区永辉超市;硫代巴比妥酸、乙二胺四乙酸、三氯乙酸、三氯甲烷、H2BO3、MgO、HCl、NaOH分析纯,国药集团化学试剂有限公司;平板计数琼脂(PCA)培养基、MRS 培养基、MSA 培养基、YPD培养基 青岛海博生物技术有限公司;纳他霉素、茶多酚 河南万邦实业有限公司。
HSX 型控温控湿培养箱 上海福玛设备有限公司;SW-CJ-1F 型超净工作台 苏州净化设备有限公司;pHS-3C 型精度pH 计 上海精密科学仪器有限公司;HYG-2 型回转式恒温调速摇瓶柜 上海欣蕊自动化设备有限公司;YXO.SGH280 型高压蒸汽灭菌锅 上海医用核子仪器厂;低温高速冷冻离心机德国Eppendorf 有限公司;HD-3A 型智能水分活度测量仪 无锡华科仪器有限公司;755S 紫外可见分光光度计 上海凌光仪器有限公司;半微量凯氏定氮蒸馏装置 上海晖弘精密玻璃机械有限公司。
1.2 实验方法
1.2.1 样品制备 备选菌株在液体培养基中30 ℃培养12 h,离心(4 ℃,4000 r/min)10 min,去掉上清液,并用适当体积的无菌生理盐水稀释菌体,将菌体浓度调整为107CFU/mL,并按照乳酸菌L003:葡萄球菌C07:酵母菌Y04=1:4:1 的比例接种[9]。
基本配方:河鲀鱼肉200 g、食盐16 g、植物油10 g、香辛料1 g、水100 g。
制备流程[10]:原料肉预处理→绞碎→拌料接种→发酵→调配→蒸制→成品,具体如下:
碎鱼肉的前处理:河鲀碎鱼肉用斩拌机斩断,置于-20 ℃备用。
发酵剂制备:发酵菌采用3 种菌株混合发酵,将植物乳杆菌置于MRS 培养基,木糖葡萄球菌置于MSA 培养基,将酿酒酵母置于YPD 培养基培养,重复两次,将培养液离心(4 ℃,8000 r/min,5 min)取菌体,使用生理盐水将菌体浓度调整为107CFU/mL,置于4 ℃,24 h 内使用。
发酵鱼酱的制备:将碎鱼肉置于玻璃发酵瓶中,加入15%食盐,将发酵剂按照L003:C07:Y04=1:4:1 的比例加入至发酵瓶中,在30 ℃下发酵47 h。
蒸制:将发酵好的鱼酱进行蒸制20 min,即得发酵鱼酱。
分组方法:共分10 组,具体操作见表1,各组于保藏0、15、30、45、60、75、90 d 时,测定其pH、水分活度(Aw)、总酸、氨基酸态氮(AAN)、挥发性盐基氮(TVB-N)、硫代巴比妥酸(TBA)和菌落总数。

表1 河鲀发酵鱼酱的杀菌和保藏方式Table 1 Sterilization and storage methods of fermented puffer fish sauce
1.2.2 pH 测定 按照GB 5009.237-2016[11]的方法测定。
1.2.3 水分活度(Aw)测定 按照GB 5009.238-2016[12]的方法使用全自动水分活度仪测定。
1.2.4 总酸含量分析 参照GB 12456-2021[13]的方法测定。
1.2.5 氨基酸态氮(AAN)含量分析 参照GB 5009.235-2016[14]的方法测定。
1.2.6 挥发性盐基氮(TVB-N)测定 参照GB 5009.228-2016[15],使用半微量凯氏定氮法测定。
1.2.7 硫代巴比妥酸(TBA)测定 按照GB/T 35252-2017[16]直接法测定。
1.2.8 菌落总数测定 按照GB 4789.2-2022[17]的方法测定。
1.3 数据处理
每组实验均进行三次平行测定。利用Excel 2019 对实验数据统计分析,图形采用Origin 2022 进行绘制。
2 结果与分析
2.1 河鲀发酵鱼酱保藏过程中pH 的变化
由图1A 可以看出,在保藏前期和中期,pH 较为恒定,在75 d 后降幅较大,其中真空处理组的降幅最大,而复合处理组的降幅最小。整个保藏过程中各组鱼酱的pH 均在5.50~6.72 之间,有研究发现四种鱼酱的pH 均在6.00~7.00 之间[10],与本研究一致。pH的下降与微生物群落的构成有关,产酸细菌一般可以在较低温度下产酸对产品进行后发酵,而通过产酸也可以抑制其他不耐酸微生物的生长[18],这可能是75 d 后pH 下降明显的原因。由图1B 可以看出,随着保藏时间的延长,各处理组的pH 均呈现下降的趋势,其中15~30 d 内,真空处理组出现了较为明显的降幅,而防腐剂组在45~60 d 出现较大降幅。在保藏期结束时,真空处理组的pH 下降幅度最大,而高压处理组和复合处理组降幅最小,最终pH 均为6.35,说明这两种处理方式对微生物代谢抑制效果更好。
2.2 河鲀发酵鱼酱保藏过程中水分活度的变化
水分活度通常反映食品中水分的可利用程度,水分活度越大表明食品中可利用的水越多,这些水易使食品变质,同时与其口感密切相关[19]。由图2A 可以看出,高压处理组和复合处理组的初始水分活度最高,其他三组初始水分活度则较低,随着保藏时间的延长,各处理组的水分活度均呈现逐步下降的趋势,在保藏前期(0~15 d)各组降幅较大;保藏中后期各组水分活度的变化趋势较为平缓,在保藏结束时,各组的水分活度无明显差异,说明4 ℃保藏条件下各组处理方式对水分活度没有明显影响。由图2B 可以看出,随着保藏时间的延长,各处理组的水分活度呈现逐步下降的趋势,保藏前期降幅较大,15 d 之后下降幅度则较小,保藏结束时,辐照处理组和复合处理组的水分活度较低,分别为0.890 和0.885。水分活度的降低可以有效抑制微生物的生长,已有研究报道了多种食品体系中水分活度对微生物菌落构成的影响[20],辐照组在25 ℃保藏条件下始终保持较低的水分活度,相比其他处理组显现出一定的保藏优势。

图2 河鲀发酵鱼酱保藏过程中水分活度的变化Fig.2 Changes of Aw during storage of fermented puffer fish sauce
2.3 河鲀发酵鱼酱保藏过程中总酸的变化
总酸影响鱼酱制品的香、味和稳定性[21],是其需要检测的重要特征指标[22]。由图3A 可知,除真空处理组外,在4 ℃保藏过程中总酸的变化整体较为平缓,在保藏60 d 后,部分处理组有上升趋势,其中真空处理组、辐照杀菌组和防腐剂处理组的上升趋势较其他组别更为明显,在实验结束时,真空处理组的总酸最高,达到0.15 g/100 g,而复合杀菌组和高压处理组的总酸较小,分别为0.115 g/100 g、0.10 g/100 g。总酸在后期的升高可能由于产品中产酸细菌的增殖所导致,复合杀菌组和高压处理组在4 ℃保藏过程中显示出优势。由图3B 可知,在保藏过程中真空处理组的总酸含量不断增高,其他处理组在前期的总酸含量变化较为平缓,且数值低于真空处理组。在60 d后,除复合处理组外,其他处理组的总酸含量均呈现出明显的上升趋势,在保藏结束时,复合处理组的总酸含量最低,仅0.17 g/100 g,而真空处理组的总酸含量最高,达到0.39 g/100 g。在25 ℃保藏时的总酸度高于4 ℃保藏可能是因为25 ℃保藏条件下氨基酸和有机酸产生更多导致的,与不同保藏温度下微生物代谢活性差异密切相关[23]。综上所述,复合处理组在两种保藏条件下总酸变化均较小,展现出较好的杀菌效果。
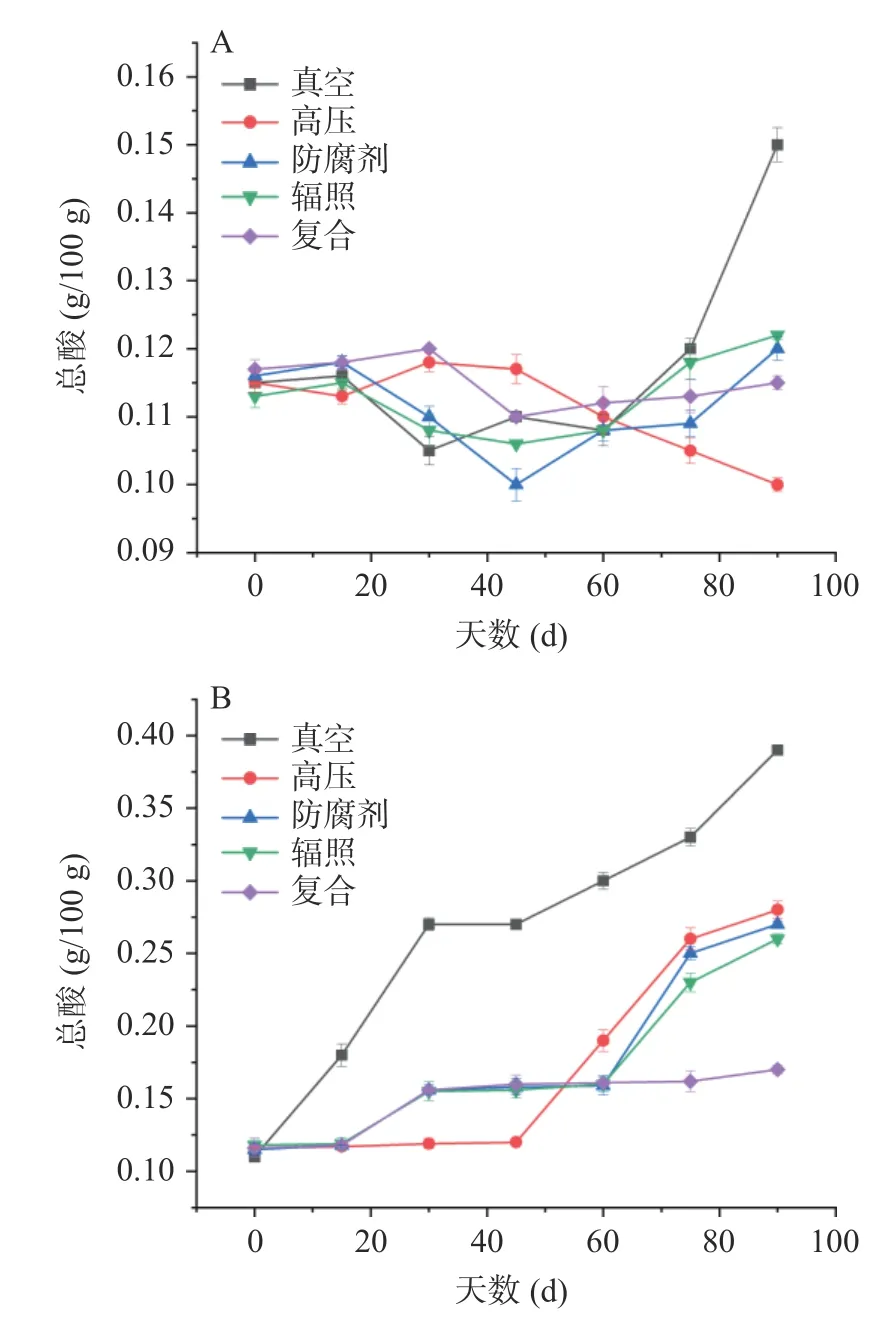
图3 河鲀发酵鱼酱保藏过程中总酸的变化Fig.3 Changes of total acid during storage of fermented puffer fish sauce
2.4 河鲀发酵鱼酱保藏过程中氨基酸态氮的变化
氨基酸态氮指以氨基酸形式存在的氮,一般情况下发酵程度越深,氨基酸态氮的含量越高[24]。由图4A 可以看出,在4 ℃保藏条件下,各处理组氨基酸态氮的含量在保藏期均呈现上升趋势。在保藏期结束后,真空处理组的氨基酸态氮的含量最高,为0.175 g/100 g,高压处理组和复合处理组的含量则最少,分别为0.134 g/100 g、0.132 g/100 g,显示出更好的保藏效果。由图4B 可以看出,在25 ℃的保藏情况下,各处理组的氨基酸态氮呈现逐步上升的趋势,在保藏后期,真空处理组相对于其他几组上升的幅度比较大。在保藏期结束时,真空处理组、辐照处理组和防腐剂处理组的氨基酸态氮含量较高,分别达到0.260 g/100 g、0.210 g/100 g、0.200 g/100 g;而高压灭菌组和复合杀菌处理组的含量较少,仅0.158 g/100 g、0.148 g/100 g,与4 ℃保藏条件下结果一致。另外,保藏期结束时各组氨基酸态氮的含量在0.148 g/100 g~0.26 g/100 g 之间,说明在25 ℃下的氨基酸态氮最高浓度高于4 ℃,保藏期内的氨基酸态氮的波动推测与微生物的生长繁殖、酶活力的变化和美拉德反应等因素有关[25],因此可能是较高的温度提高了微生物的生长繁殖速度和酶的活性所致。值得注意的是,辐照处理组在两种保藏温度下均呈现较高的氨基酸态氮含量,在25 ℃下仅次于真空处理组。蒋慧亮等[26]用不同剂量的电子束处理蚌肉进行冰藏实验,发现经电子束辐照后蚌肉中各类氨基酸的质量分数都出现了不同程度的损失,表明过量的电子束辐照会引起水产品中氨基酸的损失和脂质氧化的加剧,这可能是辐照处理组氨基酸态氮含量较高的原因。
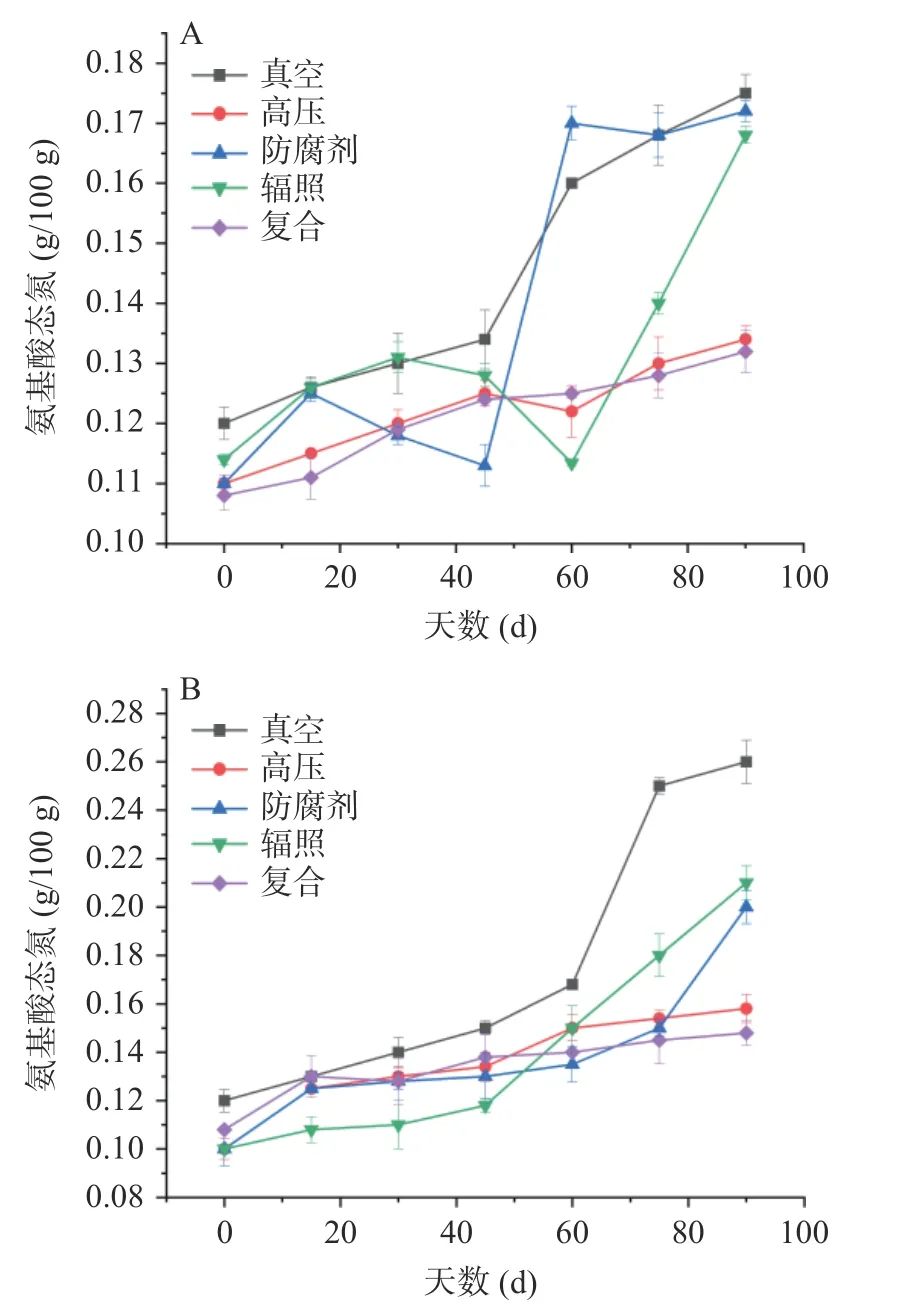
图4 河鲀发酵鱼酱保藏过程中氨基酸态氮的变化Fig.4 Changes of amino acid nitrogen during storage of fermented puffer fish sauce
2.5 河鲀发酵鱼酱保藏过程中TVB-N 的变化
挥发性盐基氮(TVB-N)是动物性食品在储藏过程中由于酶和微生物的作用,导致蛋白质分解产生的氨及胺类物质,是反映动物型产品鲜度的主要指标之一[27]。由图5A 可以看出,在4 ℃保藏前期,60 d 之前各处理组的挥发性盐基氮变化不大,在60 d 后,各组的TVB-N 均大幅度增加,其中防腐剂处理组和真空处理组的上升幅度最大,而复合处理组的上升幅度最小,最终各组的TVB-N 的含量分布在17.03 mg/100 g~26.00 mg/100 g 之间。郑志颖等[10]研究发现4 种不同处理鱼酱的挥发性盐基态氮的含量分别为37.8 mg/100 g、30.1 mg/100 g、23.45 mg/100 g、24.2 mg/100 g,并推测可能是某些细菌利用游离氨基酸等含氮物质产生了挥发性盐基氮物质,因此在4 ℃保藏条件下,高压处理组和复合处理组显示出更好的保藏效果,最终TVB-N 含量仅21.07 mg/100 g、17.03 mg/100 g。由图5B 可以看出,在25 ℃保藏过程中,各处理组在保藏期内均呈现逐步上升趋势,上升幅度较为不同,其中真空处理组在保藏结束时高于其他各处理组,而高压处理组和复合处理组的TVB-N 含量则最少,最终各组的TVB-N 含量分布在23.50 mg/100 g~33.80 mg/100 g 之间。TVB-N 的含量与食品中的内源酶和微生物的生长繁殖有关,根据现行标准规定,水产品及其制品中的TVB-N 含量不应高于30 mg/100 g[28]。结果表明,90 d 保藏期结束后,除真空处理组以外,其余处理组均符合标准要求,但高压处理组和复合处理组的TVB-N 含量均较低,分别为23.50 mg/100 g、26.20 mg/100 g,显示出更好的保藏效果。另外,在25 ℃保藏温度下,各处理组TVBN 的增长速度及最大值均高于4 ℃时,这表明4 ℃条件下微生物的生长受到抑制,代谢活性减弱。戚文元等[29]研究也发现,鲜活宰杀的罗非鱼片初始带菌量和TVB-N 的质量分数较高,经过电子束辐照后罗非鱼片中的微生物质量分数会显著降低。各处理组对河鲀发酵鱼酱中微生物的杀灭效果存在差异,而保藏温度对产品微生物的繁殖进一步产生了重要影响。
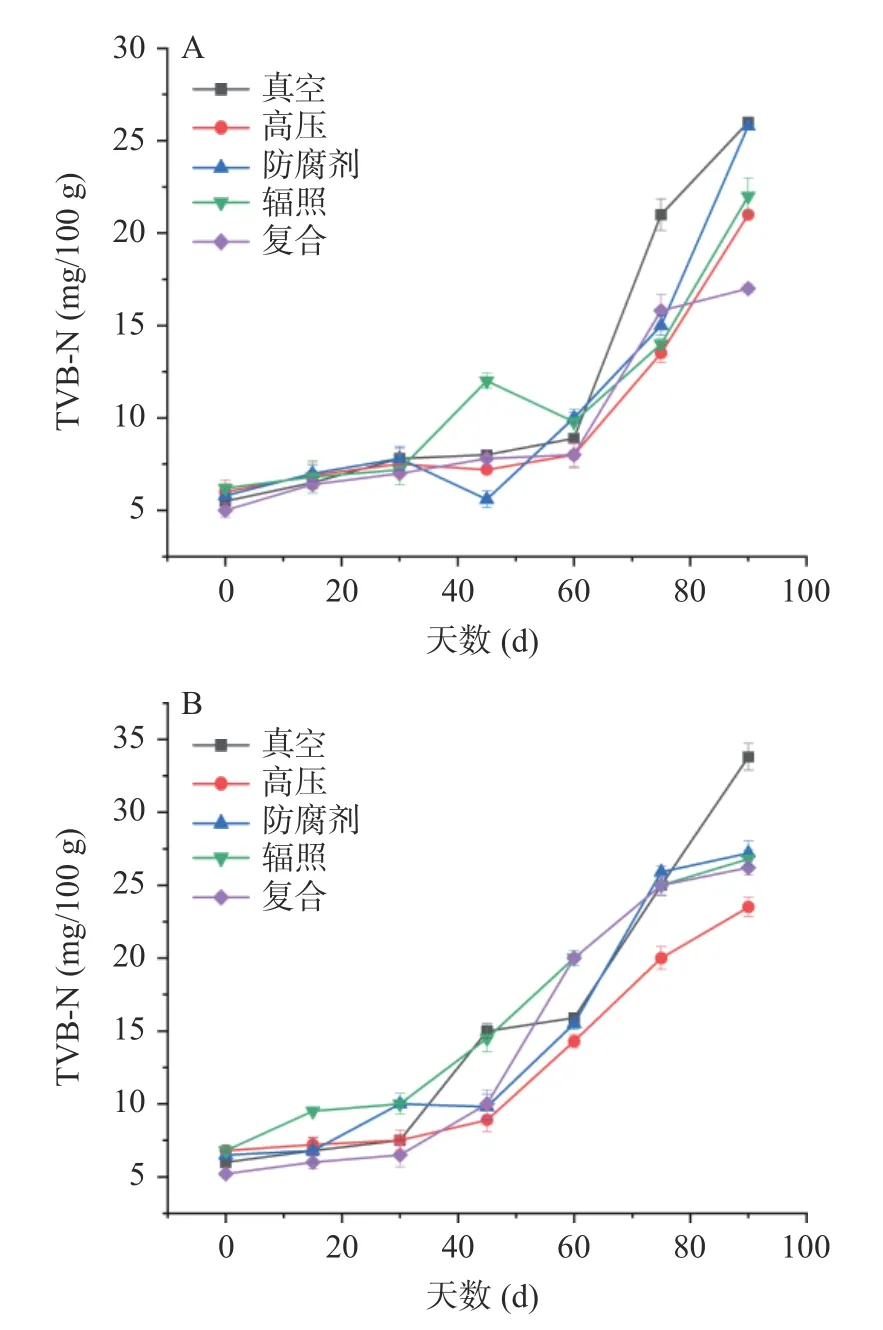
图5 河鲀发酵鱼酱保藏过程中TVB-N 的变化Fig.5 Changes of TVB-N during storage of fermented puffer fish sauce
2.6 河鲀发酵鱼酱保藏过程中TBA 的变化
TBA 是油脂酸败后产生的代谢产物,其含量越高,表明食品中的油脂酸败的越严重[30]。由图6A 可以看出,随着贮藏时间的延长,各处理组的TBA 呈现递升的趋势,高压处理组在60 d 前的上升趋势较为平缓,而在60 d 后出现了较为明显的增幅。实验结束时真空处理组的TBA 最高,达到0.18 mg/100 g;辐照处理组次之,为0.17 mg/100 g;而高压处理组和复合处理组的TBA 最低,均为0.15 mg/100 g。张海燕[31]研究发现鲈鱼片在保藏过程中TBA 值随着保藏时间的延长而升高,与本文研究一致。Sakpetch 等[32]研究发现发酵鱼露发酵过程中过氧化值和硫代巴比妥酸持续下降,可能与微生物的代谢活动密切相关,说明发酵过程中的有益菌有利于不良代谢产物的分解,然而随着发酵期结束,保藏期的延长,油脂酸败代谢产物又再次增加,本研究结果显示高压处理组和复合处理组在保藏过程中体现了优势。由图6B 可以看出,随着保藏时间的延长,各处理组的TBA 呈现平稳上升的趋势,尤其真空处理组与辐照处理组在后期上升的幅度较大,而复合处理组仅在最后15 d 出现较大幅度的上升,最终的TBA 值与高压处理组一致,为0.16 mg/100 g。总体而言,不同保藏温度处理下,TBA 的含量的差异不明显。
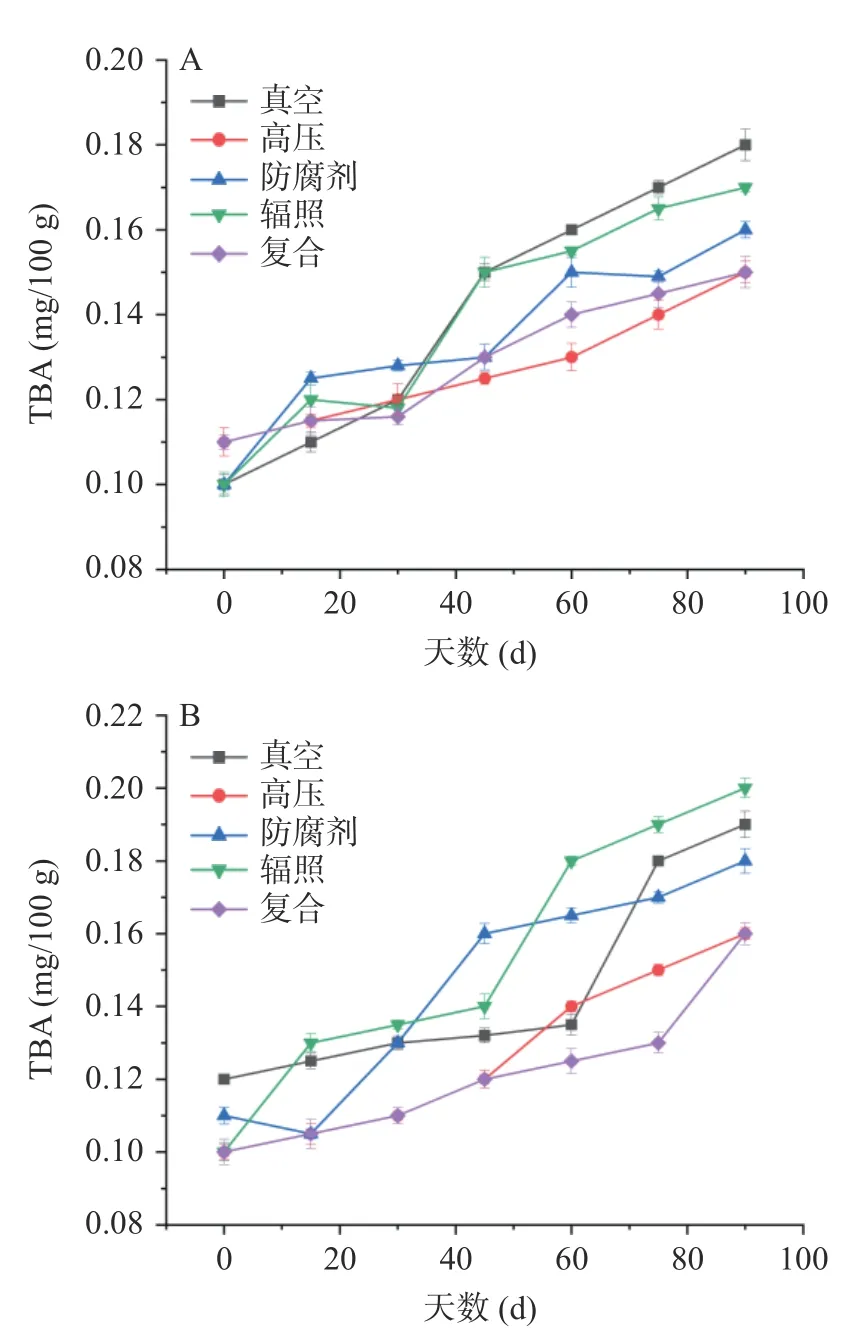
图6 河鲀发酵鱼酱保藏过程中TBA 的变化Fig.6 Changes of TBA during storage of fermented puffer fish sauce
2.7 河鲀发酵鱼酱保藏过程中菌落总数的变化
菌落总数反映出食品被微生物污染的程度,由图7A 可以看出,各处理组的菌落总数均呈现上升趋势,但在中后期迅速增加,其中真空处理组的菌落总数变化最大,90 d 后达到最高,为3.30 lg CFU/g。在整个保藏过程中,高压处理组的菌落总数较低,最终菌落总数为2.70 lg CFU/g,说明该处理方式的保藏效果较优。由图7B 可以看出,各处理组的菌落总数在保藏中期迅速增加,而在保藏后期趋于平缓,高压处理组和复合处理组的菌落总数增长均小于真空处理组、防腐剂处理组以及辐照组,最终为2.80 lg CFU/g 和2.70 lg CFU/g。在不同温度处理下,保藏期结束时的菌落总数接近,但增长速度最快的时间段存在差异,可能是由于微生物在低温下生长较慢导致的。在两种保藏温度下,高压处理组和复合处理组的菌落总数均较低,说明这两种处理方式的杀菌效果较优,在整个保藏期间均表现出更好的保藏效果。
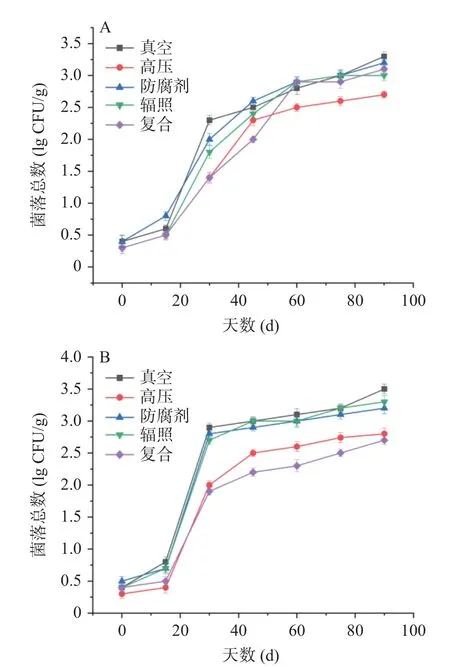
图7 河鲀发酵鱼酱保藏过程中菌落总数的变化Fig.7 Changes of total bacterial count during storage of fermented puffer fish sauce
3 结论
本研究通过观察氨基酸态氮、总酸、TVB-N 等指标探究了不同杀菌技术和保藏温度对河鲀发酵鱼酱保藏期品质的影响。研究表明,在4 ℃保藏温度下,各组氨基酸态氮、总酸、TVB-N 等指标比在25 ℃保藏的同处理组的样品更好,其中复合杀菌组的氨基酸态氮、总酸、TVB-N 分别为0.132 g/100 g、0.115 g/100 g 和17.03 mg/100 g,均低于25 ℃保藏温度下的0.148 g/100 g、0.17 g/100 g 和26.20 mg/100 g,因此河鲀发酵鱼酱在4 ℃保藏优于25 ℃保藏;而在相同温度下,复合处理组指标的综合情况优于其他处理组,其中氨基酸态氮、总酸、TVB-N、pH 和TBA 等指标的变化量均最小;而高压处理也有其特有的优势,在TVB-N、pH、TBA 等指标中,具有与复合处理组相似的结果。此外,许多品质指标会随着时间的推移而产生较为明显的变化,其变化趋势与处理方式密切相关,综合而言,复合杀菌处理和高压灭菌处理对河鲀发酵鱼酱的保藏具有更好的效果。研究为不同保藏条件下河鲀发酵鱼酱保藏期品质的变化提供了具体依据,对河鲀鱼酱的商业化保藏具有实际指导意义。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
