蜡样芽孢杆菌GW-01 全基因组测序及生物学特性分析
2024-04-01蒋杨丹颜佶沙谢宇宣赵思佳何启田赵甲元
刘 珊,蒋杨丹,颜佶沙,谢宇宣,赵思佳,何启田,赵甲元,*
(1.西南土地资源评价与监测教育部重点实验室(四川师范大学),四川成都 610101;2.四川师范大学生命科学学院,四川成都 610101;3.浙江大学生物系统工程与食品工程学院,浙江杭州 310000)
蜡样芽孢杆菌(Bacillus cereus,Bc)为兼性厌氧,产芽孢的革兰氏阳性菌杆菌,在土壤、空气及动物肠道中普遍存在[1],该菌能形成热稳定性孢子,具有很强的环境适应性[2]。蜡样芽孢杆菌与炭疽芽孢杆菌、苏云金芽孢杆菌、细胞毒性芽孢杆菌等细菌的16S rRNA 相似度极高,难以区分[3]。蜡样芽孢杆菌是一种传统的食源性致病菌,通常认为食物中Bc 含量超过105CFU/g 可引起动物和人类的食物中毒,出现腹泻和呕吐等症状[4]。由于蜡样芽孢杆菌次级代谢产物丰富,也是益生菌常用菌种之一[5],常被用作人和畜禽的口服菌剂,具有促进肠道优势菌群的生长[6]、抑制病原菌增殖[7]、减轻术后炎症[8]、缓解肠道炎症反应[9]、增强肠道上皮屏障功能和先天免疫功能[8]。蜡样芽孢杆菌能大量表达蛋白酶与脂肪酶,Shahn等[10]利用益生菌蜡状芽孢杆菌DM423 与植物乳杆菌共发酵香肠,促进了香肠风味物质的形成。蜡样芽孢杆菌还可分泌细菌素、抗菌肽或其他具有抑菌能力的物质来发挥抑菌功能,进而预防肠道微生物感染[11]。本团队前期从健康的雌性绵羊瘤胃中筛选到可降解高效氯氰菊酯(β-CY)的蜡样芽孢杆菌GW-01[12-13],并发现其作为口服菌剂可有效降低小鼠体内β-CY 的积累[14]。然而,其能否应用于人体需要更多的证据。
随着基因组测序技术、生物信息学的不断发展与进步,利用微生物全基因组对Bc 的安全性分析成为可能。传统的实验和鉴定方法很难全面地分析GW-01 生物学特性,也不能充分挖掘其功能基因,为了从基因层面深入了解该菌,本文采用二代Illumina Hiseq 与三代Pacbio 平台相结合的测序技术,对蜡样芽孢杆菌GW-01 进行全基因组测序,利用NR、Swiss-Prot、COG、GO 和KEGG 数据库进行基因功能注释,并预测其毒力因子与抗性基因,为GW-01的安全性分析提供全基因组维度的证据。
1 材料与方法
1.1 材料与仪器
蜡样芽孢杆菌GW-01 从5 岁健康雌性绵羊(中国武威)的瘤胃食糜中分离得到,筛选时表现出对氯氰菊酯有一定的降解作用,现由四川师范大学生命科学学院微生物实验室保存;高效氯氰菊酯 国家标准物质中心;乙腈、甲醇 色谱纯,上海吉至生物科技有限公司;细菌基因组DNA 提取试剂盒 北京天根生化科技有限公司;DNA Marker DL2000,宝日医生物技术(北京)有限公司;6×DNA Loading Buffer北京兰杰柯科技有限公司;荧光染料(Quant-iT PicoGreen dsDNA Assay Kit) 美国赛默飞公司。Agilent 1200 HPLC 高效液相色谱仪 安捷伦生物科技有限公司;NanoDrop 2000 紫外分光光度计美国赛默飞公司;ABI9700 PCR 仪 美国应用生物系统公司;DYY-6C 电泳仪 北京六一生物科技有限公司;Illumina HiSeq X Ten 测序仪 Illumina公司。
1.2 实验方法
1.2.1 菌株GW-01 培养及对β-CY 降解率的测定将甘油保存的GW-01 菌株划线于LB 固体培养基中,培养条件37 ℃、24 h,然后用无菌生理盐水洗下并用紫外分光光度计将细胞浓度调节至OD600nm约0.8 制成种子液。
将GW-01 种子液按5%的接种量接种于含100 μg/mL 的β-CY 的LB 培养基中,分装于30 mL/瓶。同时接种5%无菌生理盐水作为空白对照,37 ℃、135 r/min 条件下培养,测定不同培养时间条件下GW-01 对β-CY 的降解情况。
将30 mL 培养液加入等量的乙腈,超声处理破碎30 min,取10 mL 超声破碎后的培养液于6000 r/min 离心10 min,并用0.45 μm 的有机相滤膜过滤上清液以去除样品中的杂质,用液相色谱检测上清滤液中β-CY 的含量。通过采用配有二极管阵列检测器(DAD)的Agilent1200 高效液相色谱仪,以乙腈-水(85:15,v/v)为流动相,流速为1.0 mL/min,柱温为30 ℃,检测时间为15 min,色谱柱为Eclipse plus C18,紫外检测器波长为220 nm。
式中:A0为高效氯氰菊酯初始浓度(μg/mL);A 为高效氯氰菊酯降解后浓度(μg/mL)。
1.2.2 菌株总DNA 提取 依据细菌基因组DNA 提取试剂盒说明书对菌株GW-01 进行总DNA 提取。首先DNA 的纯净度通过使用NanoDrop 2000 进行检测,OD260/280=1.8~2.0,OD260/230=2.0~2.2;用荧光染料(Quant-iT PicoGreen dsDNA Assay Kit)检测DNA 的浓度,浓度应大于50 ng/μL;最后用核酸电泳法检测DNA 完整度,将5 μL 的基因组样品与1 μL 6×DNA Loading Buffer 吹打混匀后加入到1%的琼脂糖凝胶中进行电泳,观察基因组DNA 有无弥散,以此来检测DNA 是否降解。
1.2.3 菌株GW-01 基因组文库制备及测序 本次测序委托成都迈乐赛生物科技有限公司完成。样本质检合格后,利用Covaris 打断DNA 样品,使其呈现片段化,进行文库构建。采用第二代 Illumina NovaSeq 平台与第三代PacBio 平台相结合的测序技术进行测序。
1.2.4 基因组序列拼接及分析 使用HGAP[15]、CANU[16]软件将Pacbio 获得的下机数据进行拼装以得到contig 序列。使用pilon[17]软件将二代获得的高质量数据和三代contig 序列进行校正,最终进行拼接以得到完整序列,并对拼接最终得到的完整序列进行拼装效果评价。
1.2.5 基因功能分析 通过BLAST 软件(Basic Local Alignment Search Tool)与 Gene Ontology(GO)[18]、Cluster of Orthologous Groups of Proteins(COG)[19],Kyoto Encyclopedia of Genes and Genomes(KEGG)[20]通路分析工具、Non-Redundant Protein Database(NR)[21]非冗余蛋白数据库,Carbohydrate-Active EnZymes Database(CAZy)[22]碳水化合物活性酶、Swiss-Prot[23]蛋白质序列功能信息数据库、毒力因子数据库(VFDB)[24]和综合抗生素抗性基因数据库(CARD)[25],进行对比分析,使用Diamond 软件对致病系统进行比对分析,获得相应的注释结果。
1.2.6 菌株GW-01 的进化和比较基因组学分析根据菌株GW-01 全基因组注释信息,选择gyrA基因序列及NCBI 数据库比对分析结果,利用MEGA 11.0 软件的Neighbor-Joining 法构建系统发育树。
1.3 数据处理
GW-01 菌株对β-CY 降解率测定用Origin 2021软件进行数据分析,所得数据为均值±标准差(±SD)。
2 结果与分析
2.1 菌株GW-01 对β-CY 降解率的测定
由图1 所示,蜡样芽孢杆菌GW-01 能降解100 μg/mL 的β-CY,并且随着培养时间的增加,菌株GW-01 对β-CY 的降解率逐渐增加,在第6 d 达到最大降解率48.4%。

图1 GW-01 在不同时间内对β-CY 的降解率Fig.1 Degradation rate of β-CY by GW-01 at different times
2.2 菌株GW-01 全基因组概况
采用第二代Illumina NovaSeq 测序平台与第三代PacBio 测序平台相结合,对菌株GW-01 进行全基因组测序。如图2 所示,GW-01 菌株全基因组大小为5244145 bp,基因组类型为环状,GC 的平均含量为36.43%,编码的基因为5314 个,含有104 个tRNA 基因,313 个ncRNA。
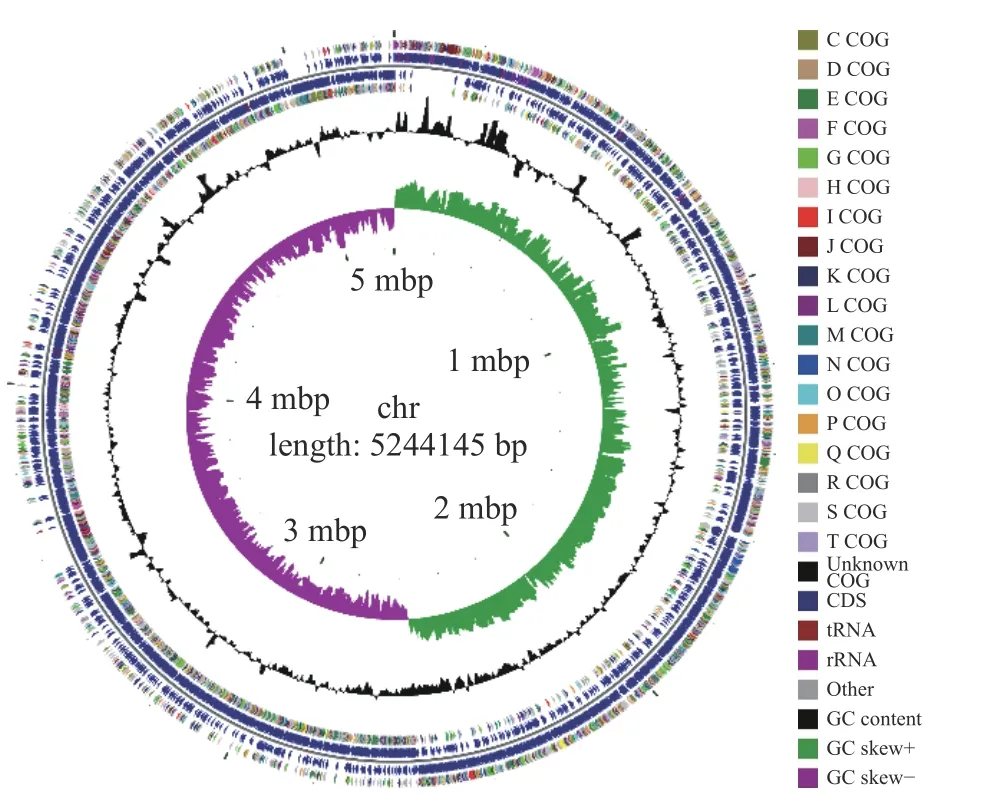
图2 蜡样芽孢杆菌GW-01 基因组圈图Fig.2 Genomic circle diagram of Bacillus cereus GW-01
2.3 菌株GW-01 的进化和比较基因组学分析
芽孢杆菌属内的种间亲缘关系较近,不能采用16S rRNA 基因来分析芽孢杆菌属物种间的进化关系,因此保守蛋白编码基因在系统发育分析时具有更高的分辨率[26],其中gyrA是常用于芽孢杆菌鉴定的保守蛋白编码基因,可以用于区分杆菌种间的差异[27-28]。将菌株GW-01 与五株蜡样芽孢杆菌来源的gyrA 蛋白序列构建进化树如图3 所示,菌株GW-01 与CC-1 和M3 聚在一起,表明GW-01 与这两株菌在进化时尚存在密切的关系。推测GW-01可能出现在CC-1 之前,M3 之后。
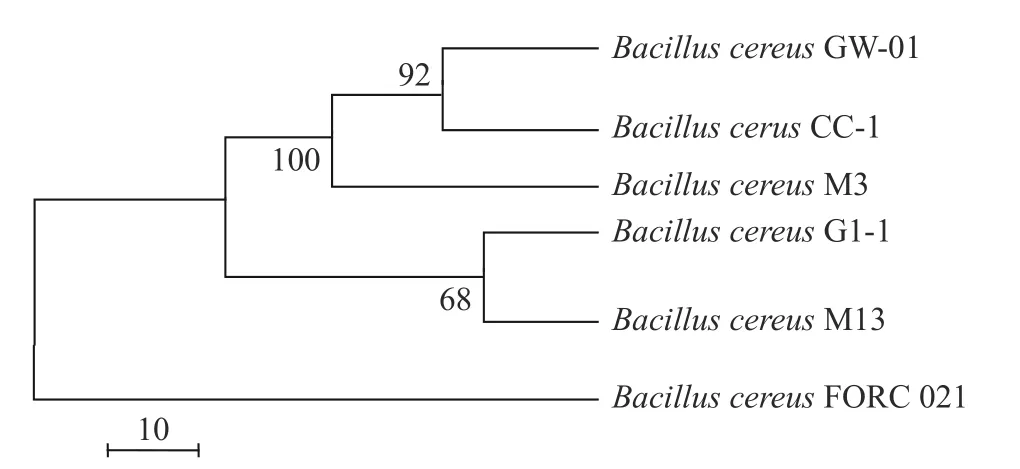
图3 基于GW-01 及近缘种gyrA 蛋白氨基酸序列构建进化树Fig.3 Phylogenetic tree reconstructed based on gyrA protein sequence of GW-01 and its related bacterial species
选取与菌株GW-01 亲缘关系非常相近的四株蜡样芽孢杆菌CC-1、M3、G1-1、M13 进行分析,并从NCBI 上下载这四株Bc 的基因组概况如表1 所示,GW-01 与CC-1 基因组大小和tRNA 数最为接近,GW-01 的GC 含量比例高于其他菌株,编码蛋白数与M3 最为接近。蜡样芽孢杆菌GW-01 与其他四株菌独有基因和共有基因如图4 所示,共有的基因有630 个,GW-01、CC-1、M3、M13 和G1-1 独有的基因分别为554、627、954、409 和598。

表1 蜡样芽孢杆菌GW-01 全基因组特征及其与其他近缘芽孢杆菌比较Table 1 Genome characteristics of Bacillus cereus GW-01 and comparison with other Bacillus relatives
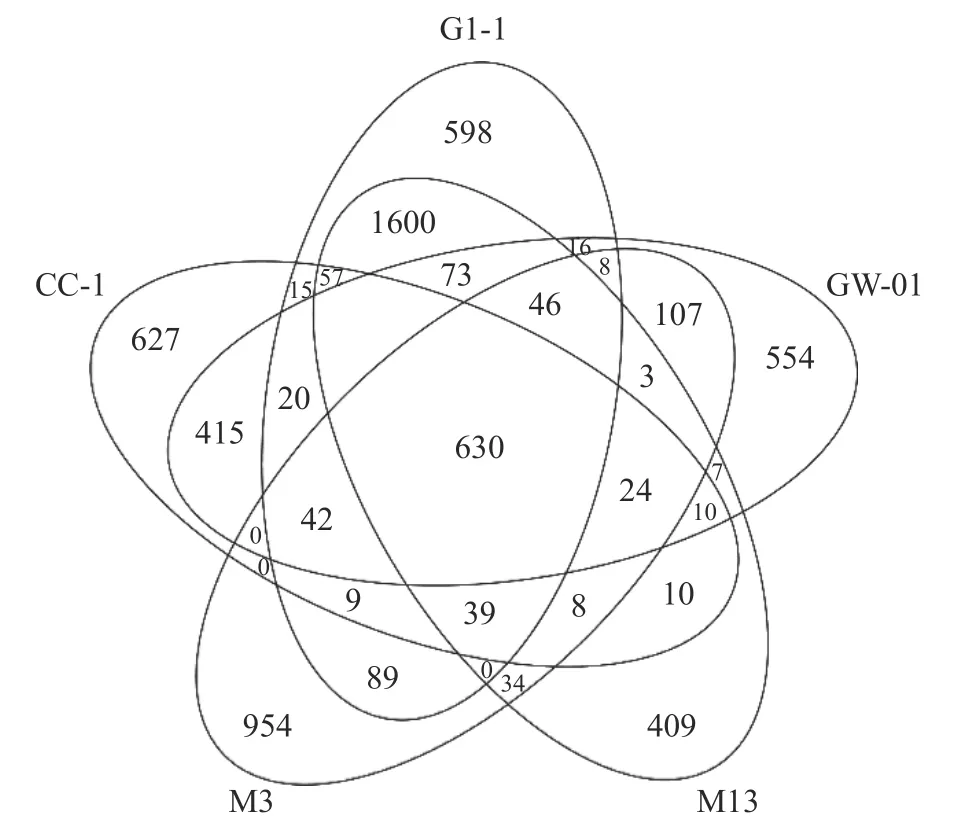
图4 五株蜡样芽孢杆菌菌株独有基因和共有基因的韦恩图Fig.4 Venn diagram of unique and shared genes of five kinds of Bacillus cereus strains
2.4 基因组的功能注释
将预测基因的蛋白序列与GO、KEGG、NR、CAZy、CARD、VFDB 和Swiss-Prot 各功能数据库进行比对分析(Evalue≤1e-5),选取蛋白质序列匹配程度高即Score 最高的比对结果(默认Identity≥40%,Coverage≥40%)进行注释。最终发现菌株GW-01 基因组共有5314 个基因比对成功得到注释,其中在GO、KEGG、NR、COG 和Swiss-Prot 中得到功能注释的基因较多,分别为3536、4714、5290、4434 和3854 个,占基因总数的66.60%、38.72%、99.62%、83.50%、72.58%
2.4.1 GO 注释结果 将菌株GW-01 蛋白序列与GO(Gene Ontology)数据库进行比对,统计分析发现,被注释的基因共有3536。如表2 所示,GO 数据库按照生物过程(Biological Process,BP)、细胞组分(Cellular Component,CC)和分子功能(Molecular Function,MF)对蛋白进行注释,共计80 条目,每组分别包括42、13 和25 个。在BP 中注释的基因数为9320,涉及最多基因的条目包括生物过程(Biological_process)、细胞氮化合物代谢过程(Cellular nitrogen compound metabolic process)和生物合成过程(Biosynthetic process),分别有3321、1103 和1060 个;CC 中,注释基因数为3930,其中与细胞(Cell)、细胞组分(Cellular_component)、细胞内部分(Intracellular)、细胞质(Cytoplasm)相关的基因表现出最高相关性,各有1067、1023、698、491 个;MF 大类中注释的基因数为7116,其中涉及最多基因的条目为分子功能(Molecular_function)、离子结合(Ion binding)、DNA 结合(DNA binding)和氧化还原酶活性(Oxidoreductase activity),其数量分别为3166、1007、474 和455。

表2 菌株Bacillus cereus GW-01 GO 功能分类Table 2 GO functional classification of Bacillus cereus GW-01
2.4.2 COG 注释结果 对菌株GW-01 基因组中编码功能性蛋白的基因进行COG 注释,发现被注释到具有生物学活性的蛋白编码基因共4434 个。如图5所示,基因功能注释信息分为25 类,分别有0、0、213、35、342、112、246、123、104、196、368、176、253、30、110、273、62、0、1448、185、32、116、10、0、0 个基因注释分类到A~Z。较丰富的几个类别依次是转录(Transcription)共368 个基因,占注释基因总数的6.93%;氨基酸代谢及转运(Amino Acid Transport and Metabolism)共342 个基因,占注释基因总数的6.44%;而关于无机离子转运与代谢(273 个基因,5.14%)、碳水化合物运输和代谢(246 个基因,4.63%)、蛋白质翻译、核糖体结构和生物合成(196 个基因,3.69%)的基因也得到较多的注释。此外,还有1448 个基因(27.25%)尚未确定功能,这些基因可能赋予菌株某些特殊的生物学功能,有待今后进一步的研究。
2.4.3 KEGG 注释结果 将菌株GW-01 所获得的基因组信息与KEGG 数据库进行比对并分析,如图6所示,4714 个基因对应到KEGG 通路,富集在48 条代谢通路中。KEGG 富集分析显示,信号和细胞过程(Signaling and cellular processes)、遗传信息处理(Genetic information processing)、碳水化合物代谢(Carbohydrate metabolism)是最主要的3 种代谢通路,分别有668、616 和433 个基因注释结果;此外,氨 基 酸 代 谢( Amino acid metabolism) 、 代 谢(Metabolism)、能量代谢(Energy metabolism)、辅助因子和维生素的代谢(Metabolism of cofactors and vitamins)、信号转导(Signal transduction)通路与GW-01 菌株基因组相比,具有较高相关度。
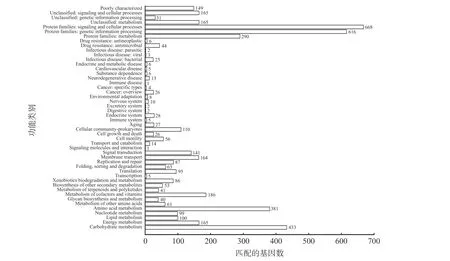
图6 菌株 Bacillus cereus GW-01 基因组KEGG 功能分类Fig.6 KEGG functional classification of Bacillus cereus GW-01
2.4.4 CAZy 功能分析 CAZy(Carbohydrate-Active enZYmes Database)即专门用于研究和分类碳水化合物活性酶的数据库。该数据库提供了广泛的酶家族和分类,包含了与糖苷键降解、修饰及生成等相关的酶类家族。主要包含5 大分类:糖苷水解酶(Glycoside Hydrolases,GHs)、糖基转移酶(Glycosyl Transferases,GTs)、多糖裂解酶(Polysaccharide Lyases,PLs)、碳水化合物酯酶(Carbohydrate Esterases,CEs)、辅助活性酶(Auxiliary Activities,AAs)。在碳水化合物的降解、合成修饰过程中发挥重要的作用。此外,CAZy 还包含了与碳水化合物结合相关的酶(Carbohydrate-Binding Modules,CBMs)。
将菌株GW-01 基因组序列通过CAZy 数据库进行比对功能注释,如图7 所示,发现其蛋白质结构域属于CAZy 家族的编码基因共有135 个,包括糖苷水解酶(GHs)家族的蛋白34 个、碳水化合物酯酶(CEs)38 个、11 类糖苷转移酶家族的蛋白(GTs)43 个、多糖裂解酶(PLs)0 个、辅助酶8 个、3 类碳水化合物结合组件(CBMs)12 个。

图7 菌株Bacillus cereus GW-01 基因组CAZy 注释Fig.7 CAZy annotation of Bacillus cereus GW-01
2.5 毒力因子分析
毒力因子是指微生物(如细菌、病毒、真菌等)能够在特定物种的宿主内建立自身并增强其引起毒性或致病性潜力的基因产物,在致病机制中发挥关键作用,使微生物能够侵入宿主、定位到特定组织或细胞,并导致病原性或毒性反应。毒力因素包括细菌毒素、帮助细菌附着宿主的细胞表面蛋白、细胞表面碳水化合物和参与宿主侵入免疫逃逸的蛋白、以及可能有助于细菌在致病机制中发挥关键作用的的水解酶[29-30]。
在蜡样芽胞杆菌中,导致机体发生食物中毒的原因主要是该菌会产生肠毒素,包括引起腹泻症状的溶血型肠毒素Hbl(hemolysin BL)、非溶血型肠毒素Nhe(nonhemolytic enterotoxin)、细胞毒素CytK(cytotoxin)、肠毒素FM(entFM)及一些特殊蛋白酶,引起呕吐的呕吐毒素ces(cereulide)[31-32],其中,毒力最强的是引起呕吐的毒素基因ces。对于不同肠致病性蜡样芽孢杆菌,其携带的毒力基因数目、毒力基因表达情况各不相同,因此各菌株对宿主的致病性也不尽相同[33]。
将菌株 GW-01 和四株近缘菌株的基因组与VFDB 数据库进行比对分析,毒力因子相 关基因数预测如表3、表4 所示,与其他四株菌相比,菌株GW-01 毒力因子相关基因数占整体基因比率最低,仅占 0.49%,在典型肠毒素基因鉴定中菌株 GW-01中只检出了Nhe(A、B和C)。研究表明肠毒素基因或某种毒素基因谱的存在并不一定证实蜡样芽孢杆菌菌株具有毒性活性[34]。

表3 蜡样芽孢杆菌GW-01 及其与其他近缘芽孢杆菌毒力因子Table 3 Bacillus cereus GW-01 and other closely related Bacillus virulence factors
表4 蜡样芽孢杆菌GW-01 及其与其他近缘芽孢杆菌毒力基因型Table 4 Bacillus cereus GW-01 and other closely related Bacillus virulence genotypes
2.6 抗性基因分析
在遗传、环境等选择压力的情况下蜡样芽胞杆菌会发生基因突变。滥用抗生素或长时间暴露于抗生素下,蜡样芽胞杆菌对药物的敏感性会逐渐降低,从而加速细菌耐药性的发展使菌株产生耐药性[35]。
将菌株GW-01 和其他四株菌通过CARD 数据库进行注释,结果如表5 所示,与其他四株近缘菌相比,菌株GW-01 与耐药相关的基因最少共96 个,仅占0.18%。可能的耐受药物有林可霉素、利福平、达托霉素、止夫西地酸、磷霉素、青霉素、磺胺、氟喹诺酮、四环素、杆菌肽、大环内酯、链霉素共12 种。目前认为,靶基因突变在细菌对抗生素耐药中起重要作用,通过对靶基因的调控表达可能改变菌株抗性,在菌株GW-01 中有24 个抗生素靶基因,可能成为改变菌株抗生素抗性的突破点。

表5 蜡样芽孢杆菌GW-01 及其与其他近缘芽孢杆菌抗生素抗性分析Table 5 Antibiotic resistance analysis of Bacillus cereus GW-01 and other closely related Bacillus
3 讨论
食源性微生物的安全问题引起越来越多关注。Bc 是常见的食源性致病菌,广泛存在于发酵食品、土壤、空气、水、植物和畜禽瘤胃肠道[3,36-37]。食品尤其是高淀粉食品在生产、运输、销售和储存等环节均会被该菌污染。作为食源性致病菌,Bc 引发食物中毒占全球食物中毒的1.4%~12%[38];在中国,2003年至2017 年期间发生的13307 起食源性疾病中,由Bc 引起的占3.0%[39]。以Bc 为主体的微生态制剂如“口服蜡样芽孢杆菌活菌片”、“蜡样芽胞杆菌片”等益生菌产品在医疗保健、农业和养殖业等各行各业有着极其广阔的应用[3,36-37]。目前,Bc 口服菌剂在市场上大量销售,用于治疗肠炎、腹泻和肠功能紊乱,作为人类和牲畜益生菌使用[40]。然而,几乎所有Bc 菌株都含有毒素编码基因,约85%~100%含有Nhe,约40%~70%分别含有Hbl和cytK[34],因此,很难解释Bc 具有益生性的原因。
近年来,许多科学家致力于Bc 致病或益生性的研究。Bc 安全性分析主要集中于动物实验和基因组分析。动物实验方面,多采用小鼠[14,36]、刺参[41]、彭泽鲫[42]和银鲫[43]等动物研究Bc 的益生特性。本课题组前期从健康雌性绵羊瘤胃中筛选到可降解β-CY 的蜡样芽孢杆菌GW-01,从宿主来源看该菌株无致病性,并通过实验表明口服Bc 菌株GW-01 能有效降低小鼠体内β-CY 的积累并促进小鼠体重增加[13]。为了深入研究该菌,本研究利用全基因组测序和生物信息学分析技术得到了菌株GW-01 的基因组序列,确定菌株基因组大小为5244145 bp,共编码5314 个基因,同时将基因组数据与GO、COG、KEGG、NR 等数据库进行比对分析,完成菌株GW-01 基因组功能注释及数据统计工作,并基于gyrA基因构建系统发育进化树,确定了GW-01 菌株与蜡样芽孢杆菌CC-1、蜡样芽孢杆菌M3、蜡样芽孢杆菌G1-1、蜡样芽孢杆菌M13 的近缘关系。
CAZy 家族主要参与糖苷键降解、修饰及生成的酶类,在宿主微生物的适应性和致病性方面发挥重要作用[44-45]。对于具有致病性的菌株,其体内糖苷水解酶可对宿主细胞的多糖进行水解,从而获得自身所需营养或影响糖类在宿主中发挥作用[46-47]。细菌的CAZy 协同作用可将复杂的碳水化合物降解为简单糖类,供给宿主动物吸收利用[48]。在菌株GW-01 基因组中共获得CAZy 家族的编码基因135 个,糖苷水解酶34 个、碳水化合物酯酶38 个、类糖苷转移酶家族的蛋白43 个、辅助酶8 个、碳水化合物结合组件12 个,推测这些酶类家族与菌株GW-01 的益生性相关。
根据蜡样芽孢杆菌引起食物中毒的症状可分为致呕吐型肠毒素和致腹泻型肠毒素,主要毒素包括ces、Hbl 和Nhe 以及CytK。ces 在淀粉和乳制品中检出率较高,常用的食品加工方法很难使ces 失活,人体摄后宿主会出现恶心和呕吐等症状。Nhe 和Hbl是引起腹泻的重要毒素,具有高度的同源性,主要通过溶解结合部位的细胞膜形成孔洞,导致K+外流,进而直接刺激NLRP3 炎症小体,导致宿主的死亡,该毒力因子主要受PlcR、CCPA、ResD和FNR等毒力调节因子的影响[49]。CytK 的毒性作用与Hbl 和Nhe相类似,具有细胞毒性和溶血活性,可使皮肤发生坏死。毒素因子需要不同基因之间相互调控如AbrB、Spo0A、PlcR和CodY调控系统对ces基因簇的转录进行调控[50],CodY的功能是传输和调节ces基因簇所在质粒与细菌染色体间的信号,控制岗体进行营养和能量的代谢,进而影响毒素的合成[51-52]。
大量的研究显示几乎所有的Bc 都能分泌一种或多种毒素,益生性Bc 中毒素的存在情况仍不清楚。采用VFDB 数据库对菌株GW-01 的毒力因子进行预测,菌株GW-01 大部分潜在的毒力因子仅编码菌株正常生长所需的蛋白功能,还有一些可以增强细菌粘附和侵袭的能力,如Hsp60,可提高细菌对宿主细胞的粘附能力。相比于其他四株近缘菌株,在GW-01 中,只检测到与致病性芽孢杆菌相关的毒素基因Nhe,且Nhe存在于约80%~100%的蜡样芽孢杆菌中[34]。蜡样芽孢杆菌毒性基因在表达上沉默或只有在特定情况下才能表达,Cui 等[53]认为蜡样芽孢杆菌益生菌菌株的毒性基因在转录上是沉默,不会产生活性毒素,Tsilia 等[54]利用蜡状芽孢杆菌NVH 0500/00 在胃肠道模拟过程中,发现其可以粘附黏蛋白,但不能产生肠毒素。plcR是芽孢杆菌细胞外毒力因子的多效性调节因子,同时调控HBL和Nhe的转录,plcR基因的转录发生在稳定期,而在孢子形成期可被孢子形成因子Spo0A抑制[9]。GW-01 菌株的Nhe基因由于菌株的调控系统影响其毒素基因的表达,推测菌株GW-01 较其他蜡样芽孢杆菌安全性较高。
4 结论
本文采用第二代 Illumina 与第三代 PacBio 平台相结合的测序技术,对菌株GW-01 进行全基因组测序,得到了基因组序列信息,并确定为蜡样芽孢杆菌。通过COG、GO、KEGG 等数据库完成了功能注释与比对分析,了解了菌株GW-01 的生物学特性。通过与CAZy 数据库的比对共获得了CAZy 家族编码基因135 个,其糖苷水解酶、糖苷转移酶等的协同作用可能与菌株GW-01 的益生性相关。采用VFDB数据库对菌株GW-01 的毒力因子进行预测,与其他Bc 相比,GW-01 潜在的毒力因子占比率最少,且大部分仅编码菌株正常生长所需的蛋白,因此GW-01 虽具有毒力因子但其致病性有限,在开发成为益生菌方面具有很大的应用潜力。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
