耐低温酵母的分离鉴定及对低温酿造米酒品质的影响
2024-04-01李嘉宇黄杰惠陈博慧
廖 娟,李嘉宇,黄杰惠,陈博慧,杨 涛,*
(1.中南林业科技大学食品科学与工程学院,湖南长沙 410004;2.稻谷及副产品国家工程研究中心,湖南长沙 410004)
米酒是一种以大米为原料的传统酒精饮料,因其香气浓郁、口感清爽而备受喜爱[1]。由于发酵原料以及发酵工艺的不同,米酒的风味与酱香型和浓香型白酒相比会显得相对单调[2]。米酒大多是常温发酵,常温下酵母生长和代谢旺盛,酵母快速增长过程中会因代谢产生大量高级醇类物质[3],大量高级醇会给酒体带来苦味、且具有较强的致醉性[4]。所以目前市面上米酒普遍存在酯类含量低、高级醇含量偏高的问题,其发展受到香味组分较少、容易致醉、饮后上头等关键问题的制约[5]。
低温发酵常被用于啤酒、日本清酒及白葡萄酒的生产中,被认为可以增加和保留更多的挥发性香气成分,从而改善发酵酒的风味[6]。Massera 等[7]发现与25 ℃下发酵相比,低温发酵的葡萄酒具有更高的酯和更低的萜烯含量。Gamero 等[8]发现低温发酵下生产的葡萄酒中甘油、乙基酯的产量显著上升。Urbina 等[9]发现发酵温度与啤酒中高级醇的含量成正比。目前米酒酿造过程中少有采用低温发酵工艺的尝试。为了降低米酒中高级醇的含量、增加酯类物质含量,以提高米酒香气品质,本研究旨在利用低温酿造改善米酒品质。
为筛选适合低温酿造米酒的酵母菌株,本研究以从米曲中分离纯化出酵母为研究对象,测定其低温下产香情况、发酵能力、产乙醇能力和产酯能力,筛选出一株优良耐低温产香酵母,通过菌落形态观察并结合分子生物学鉴定筛选得到的酵母菌,并分析其生长特性和耐受性。利用筛选得到耐低温酵母,进行低温米酒发酵实验,分析低温米酒和常温米酒的理化指标及感官评价。该研究对低温发酵米酒的开发具有重要参考价值。
1 材料与方法
1.1 材料与仪器
籼米 金龙鱼粮油食品股份有限公司;米曲样品来源于广西、四川、贵州、湖南、湖北等地的七种米曲;安琪酵母(AngelSaccharomyces cerevisiae)安琪酵母股份有限公司;孟加拉红培养基 广东环凯生物科技有限公司;酵母粉、蛋白胨 赛默飞世尔科技有限公司;糖化酶(100000 U/g)、α-淀粉酶(40000 U/g) 上海阿拉丁生化科技股份有限公司;2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC) 上海麦克林生化科技有限公司;其余试剂均为国产分析纯。
HS-10 顶空进样器、Nexis GC-2030 气相色谱仪日本岛津公司;BA200 显微镜 麦克奥迪实业集团有限公司;MIR-150A 恒温培养箱 上海SANTN公司;TD5A-WS 台式高速离心机 湖南湘仪实验仪器开发有限公司;UV-2600 紫外可见光分光光度计日本岛津公司;A300 聚合酶链式反应仪 杭州朗基科学仪器有限公司。
1.2 实验方法
1.2.1 培养基的配制 孟加拉红培养基(g/L):蛋白胨 5.0,KH2PO41.0,MgSO40.5,葡萄糖10.0,氯霉素0.1,孟加拉红0.033,琼脂20.0,121 ℃灭菌20 min;YPD 固体培养基(g/L);酵母膏10,蛋白胨20,葡萄糖20,琼脂20,121°C灭菌20 min;米曲汁培养基:籼米500 g,淘洗干净后加水没过,浸泡5 h,上锅蒸煮直至大米煮熟,冷却,拌入米根霉,30 ℃培养40 h。然后加水淹没培养物,60 ℃糖化6 h,过滤,将滤液糖度调至15°Bx,pH 调至6;米曲汁固体培养基:米曲汁培养基中加入2%的琼脂;TTC 上层培养基(g/L):2,3,5-三苯基氯化四氮唑(TTC)0.5,葡萄糖5,琼脂15;TTC 下层培养基(g/L):MgSO40.4,KH2PO41.0,酵母浸出粉1.5,蛋白胨2,葡萄糖10,琼脂20,调节pH 至5.5。
1.2.2 酵母菌种的分离纯化 根据参考文献[10]的方法并加以修改,称取0.1 g 米曲溶于10 mL 无菌水中,30 ℃、170 r/min 摇床培养30 min,静置取上层菌悬液,梯度稀释涂布于孟加拉红琼脂平板上,30 ℃培养24 h,挑取符合酵母菌落形态的菌株,采用平板划线法接于YPD 固体培养基上,30 ℃培养48 h,纯化得到纯菌株。将纯化得到的菌株接种于YPD 培养基中,150 r/min、30 ℃摇床培养24 h 得到种子液,种子液稀释至107CFU/mL,4 ℃保存备用。
1.2.3 耐低温产香酵母的筛选
1.2.3.1 酵母的初筛 将分离纯化得到的菌株接种于米曲汁固体培养基平板上,15 ℃培养至菌落成型,通过嗅闻法[11]对酵母菌株进行香气评价,排除其中香气不协调、不舒适的菌落,初步筛选具有酯香、甜香、酒香等香气的菌株进行复筛。
1.2.3.2 酵母的二级筛选 将初筛得到的菌株种子液分别以2%的接种量接种于盛有倒置杜氏小管的米曲汁培养基中,采用杜氏小管发酵法[12],170 r/min、15 ℃摇床培养,观察杜氏管内气体的产生情况,记录气泡在杜氏小管中的高度,筛选产气多且快的酵母进行三级筛选。
1.2.3.3 酵母的三级筛选 将二级筛选得到的菌株划线接种于TTC 下层培养基上,15 ℃下培养至菌落成型,倒入TTC 上层培养基,15 ℃下遮光培养2~3 h,观察培养皿上菌落的显色情况[13]。菌落颜色越红,菌株的产乙醇能力越强,筛选出产乙醇能力强的酵母进行四级筛选。
1.2.3.4 酵母的四级筛选 将三级筛选得到的菌株种子液分别以2%的接种量接种于米曲汁培养基中,15 ℃摇床培养15 d 后,取发酵液2 mL 进行乙酸乙酯含量的测定,采用气相色谱法,参考黄慧芬[14],筛选产乙酸乙酯能力最好的菌株。
1.2.4 耐低温产香酵母的鉴定
1.2.4.1 形态学观察 取一环纯化后的菌株在YPD平板上划线,30 ℃培养48 h,取平板进行观察。用接种针沾取菌苔于载玻片上,滴加1 滴无菌水,盖上盖玻片,于光学显微镜下10×40 倍观察菌株细胞形态。
1.2.4.2 分子生物学鉴定 使用真菌通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')、ITS4(5'-TCC TCCGCTTATTGATATGC-3')扩增菌株的ITS 序列;PCR 反应体系:预混酶20 μL;引物ITS1、ITS4 各2 μL;菌液2 μL;ddH2O 15 μL。扩增条件:预变性98 ℃、2 min;变性 98 ℃、10 s;退火56 ℃、10 s;延伸72 ℃、10 s/kb,循环35 次;再延伸72 ℃、5 min;4 ℃保存。将扩增好的PCR 产物进行琼脂糖凝胶电泳。电泳条带送至武汉擎科生物公司测序。测序结果提交于美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的Gen-Bank 数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索,选取同源性较高的模式菌株的ITS rRNA 基因序列,使用MEGAX 软件中的邻接法构建系统发育树。
1.2.5 耐低温产香酵母的生长曲线测定 根据参考文献[15]的方法并加以修改,酵母种子液以2%的接种量接种至YPD 培养基中,分别于30 ℃、15 ℃,150 r/min 摇床培养。定时取样测定OD540nm值,以时间为横坐标,OD540nm值为纵坐标,绘制出菌株的生长曲线;同时绘制安琪酿酒酵母(AQJM)的生长曲线作为对照。
1.2.6 耐低温产香酵母的耐受性实验
1.2.6.1 乙醇耐受性 酵母种子液以2%的接种量接种至不同乙醇浓度(0%vol、2%vol、4%vol、6%vol、8%vol、10%vol、12%vol)的YPD 培养基,30 ℃、150 r/min 摇床培养24 h,测定OD540nm值,比较生长情况。
1.2.6.2 糖耐受性 酵母种子液以2%的接种量接种至不同葡萄糖含量(2%、10%、20%、30%、40%、50%、60%)的YPD 培养基,30 ℃、150 r/min 摇床培养24 h,测定OD540nm值,比较生长情况。
1.2.6.3 酸耐受性 酵母种子液以2%的接种量接种至不同pH(乙酸调,3.0、3.5、4.0、4.5、5.0、5.5、6.0)的YPD 培养基,30 ℃、150 r/min 摇床培养24 h,测定OD540nm值,比较生长情况。
1.2.6.4 温度耐受性 酵母种子液以2%的接种量接种至YPD 培养基,分别于不同温度(10、15、20、25、30、35、40 ℃)下、150 r/min 摇床培养48 h,测定OD540nm值,比较生长情况。
1.2.7 耐低温产香酵母低温酿造米酒实验 根据参考文献[16]的方法并加以修改,250 g 籼米浸泡3 h 后,按料液比1:3 籼米与水混合,用打浆机磨浆。加入10 U/g 高温α-淀粉酶,温度90 ℃、液化时间45 min,冷却至室温,加入糖化酶250 U/g,温度60 ℃,糖化时间60 min,冷却至室温,以2%的接种量接种酵母XQ2-8 种子液,置于锥形瓶中封口膜密封,在15 ℃下发酵,监测其失重,当24 h 内失重<0.02 g 时视为发酵结束,记录其发酵时长,发酵结束后离心过滤获得米酒,并以30 ℃下发酵获得的米酒作为对照。
1.2.8 米酒理化指标分析及感官评价 还原糖含量的测定:采用DNS 法[17];总酸、酒精度及pH 的测定:参照GB/T 13662-2018 黄酒中方法[18];总酯含量的测定:采用皂化回流法[19];总高级醇含量的测定:采用气相色谱法,参考黄慧芬[14];感官评价:感官评价小组由10 位经过训练的品评师组成,实验在食品感官品评室中进行,样品随机呈现。香气、滋味、色泽、典型性4 个维度,每个维度25 分,总分为100 分,具体评分标准见表1。
1.3 数据处理
利用Excel、SPSS、GraphPad Prism 8 软件对数据进行分析处理,使用MEGA11 软件构建系统发育树。实验均进行3 次重复,结果表示为“平均值±标准偏差”。
2 结果与分析
2.1 耐低温产香酵母的初筛
从多个米曲样本中分离、纯化后共得到69 株品质优良、性状稳定的酵母菌,将得到的菌株接种于米曲汁固体培养基平板上,嗅闻法对各酵母菌株进行香气评价,排除其中香气不协调、不舒适的菌落,初步筛选得到47 株产香舒适的菌株,根据菌株样本的米曲来源进行编号。初步筛选的目的是为了选出具有产香能力的酵母菌,由图1 所示,本实验筛选所得酵母的香气类型可分为7 类,按其占比从高至低包括:酒香共15 株占比33%、淡果香共7 株占比15%、浓郁酯香共7 株占比15%、浓郁果香共6 株占比13%、酯香共5 株占比10%、清香共4 株占比8%和其他(中药香和烟熏香)共3 株占比6%。
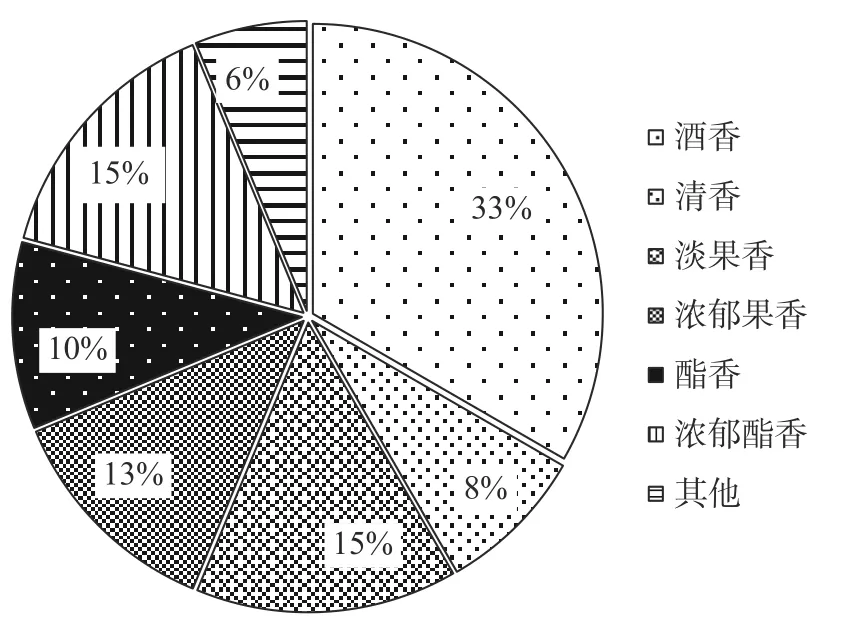
图1 酵母香气类型分类图Fig.1 Yeast aroma classification
2.2 耐低温产香酵母的二级筛选
初次筛选得到的47 株有产香能力的酵母菌株采用杜氏管发酵法,以发酵过程中酵母的产气情况来表达菌株的发酵能力[20]。初筛后得到的47 株产香酵母以及对照菌株安琪酿酒酵母(AQJM)的产气情况见表2,有38 株酵母具有产气能力,其中有10 株酵母菌株发酵管中杜氏小管中空气高度高于30 mm,具有极强的产气能力,菌株编号分别是XQ1-3、XQ2-8、XQ3-5、XQ4-2、XQ4-3、XQ5-8、XQ6-2、y-8、YRJM、N9-2,这些菌株相比于其他菌株有更强的发酵能力。因此,选择具有较好低温下发酵能力的10 株产香酵母进行下一步筛选。

表2 杜氏小管筛选产气结果Table 2 Duchenne tubule screening results of gas production
2.3 耐低温产香酵母的三级筛选
TTC 是一种显色剂,能与酵母代谢物发生显色反应,可以用来判断酵母产乙醇能力的强弱[21]。观察培养皿中菌落的颜色,产乙醇能力越强的菌株菌落呈现深红色,产乙醇能力弱的菌株菌落呈现粉红色或不显色。结果如表3 所示,菌株XQ1-3、XQ4-2、XQ5-8、N9-2、XQ2-8、XQ3-5 在TTC 培养基上的颜色与对照菌株安琪酿酒酵母(AQJM)的颜色相当或更深,说明其产酒精能力与对照菌株AQJM 相当或更强。因此,选择XQ1-3、XQ2-8、XQ3-5、XQ4-2、XQ5-8、N9-2 进行下一步筛选。

表3 酵母菌在TTC 培养基上的显色结果Table 3 Color development results of yeast cultured on TTC medium
2.4 耐低温产香酵母的四级筛选
产酯能力强的酵母可对米酒的感官品质起到修饰、提高作用。乙酸乙酯被广泛认为是米酒、黄酒等以大米为原料的发酵酒的特征香气物质[22]。乙酸乙酯能赋予发酵食品以水果香,是酒精饮料中最为常见的乙酯类香气物质,存在于所有香型的酒类中[23]。如图2 所示,在相同发酵条件下各酵母菌株的产乙酸乙酯能力差异较大,其中酵母XQ2-8 的产乙酸乙酯的含量最高,为41.2 mg/L。因此选择菌株XQ2-8 进行后续实验。

图2 不同菌株产乙酸乙酯含量的比较Fig.2 Comparison of ethyl acetate produced by different strains
2.5 酵母XQ2-8 的鉴定
2.5.1 酵母XQ2-8 形态学观察 将酵母XQ2-8 在YPD 平板中划线,30 ℃培养至菌落成型,菌落形态如图3A,菌落长势良好,呈乳白色、质地均匀、呈圆形、边缘整齐、湿润黏稠易挑起;显微镜下细胞形态特征如图3B,细胞呈卵圆形,出芽生殖,无鞭毛及假丝,属酵母的典型特征。
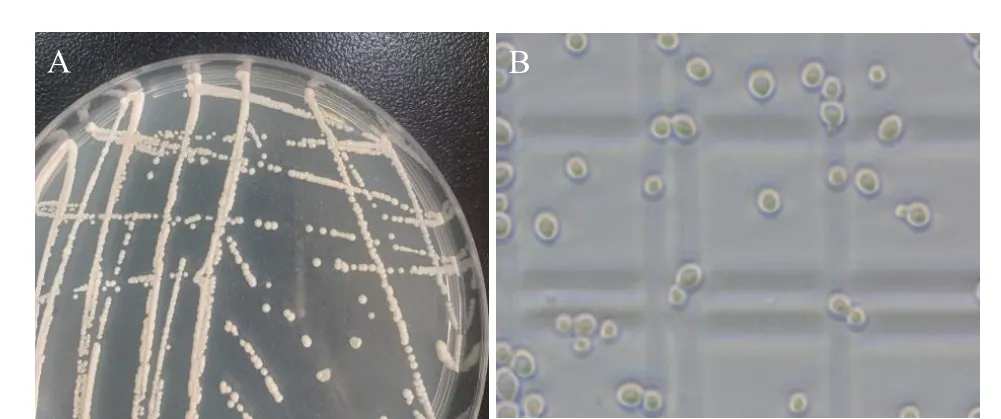
图3 XQ2-8 酵母的菌落形态(A)及细胞形态(B)Fig.3 Colony morphology (A) and cell morphology(B) of XQ2-8
2.5.2 酵母XQ2-8 分子生物学鉴定 对筛选到的酵母XQ2-8 进行ITS 序列测序,数据在NCBI 数据库中登录,序列号为OR003908,并进行BLAST 比对,用MEGA-X 软件绘制菌株XQ2-8 基因序列相关菌株的系统发育树,结果见图4。菌株XQ2-8 与MH979683.1Saccharomyces cerevisiae聚在一个分支上;再结合菌落形态、镜检结果分析,确定菌株XQ2-8 为酿酒酵母(Saccharomyces cerevisiae)。
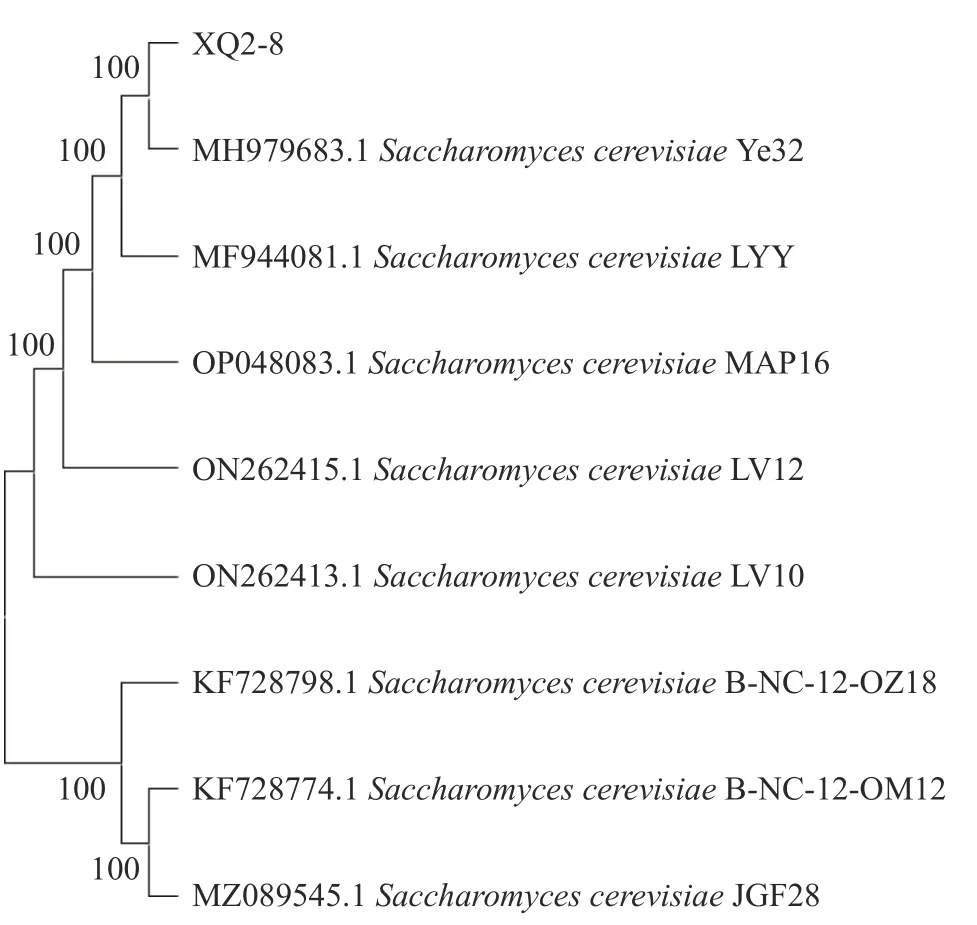
图4 XQ2-8 ITS 序列系统发育树Fig.4 ITS sequence phylogenetic tree of XQ2-8
2.6 酵母XQ2-8 的生长曲线
酵母XQ2-8 在YPD 培养基中30 ℃和15 ℃下培养的生长曲线如图5,酵母XQ2-8 在30 ℃下培养,在0~8 h 为迟缓期,生长速率缓慢;8~20 h 为对数生长期,生长速率最大;20 h 后进入稳定期,OD540nm值基本保持在1.68。酵母XQ2-8 在15 ℃下培养,在0~1 d 为迟缓期,相比30 ℃下迟缓期延长;1~5 d为对数生长期;5 d 后进入稳定期,OD540nm值基本保持在1.65。酵母XQ2-8 在30 ℃下的生长曲线与对照菌株安琪酿酒酵母(AQJM)基本一致,但15 ℃下安琪酿酒酵母延滞期更长为2 d,2~7 d 为对数生长期,7 d 后进入稳定期,且达到稳定后的生物量也降低。在生产中延滞期短的菌株有更好的适应能力[24],可在短时间内形成优势,减少副产物的形成,缩短发酵周期,有利于提高发酵效率。说明酵母XQ2-8 具有耐低温性,适用于低温下酿造米酒。
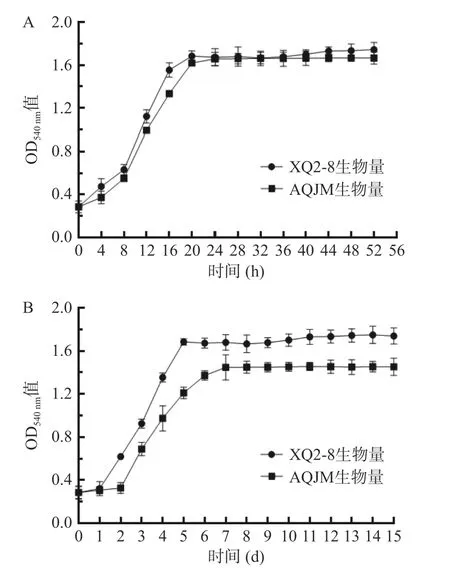
图5 XQ2-8 菌株在30 ℃(A)和15 ℃(B)下生长曲线Fig.5 Growth curve of strain XQ2-8 at 30 ℃ (A) and at 15 ℃ (B)
2.7 酵母XQ2-8 的耐受性分析
高浓度乙醇会抑制酵母菌细胞的生长,影响其发酵效果[25]。具有一定耐乙醇能力的酵母能够使发酵更加完全、彻底[26]。酵母XQ2-8 对乙醇的耐受性见图6a,随着乙醇体积分数增加,酵母XQ2-8 的生物量逐渐降低,耐受能力逐渐减弱。在乙醇浓度为8%vol 时,酵母呈现微弱生长;在乙醇浓度>8%vol时,酵母的生长基本停止。米酒的酒精度多为3%vol~7%vol,说明酵母XQ2-8 能够在米酒发酵过程中正常生长。王奇盛[27]从酒醅中分离出的酿酒酵母在8%vol 的乙醇浓度下生长能力显著降低,与本文结果一致。
葡萄糖是酵母菌发酵的营养来源,但过高的葡萄糖含量会抑制酵母菌的生长[28]。应用于生产中的酵母菌株应具备良好葡萄糖耐受能力[29]。杨宁等[30]将从白酒酒醅中分离出的酵母JM2 与安琪酿酒酵母对比,发现二者在葡萄糖含量50%的条件下基本停止生长。酵母XQ2-8 对葡萄糖的耐受性见图6b,随着葡萄糖含量的增加,酵母XQ2-8 的OD540nm值降低。当葡萄糖含量>30%时,酵母的生物量明显下降,但在葡萄糖含量为60%时,酵母XQ2-8 仍可生长。说明该菌种葡萄糖耐受性较好,可用于米酒生产发酵。
酵母菌最适生长pH 通常为4~5,发酵过程中产生的酸性物质会导致体系酸度的变化。张乐等[31]发现,酿酒酵母具有一定的酸耐受性有利于提升酵母的发酵速率。应用于生产的酵母应具备良好的耐酸性。酵母XQ2-8 对酸的耐受性见图6c。当pH 为3.0~6.0 时,随着pH 不断升高,酵母XQ2-8 的生物量逐渐升高至稳定,当pH 为5.5 时菌株的生长状况最佳,在pH 为3.0 时菌株生物量低但仍可生长,米酒的pH 在3.8~4.5 之间[32],说明酵母XQ2-8 能够适应米酒酿造过程中的pH 环境。陈丽花等[10]从甜酒曲中分离的多株酵母在pH3.0~11.0 之间均能生长,这与本实验结果相似。
温度会直接影响酵母的生长繁殖,温度较高,酵母生长较快容易加速衰亡,温度较低会导致酵母生长周期变长[33]。本文旨在利用低温发酵米酒,故对于所筛选菌株的低温耐受性至关重要。酵母XQ2-8 对温度的耐受性见图6d。酵母XQ2-8 在10~35 ℃范围内均能生长,在25 ℃条件生长情况最好,且在10 ℃下仍有一定生长能力,说明酿酒酵母XQ2-8 具有一定的低温耐受性,能够适用于低温发酵米酒。
2.8 酵母XQ2-8 对低温发酵米酒品质的影响
利用上述实验筛选得到耐低温酵母XQ2-8,进行低温米酒发酵实验,同时以30 ℃下发酵的米酒为对照组,15 ℃和30 ℃下发酵时长分别是13 d 和6 d,发酵结束后其理化指标及感官得分见表4,低温米酒残糖量和酒精度分别为5.61 g/L、7.81%vol,与常温米酒无显著差异(P>0.05),且符合米酒标准NY/T 1885-2017《绿色食品 米酒》[34]。总酸含量1.91 g/L、总酯含量60.08 mg/L、甘油含量2.59 g/L、高级醇含量578.20 mg/L、感官评分89.47,与常温米酒差异显著(P<0.05)。相比30 ℃下酿造的米酒,15 ℃下酿造的米酒总酯含量提高15.6%、甘油含量提高22.7%、高级醇含量降低17.7%,这一结果与Molina 等[35]、Beltran 等[36]对比低温常温下发酵葡萄酒、啤酒的结果相似。目前米酒中酯类含量相对较低,高级醇含量相对高于其他酒种,酯类含量低使米酒香味寡淡[37],高级醇含量高使酒体呈现苦味[38],具有较强的致醉性[39]。甘油是酵母酒精发酵过程中主要副产物之一[40],可为酒体提供圆润、柔滑口感,一定含量甘油可增加米酒复杂性[41]。低温酿造使米酒中酯类、甘油含量提高,高级醇含量降低,可以改善米酒品质。
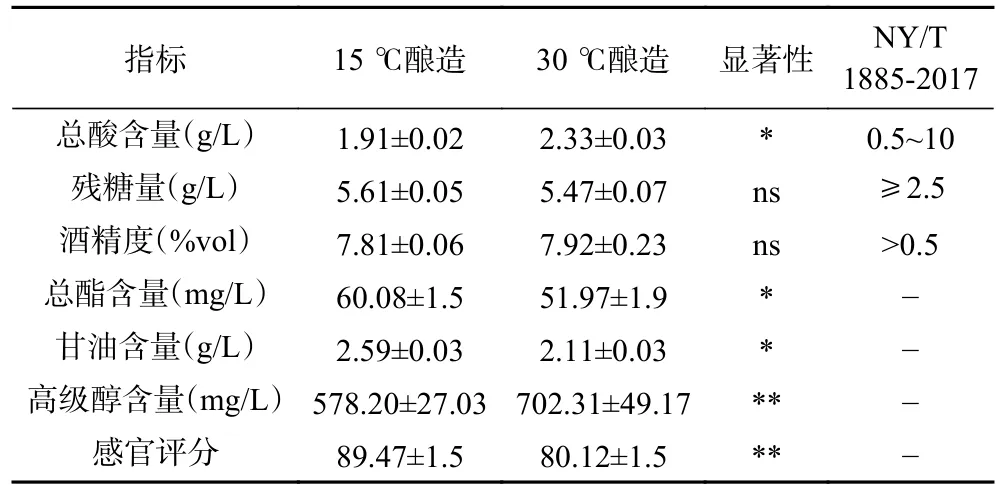
表4 米酒理化指标分析Table 4 Analysis of physicochemical indexes of rice wine
3 结论
本文以从米曲中筛选得到的69 株酵母菌株为研究对象,比较其低温下的产香、发酵、产酒精和产酯能力,获得1 株低温下发酵性能优良且产香能力强的菌株XQ2-8,经鉴定为酿酒酵母(Saccharomyces cerevisiae)。在低温下菌株XQ2-8 比对照菌株生长延滞期更短、达到稳定时生物量更高,生长周期更短,具有良好的耐低温特性;菌株XQ2-8 可在乙醇体积分数8%vol、葡萄糖含量60%、pH3.0、低温10 ℃的条件下生长。利用菌株XQ2-8 低温酿造米酒发现,与常温酿造米酒相比,低温米酒的总酯含量和甘油含量分别提高了15.6%和22.7%;总酸含量和总高级醇含量分别降低了18.0%和17.7%、感官得分提高了11.7%,说明菌株XQ2-8 低温酿造米酒能有效改善米酒饮后上头、风味组分少的问题,提高米酒品质。
本研究筛选了一株适用于低温酿造米酒的优良菌株,且利用该菌株低温酿造米酒能够有效提高米酒的风味品质,对于开发低温米酒酿造工艺有较强的工业应用价值。但目前低温发酵仍然存在发酵周期长的问题,不利于大规模工业化生产。在未来,对低温米酒酿造工艺的优化还有待深入研究。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
