裂褶菌发酵西洋参工艺优化及体外抗氧化能力研究
2024-04-01王崑仑管立军李家磊季妮娜
王崑仑,管立军,*,高 扬,严 松,李家磊,季妮娜,李 波,周 野
(1.黑龙江省农业科学院食品加工研究所,黑龙江哈尔滨 150086;2.黑龙江省食品加工重点实验室,黑龙江哈尔滨 150086;3.黑龙江省农业科学院大豆研究所,黑龙江哈尔滨 150086)
西洋参(Panax quinquefoliusL.),又名洋参、花旗参等,系五加科人参属植物,原产于美国和加拿大,其化学成分丰富,生物活性广泛,药用价值高,受到全世界人民的喜爱[1]。西洋参具有补气养阴、清热生津之功效,用于改善气虚阴亏、虚热烦倦、咳喘痰血、内热消渴和口干舌燥等症状。西洋参的活性成分主要有人参皂苷、多糖、黄酮等,其中皂苷Rg1、Rb1、Re、Rb2、Rc、Rd、Rg2是西洋参中含量较高的7 种,质量分数占总人参皂苷的90%以上[2]。随着国内外对西洋参研究的深入,发现西洋参的人参皂苷,尤其是二醇系人参皂苷,在酸、碱、高温和微生物的作用下,可以分解为西洋参中没有的稀有皂苷Rg3、s-Rh2、r-Rh2和拟人参皂苷CK 等[3-4]。其中,Rg3具有很强的抗氧化能力,并能提高人体对多种癌细胞的抗增殖作用[5-6]。 Rh2是抗肿瘤效果最好的人参皂苷类,能通过抑制肿瘤细胞分裂周期,来抑制肿瘤细胞扩散[7]。拟人参皂苷CK 在抗肿瘤、抗菌和治疗白血病方面具有良好功效[8-10]。西洋参中多糖是仅次于皂苷的活性成分,具有抗氧化、提高机体免疫力和抗肿瘤等作用[11-13]。西洋参黄酮具有抗氧化和降血压等作用[14-15]。
裂褶菌(Schizophyllum communeFr.)又称白参、树花、八担柴,是一种营养丰富的大型真菌[16]。它多在针叶树或阔叶树的腐木、枯枝、倒木上发现,是典型的木腐菌;味道鲜美,口感鲜嫩,具有浓郁菇类香味,可在不同的环境下生长[17]。裂褶菌具有滋补强壮、清肝明目、镇静作用,在民间常用于治疗白带异常,药用价值明显[18]。目前对裂褶菌的研究颇为广泛,欧美国家、日本等国在裂褶菌多糖的抗癌活性物质、分子生物学、优良菌株的选育等方面研究较多[19-20],国内主要在裂褶菌的人工驯化栽培及栽培现状、裂褶菌多糖利用、药用价值及发酵条件等方面展开研究[21]。经研究发现裂褶菌主要功效成分裂褶菌多糖具有抗肿瘤[22-23]、提高免疫力[24]、抗疲劳和抗氧化等作用[25-26]。利用裂褶菌进行发酵有效物质生物转化成为新的热点。刘海英[27]利用裂褶菌发酵转化大豆异黄酮,结果表明大豆异黄酮糖苷被转化为苷元。
鉴于此,本研究以西洋参为原料,创新性采用裂褶菌作为固态发酵西洋参的菌种,将裂褶菌的活性物质与西洋参的活性物质结合,产生稀有人参皂苷,获得更多的人参皂苷、多糖、黄酮等活性成分,产生极具保健价值的裂褶菌西洋参发酵物。并通过单因素实验和响应面Box-Behnken 试验设计,对裂褶菌固态发酵西洋参工艺进行优化,建立一个高效的发酵方法,为西洋参的发酵工艺提供实验依据。
1 材料与方法
1.1 材料与仪器
西洋参 黑龙江省海林西洋参种植基地;标准品:人参皂苷Rg1、Re、Rb1、Rg2、Rc、Rb2、Rd、Rg3、s-Rh2、r-Rh2、拟人参皂苷CK 99.5%,上海纯优生物科技有限公司;芦丁对照品 上海源叶生物科技有限公司;无水乙醇 分析纯,沈阳迈科麦科技有限公司;裂褶菌(Schizophyllum commune)1 号菌株,编号336356 云南食用菌研究所;裂褶菌(Schizophyllum commune)2 号菌株(编号SHBCC D11505)和3 号菌株(编号SHBCC D61817) 上海保藏生物技术中心;马铃薯葡萄糖琼脂培养基、马铃薯葡萄糖肉汤北京奥博星生物技术有限责任公司;葡萄糖 天津市天力化学试剂有限公司;浓硫酸 天津市祥瑞鑫化工科技有限公司;苯酚 天津市红岩化学试剂厂;无水乙醇、正丁醇、甲醇(分析纯) 天津市永大化学试剂有限公司;乙腈、甲醇 色谱纯,上海阿拉丁股份有限公司;实验用去离子水 娃哈哈集团。
KQ-400KDE 型高功率超声波清洗器 济宁亨达超声波有限公司;CARY100 型紫外分光光度计上海精科有限公司;XS204 型分析天平 瑞士METTLER TOLEDO 公司;3-18K 型冷冻离心机德国SIGMA 公司;NAI-T1-50 型台式真空冷冻干燥机 上海那艾精密仪器有限公司;SW-CJ-2D 型双人净化工作台 上海苏净实业有限公司;LHS-250HC-11 型恒温恒湿箱 上海一恒科学仪器有限公司;HZQ-F100 型振荡培养箱 哈尔滨市东联电子技术开发有限公司;BL-50A 型立式压力蒸汽灭菌器 上海东亚压力容器制造有限公司;TSE240V-ULTS 型立式超低温冰箱、U3000 型高效液相色谱仪 美国赛默飞公司;SHB-III 型循环水式真空泵 无锡市长庆化工防腐设备有限公司;DYF-500 型万能粉碎机浙江瑞昊机械制造有限公司;DHG-9240A 型电热恒温鼓风干燥箱 苏州德沃斯烘箱制造有限公司;DK-98-IIA 型电热恒温水浴锅 天津市泰斯特仪器有限公司;QT-1 型旋涡混合器 上海琪特分析仪器有限公司。
1.2 实验方法
1.2.1 工艺流程 西洋参→冷冻干燥→粉碎(过80 目)→西洋参粉→灭菌→接种裂褶菌→培养→冷冻干燥→粉碎(过80 目)→西洋参发酵产物→活性物质含量检测
操作要点:将西洋参冷冻干燥磨粉(过80 目)制成西洋参粉。称取5.0 g 西洋参粉放入50 mL 三角瓶中,加入蒸馏水2.5 g 搅拌均匀,生物透气膜封口,在灭菌锅内121 ℃灭菌20 min,放冷,备用。在无菌环境下,向三角瓶中加入6%(w/w)接种量的裂褶菌和2.5 g 无菌水,搅拌均匀后,在25 ℃、80%湿度下培养8 d,使裂褶菌白色菌丝布满三角瓶,冷冻干燥,粉碎过80 目筛,即得西洋参发酵物。检测西洋参发酵物中活性物质人参皂苷、粗多糖和总黄酮的含量。
1.2.2 人参皂苷含量测定 人参皂苷对照品溶液的制备:精密称取标准品人参皂苷(Rg1、Re、Rb1、Rg2、Rc、Rb2、Rd、Rg3、CK、s-Rh2、r-Rh2),溶于甲醇溶液中,定容,稀释成合适的浓度梯度,过滤待检测。
色谱条件:色谱柱(Waters-C18,250 mm×4.6 mm,5 μm);检测波长:203 nm;流速:1.0 mL/min,柱温:40 ℃;流动相为乙腈溶液;梯度洗脱程序为:0~25 min,乙腈的体积分数为20%;25~60 min,乙腈的体积分数由20%增至40%;60~90 min,乙腈的体积分数由40%增至55%;90~120 min,乙腈的体积分数55%[28]。
精密称取1.0 g 西洋参发酵物,加入50.0 mL 水饱和正丁醇,称定重量,水浴加热回流1.5 h,放冷再称定重量,用水饱和正丁醇补足减轻重量,摇匀过滤。精密量取滤液25 mL 蒸干,残渣加50%甲醇适量使其溶解,定容于10 mL 容量瓶,摇匀滤过,针入高效液相色谱检测,按下面公式计算人参皂苷含量:
式中:W1表示人参皂苷含量,%;C1表示根据峰面积计算出的溶液质量浓度,mg/mL;V1表示供试品溶液体积,mL;D1表示溶液稀释倍数;M1表示取样量,mg。
1.2.3 粗多糖含量测定 葡萄糖对照品溶液的制备:精密称取葡萄糖对照品若干,配成浓度0.2 mg/mL对照溶液,备用。
标准曲线的绘制:采用苯酚-硫酸法,精密移取葡萄糖对照溶液0、0.2、0.4、0.6、0.8、1.0 mL 放于20 mL 具塞比色管中,用蒸馏水补至1.0 mL。移液管取1.0 mL 5%苯酚溶液于比色管中,再以较快的速度加入5.0 mL 浓硫酸,静置10 min。将比色管置于涡旋振荡器上振荡十几秒,使溶液充分反应,然后把试管放置在水浴锅中30 ℃下反应20 min,于490 mm 波长下,UV 测吸光度[29]。以葡萄糖浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
西洋参发酵物粗多糖含量的测定:精密称取1.0 g 西洋参发酵物,加入无水乙醇40 mL,在280 W、60 ℃、超声提取40 min,提取液在8000 r/min 下离心15 min,去上清,残渣加15 mL 的水,超声提取3次,每次30 min,每次8000 r/min 离心15 min,合并三次的上清液于50 mL 容量瓶中,加水定容至刻度,摇匀,即得样品粗多糖待测液。移取粗多糖待测液0.5 mL,照标准曲线的方法测定吸光值,带入标准曲线中,计算粗多糖浓度。按下面公式计算粗多糖含量:
式中:W2表示粗多糖含量,%;C2表示供试品溶液质量浓度,mg/mL;V2表示供试品溶液体积,mL;D2表示溶液稀释倍数;M2表示取样量,mg。
1.2.4 总黄酮含量测定 总黄酮对照品溶液的制备:精密称取芦丁标准品若干,溶于60%乙醇溶液中,配制0.1 mg/mL 的对照溶液,备用。
标准曲线的绘制:采用亚硝酸钠-硝酸铝法,从芦丁对照溶液中分别移取0、0.5、1.0、1.5、2.0、2.5、3.0 mL 放入10 mL 比色管,加60%乙醇溶至总体积5 mL。加入0.3 mL 质量分数为5%的NaNO2,震荡混匀后,静置8 min,再加0.3 mL 质量分数为10%的Al(NO3)3,振荡摇匀后,静置10 min,最后加4 mL 质量分数为4%的NaOH 溶液,用60%乙醇定容,摇匀静置10 min 后,在500 nm 最大吸收波长测定吸光度[30]。绘制芦丁浓度与吸光度的标准曲线。
西洋参发酵物总黄酮含量的测定:精密称取1.0 g 西洋参发酵物,加入60%乙醇溶液30 mL,在280 W、50 ℃条件下,超声提取3 次,每次40 min,每次8000 r/min 离心15 min,合并三次的上清液于100 mL 容量瓶中,加60%乙醇溶液定容至刻度,摇匀,即得样品总黄酮待测液。精密移取总黄酮待测液1.0 mL,照标准曲线的方法测定吸光值,带入标准曲线中,计算总黄酮浓度。按下面公式计算总黄酮含量:
式中:W3表示总黄酮含量,%;C3表示供试品溶液质量浓度,mg/mL;V3表示供试品溶液体积,mL;D3表示溶液稀释倍数;M3表示取样量,mg。
1.2.5 裂褶菌菌株的筛选 初选用于培养裂褶菌子实体的裂褶菌1 号菌株(编号336356)、用于科研生产L-苹果酸的裂褶菌2 号菌株(编号SHBCC D11505)和用于分解木质素的裂褶菌3 号菌株(编号SHBCC D61817),以期通过1 号菌株旺盛生长能力,2 号菌株分泌的L-苹果酸和3 号菌株分解木质素能力来转化西洋参中人参皂苷、粗多糖和黄酮等活性成分。按1.2.1 方法分别制备西洋参发酵物。并检测裂褶菌1 号菌株西洋参发酵物、裂褶菌2 号菌株西洋参发酵物、裂褶菌3 号菌株西洋参发酵物和未发酵西洋参中的总人参皂苷的含量、粗多糖的含量和总黄酮含量,选取适合菌株。
1.2.6 单因素实验 根据1.2.1 方法,恒定培养湿度80%,选取在条件pH7,接种量8%,发酵8 d,考察不同发酵温度(20、25、30、35 和40 ℃)对发酵物中总人参皂苷含量的影响;固定条件pH7,温度为30 ℃,裂褶菌固态发酵西洋参8 d,考察不同裂褶菌的接种量(4%、6%、8%、10%、12%和14%)对发酵物中总人参皂苷含量的影响;固定条件发酵温度30 ℃,接种量10%,发酵8 d,考察不同pH(4、5、6、7、8 和9)对发酵物中总人参皂苷含量的影响;固定条件pH7,发酵温度30 ℃,接种量10%,考察不同发酵时间(2、4、6、8、10 和12 d)对发酵物中总人参皂苷含量的影响。
1.2.7 响应面优化试验 为全面考察裂褶菌发酵西洋参工艺中各因素的影响,在单因素实验结果的基础上,运用响应面软件Design-expert 8.0 进行Box-Benhnken 试验设计。精密称取5.0 g 西洋参粉放入50 mL 三角瓶中,以裂褶菌接种量(X1)、发酵温度(X2)、发酵时间(X3)和发酵pH(X4)为自变量,总人参皂苷含量(Y1)为响应值,采用4 因素3 水平响应面试验模型进行优化。因素水平和编码见表1。

表1 响应面试验因素水平编码表Table 1 Response surface test factor level coding table
1.2.8 裂褶菌固态发酵西洋参对活性成分的影响在优化裂褶菌固态发酵工艺后,检测裂褶菌西洋参发酵物中各人参皂苷的变化、粗多糖含量的变化和总黄酮含量的变化,阐明裂褶菌固态发酵西洋参过程中对各活性成分的影响。
1.3 体外抗氧化实验
1.3.1 DPPH 自由基清除率实验 通过DPPH 自由基清除率实验评价未发酵西洋参、西洋参发酵物及VC对照品的清除自由基的能力。分别称取10.0 g未发酵西洋参和西洋参发酵物用100 mL 40%乙醇超声提取1 h,50 ℃减压旋蒸去乙醇,冻干成粉。参考Bai 等[31]的方法略有修改,分别配制(62.5、1000、2500、5000、10000、20000、40000 和80000 µg/mL)浓度的未发酵西洋参和西洋参发酵物冻干粉溶液,再配制(62.5、125、250、500、1000、1500、5000、10000、20000、40000 和80000 µg/mL)浓度的VC对照品溶液,取样品溶液1.5 mL 到比色管中,再加入等体积的0.1 mmol/L DPPH 95%乙醇溶液,混匀,室温避光反应30 min,517 nm 波长下检测吸光值,按公式计算DPPH 自由基清除率:
式中:A 为DPPH 待测样品的吸光值;A0为空白样品的吸光值。
1.3.2 ABTS+自由基清除率实验 通过ABTS+法评价未发酵西洋参、西洋参发酵物及VC对照品的清除自由基的能力。按1.3.1 处理样品,配制VC对照品溶液和样品溶液,再参考ARTS 等[32]的方法略有修改,配制在734 nm 波长下的吸光度为0.70±0.02 的ABTS+稀释液,分别取不同浓度的VC对照品溶液和样品溶液各0.1 mL 与4.9 mL ABTS+稀释液混合,常温下避光反应6 min,在734 nm 波长下检测吸光值。按公式计算ABTS+自由基清除率:
式中:A0为空白样品的吸光值;Ai为ABTS+待测样品的吸光值。
1.4 数据处理
上述实验均重复 3 次,并取平均值为实验结果。利用DPS 数据处理系统、Design-Expert 11 软件、Origin 8.06 和IC50计算器分别对实验结果进行统计学分析、作图、响应面分析和抗氧化实验的IC50值计算。
2 结果与分析
2.1 活性物质标准曲线的建立
人参皂苷Rg1、Re、Rb1、Rg2、Rc、Rb2、Rd、Rg3、s-Rh2、r-Rh2、拟人参皂苷CK、粗多糖和总黄酮的线性回归方程见表2。由表2 可知,各皂苷、粗多糖和总黄酮的相关系数R2均大于0.999,说各成分在表2 指定的浓度范围内,线性关系良好。

表2 活性物质标准曲线Table 2 Standard curve of active substance
2.2 裂褶菌菌株筛选结果
检测3 种裂褶菌西洋参发酵物和未发酵西洋参的活性成分,结果如表3 所示:总人参皂苷含量中裂褶菌2 号菌株>裂褶菌1 号菌株>裂褶菌3 号菌株>未发酵西洋参;粗多糖含量中裂褶菌3 号菌株>裂褶菌2 号菌株>未发酵西洋参>裂褶菌1 号菌株;总黄酮含量中裂褶菌2 号菌株>裂褶菌1 号菌株>裂褶菌3 号菌株>未发酵西洋参。所以,裂褶菌2 号菌株更适合于生产人参皂苷,裂褶菌3 号菌株更适合于生产多糖。由于总皂苷价值高于粗多糖,因此选择裂褶菌2 号菌株为后续实验的菌株。

表3 西洋参发酵物与未发酵西洋参活性成分比较Table 3 Comparison of active components between fermented and unfermented Panax quinquefolius L.
2.3 单因素实验结果
2.3.1 发酵温度对总人参皂苷含量的影响 由图1可知,发酵温度对总人参皂苷含量具有显著性影响(P<0.05),裂褶菌固态发酵西洋参温度在20~30 ℃条件下,总人参皂苷含量缓慢增加,在30 ℃时达到最大值9.2%±0.1%。在30~40 ℃条件下,总人参皂苷含量快速下降。这是因为30 ℃以上裂褶菌生长缓慢,35 ℃以上裂褶菌停止生长,40 ℃裂褶菌出现死亡[33],不能发挥转化人参皂苷作用。故最适发酵温度选择为30 ℃。

图1 发酵温度对总人参皂苷含量的影响Fig.1 Effect of fermentation temperature on total ginsenoside content
2.3.2 裂褶菌接种量对总人参皂苷含量的影响 由图2 可知,裂褶菌接种量对总人参皂苷含量具有显著性影响(P<0.05),当裂褶菌接菌量在4%~10%时,随着接菌量的增大,总人参皂苷含量也逐渐增加,当裂褶菌接菌量达到10%时总人参皂苷含量最高,达9.3%±0.1%;当裂褶菌接菌量高于10%时,总人参皂苷含量逐渐下降。这是因为接种量的增加明显提高了固态发酵体系中裂褶菌的含量,提高了发酵效率;当接种量高于10%时,发酵三角瓶中裂褶菌数量过多,产生竞争性抑制,影响菌体生长代谢,减弱了发酵效果;同时会消耗部分人参皂苷用于菌种繁殖,降低其含量[34]。故最适接种量选择为10%。
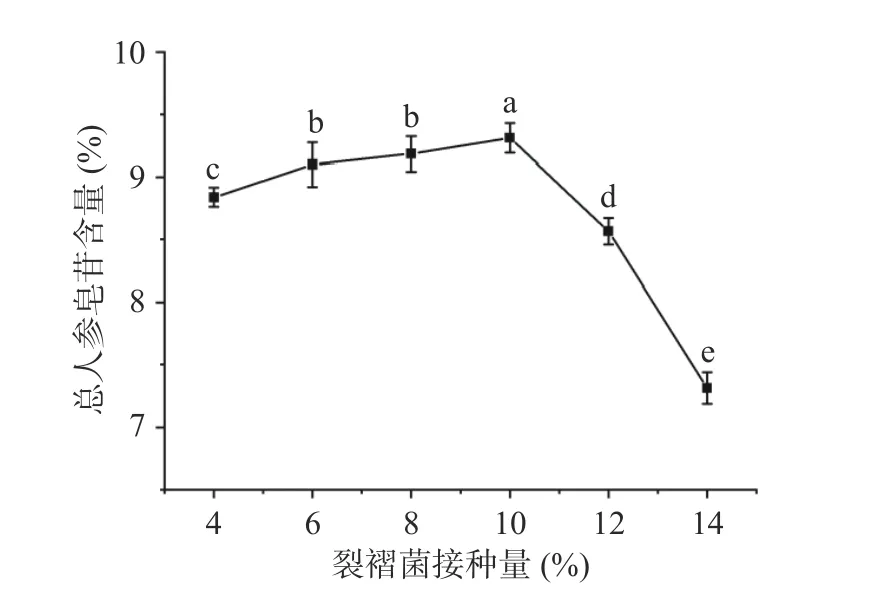
图2 裂褶菌接种量对总人参皂苷含量的影响Fig.2 Effect of inoculation amount of Schizophyllum commune on total ginsenoside content
2.3.3 pH 对总人参皂苷含量的影响 由图3 可知,pH 对总人参皂苷含量具有显著性影响(P<0.05),裂褶菌固态发酵西洋参pH 在4~6 条件下,总人参皂苷含量逐渐增加;在pH6 时达到最大值9.4%±0.2%。在pH6~8 条件下,总人参皂苷含量缓慢下降;pH9时,总人参皂苷含量大幅下降。这是由于裂褶菌生长喜酸性环境,菌丝生长的pH 适宜为5~6[33];发酵体系中,裂褶菌分泌的β-葡萄糖苷酶在pH6~8 之间具有较好的活性[29]。故最适发酵pH 选择为6。
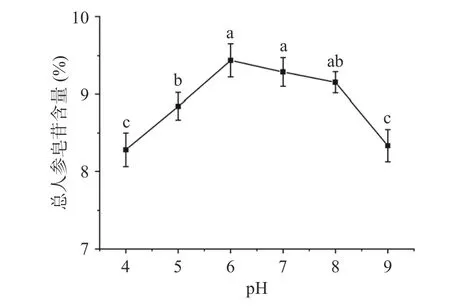
图3 pH 对总人参皂苷含量的影响Fig.3 Effect of pH value on total ginsenoside content
2.3.4 发酵时间对总人参皂苷含量的影响 由图4可知,发酵时间对总人参皂苷含量具有显著性影响(P<0.05),裂褶菌固态发酵西洋参时间2~10 d,总人参皂苷含量快速增加,在10 d 时达到最大值10.3%±0.3%。发酵10~12 d,总人参皂苷含量逐渐下降。这是因为在裂褶菌发酵初期,发酵三角瓶中营养物质充足,裂褶菌代谢旺盛,有利于向人参皂苷的转化;时间过长,营养物质消耗完,裂褶菌消耗部分人参皂苷用于菌种繁殖,在皂苷水解酶作用下生成皂苷元或次皂苷[34]。故最适发酵时间选择为10 d。
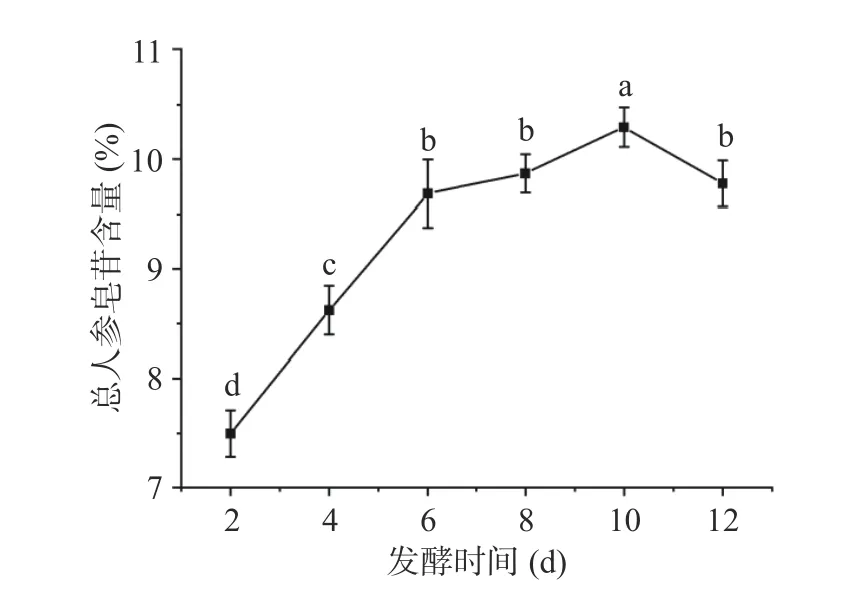
图4 发酵时间对总人参皂苷含量的影响Fig.4 Effect of fermentation time on total ginsenoside content
2.4 响应面优化发酵工艺
2.4.1 Box-Behnken 试验设计 根据单因素实验结果,利用响应面Box-Behnken 法以裂褶菌接种量(X1)、发酵温度(X2)、发酵时间(X3)以及发酵pH(X4),4 个因素为自变量,以总人参皂苷含量(Y1)为响应值,设计4 因素3 水平试验模型。设计方案及试验结果见表4。

表4 Box-Behnken 设计方案及结果Table 4 Design and result of Box-Behnken
通过Design-Expert 8.06 软件对表4 中的试验数据进行多元二次多项式回归拟合,得到总人参皂苷含量(Y1)回归方程:
Y1=10.22+0.51X1+0.62X2-0.43X3-0.37X4+0.51 X1X2-0.54X1X3+0.41X1X4+0.34X2X3+0.029X2X4+0.39X3X4-0.89X12-1.29X22-1.01X32-1.03X42
由表5 可知,总人参皂苷含量(Y1)回归模型的P值<0.01,极显著,说明这个二次回归方程模型可靠。并且,Y1模型的失拟项不显著(P>0.05),说明Y1模型未失拟,拟合可信。模型决定系数R2=96.50%,调整决定系数R2adj=91.20%,说明91.20%的响应值可变性可以被该模型解释,该模型拟合良好。下述方差结果表明,Y1模型可以准确描述各因素与总人参皂苷含量的关系。模型中因素X1、X2、X3、X4、X1X2、X1X3、X12、X22、X32和X42对总人参皂苷含量影响极显著(P<0.01),因素X1X4和X3X4对总人参皂苷含量的影响显著(P<0.05),其余因素不显著。通过F值大小可知,各因素对总人参皂苷含量影响强弱的顺序为X2(发酵温度)>X1(裂褶菌接种量)>X3(发酵时间)>X4(发酵pH)。
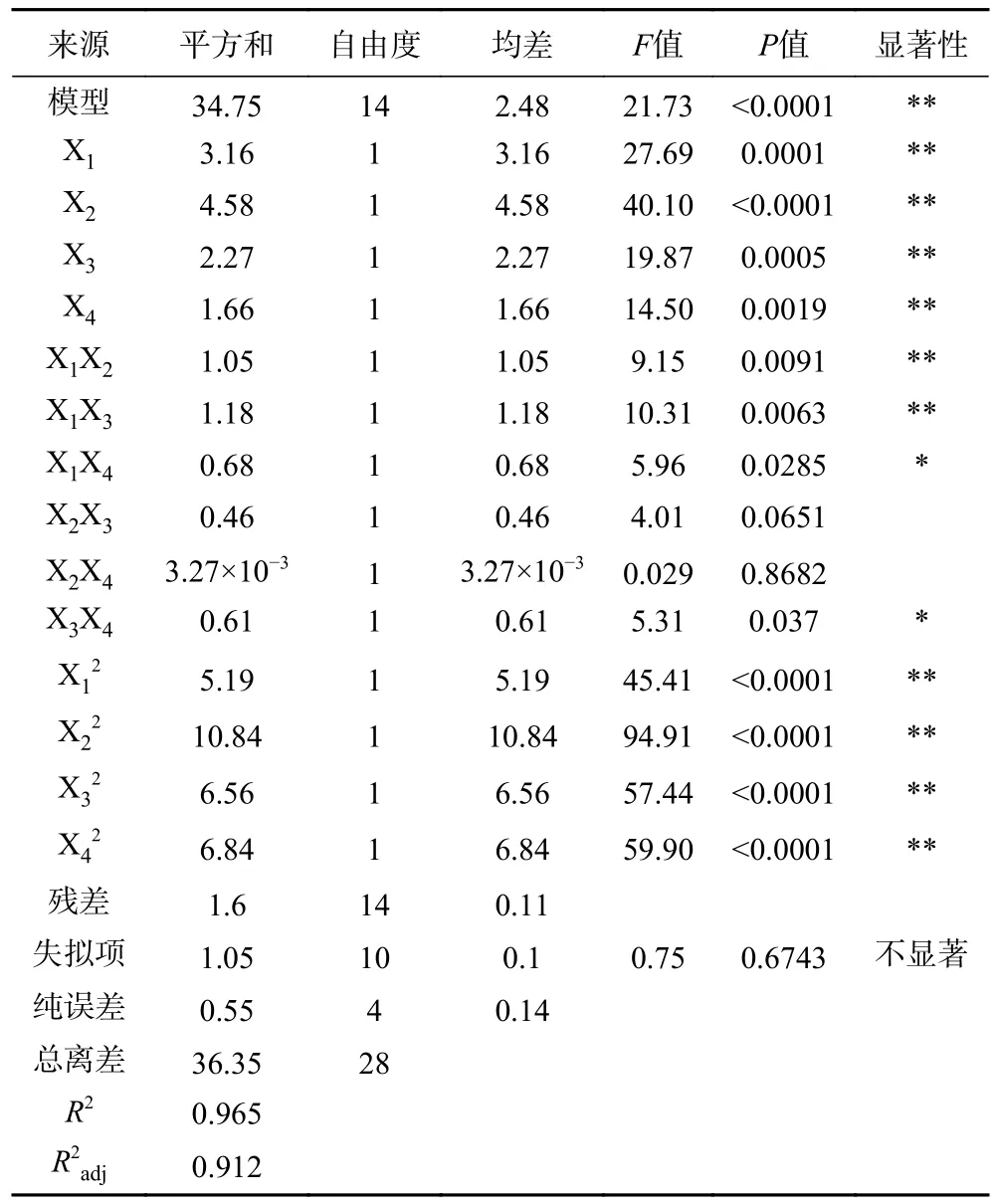
表5 方差分析结果Table 5 ANOVA of test results
2.4.2 各因素交互作用分析 如图5 所示,裂褶菌接种量(X1)和发酵温度(X2)、裂褶菌接种量(X1)和发酵时间(X3)、裂褶菌接种量(X1)和发酵pH(X4)、发酵时间(X3)和发酵pH(X4)的各组2D 等高线图均呈现椭圆状,表明各组因素间的交互作用显著[35];从3D 响应面图中可见,各变量对总人参皂苷含量影响均呈现先增后减的趋势,响应面趋于抛物线,且曲面斜率陡峭,表明各组因素间的交互作用显著[36],与Y1模型方差结果一致;而且深色部分主要集中在10.0%范围内,说明模型拟合出的最高总人参皂苷含量大于10.0%。
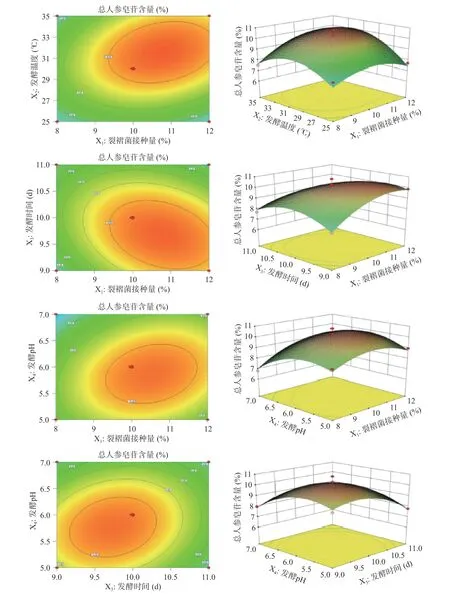
图5 各因素交互作用对总人参皂苷含量影响的等高线与相应曲面图Fig.5 Contours and response surface plots of the effect of various factors interactions on the influence of total ginsenoside content
2.4.3 模型验证结果 根据二次回归方程,拟合裂褶菌固态发酵西洋参工艺条件及结果。预测优化工艺条件为,裂褶菌接种量10.86%,发酵温度31.40 ℃、发酵时间9.69 d,发酵pH5.85,总人参皂苷含量10.51%±0.3%。根据实际操作需要,现实优化工艺条件为,裂褶菌接种量10.9%,发酵温度31 ℃、发酵时间10 d,发酵pH5.9,总人参皂苷含量10.28%±0.2%。误差在2.0%之内,说明响应面拟合的工艺模型准确可靠。
2.4.4 裂褶菌固态发酵西洋参对活性成分的影响结果 在裂褶菌固态发酵西洋参的优化工艺条件下发酵西洋参,结果如表6 所示,人参皂苷Rb1和Rg2含量大幅下降,人参皂苷Re 含量小幅下降;人参皂苷Rg1、Rc、Rb2、Rd 含量均上升,其中人参皂苷Rd 含量大幅上升;Rg3、s-Rh2、r-Rh2和拟人参皂苷CK为新出现皂苷。这说明西洋参原有人参皂苷Rb1、Rg2和Re 经裂褶菌微生物转化,分解为Rg1、Rc、Rb2、Rd、Rg3、s-Rh2、r-Rh2、拟人参皂苷CK,其中人参皂苷Rd 为主要分解产物。同时,西洋参中粗多糖含量从11.83%±0.06%上升为12.85%±0.05%,说明裂褶菌发酵西洋参过程中产生多糖;西洋参中黄酮含量从0.17%±0.01%上升为0.67%±0.01%,说明裂褶菌发酵西洋参过程中产生黄酮类物质。
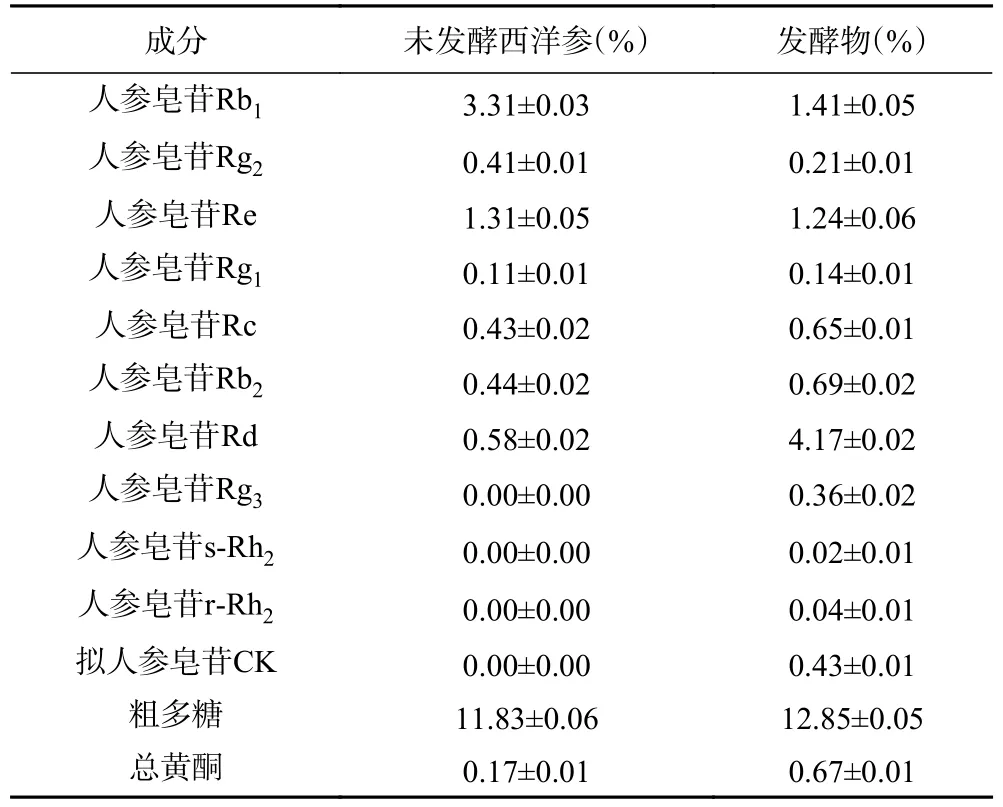
表6 裂褶菌固态发酵西洋参对活性成分的影响Table 6 Effect of solid state fermentation of Panax quinquefolius L.by Schizophyllum commune on active components
2.5 体外抗氧化能力实验结果
2.5.1 DPPH 体外抗氧化实验结果 如图6 所示,对照VC、西洋参发酵物和未发酵西洋参对DPPH 自由基均有清除作用,随着溶液浓度增加清除能力增强,其中VC溶液浓度从62.5 µg/mL 增加到1000 µg/mL时,对DPPH 自由基的清除率从37.23%增加到89.95%,后续浓度VC溶液对DPPH 自由基的清除率达到100%;西洋参发酵物待测溶液浓度从62.5 µg/mL 增加到80000 µg/mL 时,对DPPH 自由基的清除率从1.52%增加到86.65%,在相同浓度下未发酵西洋参待测溶液对DPPH 自由基的清除率从1.24%增加到80.55%。将各R 值与对应的溶液浓度,分别带入IC50计算器软件中进行计算。结果,VC的IC50值为134 µg/mL,西洋参发酵物的IC50值为31365 µg/mL,未发酵西洋参的IC50值为44169 µg/mL。因此,清除DPPH 自由基能力的强弱为:VC>西洋参发酵物>未发酵西洋参。这是因为裂褶菌西洋参发酵物中抗氧化能力强的西洋参多糖、总黄酮和稀有皂苷含量均高于未发酵西洋参[37-38],所以裂褶菌西洋参发酵物清除DPPH 自由基能力好于未发酵西洋参。
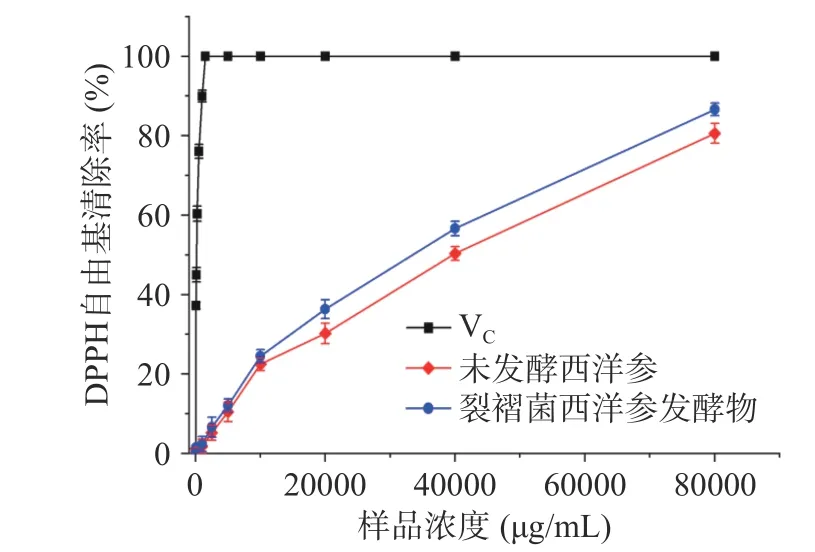
图6 DPPH 自由基清除曲线Fig.6 DPPH free radical removal curve
2.5.2 ABTS+体外抗氧化实验结果 如图7 所示,对照VC、西洋参发酵物和未发酵西洋参对ABTS+自由基均有清除作用,随着溶液浓度增加清除能力增强,其中VC溶液浓度从62.5 µg/mL 增加到1000 µg/mL时,对ABTS+自由基的清除率从29.83%增加到97.86%,后续浓度VC溶液对ABTS+自由基的清除率达到100%;西洋参发酵物待测溶液浓度从62.5 µg/mL 增加到80000 µg/mL 时,对ABTS+自由基的清除率从3.22%增加到89.71%,在相同浓度下未发酵西洋参待测溶液对ABTS+自由基的清除率从2.42%增加到82.57%。将各R 值与对应的溶液浓度,分别带入IC50计算器软件中进行计算。结果,VC的IC50值为87 µg/mL,西洋参发酵物的IC50值为10910 µg/mL,未发酵西洋参的IC50值为18713 µg/mL。因此,清除ABTS+自由基能力的强弱为:VC>西洋参发酵物>未发酵西洋参。虽然西洋参发酵物和未发酵西洋参较VC的清除ABTS+自由基的能力存在差距,但西洋参发酵物和未发酵西洋参具有抗氧化能力。由于,清除ABTS+自由基能力与清除DPPH 自由基能力呈极显著正相关[39],所以裂褶菌西洋参发酵物清除ABTS+自由基的能力好于未发酵西洋参。

图7 ABTS+自由基清除曲线Fig.7 ABTS+ free radical removal curve
3 结论
本研究以西洋参为原料,筛选适合裂褶菌菌种,通过单因素和响应面试验优化裂褶菌发酵西洋参工艺,得到优化条件:裂褶菌接种量10.9%,发酵温度31 ℃,发酵时间10 d,发酵pH5.9。结果显示:裂褶菌西洋参发酵物的总人参皂苷含量为10.28%,粗多糖含量为12.85%,总黄酮含量为0.67%,较未发酵西洋参的三者含量均有提高。并且大分子人参皂苷Rb1、Rg2和Re 含量降低,小分子人参皂苷Rg1、Rc、Rb2、Rd、Rg3、s-Rh2、r-Rh2和拟人参皂苷CK 含量升高。其中,稀有人参皂苷Rg3、s-Rh2、r-Rh2和拟人参皂苷CK 为新出现皂苷。抗氧化实验证明:裂褶菌西洋参发酵物的DPPH 和ABTS+自由基清除能力的IC50值分别为31365 和10910 µg/mL,均好于未发酵西洋参,但低于VC。本研究表明裂褶菌固态发酵西洋参能提高总人参皂苷、粗多糖、总黄酮和稀有人参皂苷的含量,增强其抗氧化能力,为西洋参的开发利用提供数据支持。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
