机械门控离子通道Piezo1 调节巨噬细胞参与炎症反应研究进展 *
2024-02-29谢亚飞杭黎华
谢亚飞 杭黎华
(江苏大学附属昆山医院麻醉科,苏州 215300)
炎症的主要临床表现为红、肿、热、痛以及功能丧失。当机体接受炎症因子刺激时,会引起局部血管经历短暂的收缩,导致血管通透性增加以及血管内液外渗。同时炎症介质可诱导免疫细胞黏附并从血管内皮迁移到损伤部位,导致炎症细胞浸润。此外,炎症介质还会激活痛觉感受器引起疼痛。作为炎症主要的特征,疼痛一方面向机体发出警告保护正常组织,另一方面通过神经系统引起神经源性炎症和神经炎症,最终危害大脑、心脏等重要器官,从而影响病人的劳动能力和生活质量,增加了社会和家庭的经济负担。目前的疼痛治疗方案仅对50%的病人有效,因此探索疼痛的不同作用机制,找到介导疼痛的新靶点一直是疼痛研究的重要方向[1]。
机械损伤是炎症的诱发因素之一,它贯穿于整个炎症病理过程。反复或持续的破坏性机械刺激会导致炎症性疾病,然而机械力诱发炎症的机制尚不完全清楚。既往的研究表明机械敏感受体存在于全身组织中,在影响细胞形态和功能方面起着重要作用[2]。压电型机械门控离子通道组件1 (piezo-type mechanosensitive ion channel component 1, Piezo1)是近年来发现的哺乳动物体内第一个机械门控阳离子通道,可对多种阳离子通透,尤其是Ca2+,这对接受机械性刺激的组织细胞的功能调控至关重要[3]。研究表明Piezo1 在炎症性疾病的发生和发展中起着至关重要的作用。巨噬细胞是先天免疫系统的多功能细胞,通过感受其微环境中的动态变化参与炎症反应。Piezo1 是巨噬细胞上显著表达的一类离子通道,是调控巨噬细胞功能的关键一环。本文就Piezo1 调控巨噬细胞参与炎症反应,参与多种炎症疾病的过程进行综述。Piezo1 调控巨噬细胞炎症反应在疾病中的重要作用是目前研究的热点之一。本文为方便研究者们更好地理解Piezo1 在炎症性疾病中的作用机制,深入研究Piezo1 调控巨噬细胞参与炎症反应的工作奠定基础。
一、Piezo 概述
生物在长期的进化过程中产生了一种可以将机械刺激转换成生物信号的高度保守机械敏感性装置即机械门控离子通道,它对听觉、痛觉、本体感觉、胚胎发生以及许多其他依赖机械感觉的生物功能起着至关重要的调控作用[4]。机械门控离子通道的概念最早由Corey 等[5]在牛蛙耳蜗毛细胞上记录到机械刺激产生的电流信号后提出。从此,研究者们开始寻找这一类离子通道,并进行深入研究。有研究表明生物体实现快速机械感受的主要途径是存在富含机械感受(mechanical sensation, MS)转导通道的专门感觉细胞[6]。Cox 等[6]研究发现了包括双孔钾通道(tandem-pore-domain potassium channels,K2P)、瞬时受体电位(transient receptor potential, TRP)通道家族等多种机械门控离子通道。但是由于生物体间的差异,哺乳动物机械门控离子通道的研究相对滞后。
直至2010 年,Coste 等[3]在小鼠神经母细胞瘤细胞系中发现了哺乳动物细胞中第一个产生兴奋性机械敏感阳离子电流并鉴定出了Piezo 蛋白家族。Piezo 蛋白家族是一类保守的真核机械门控离子通道,由Piezo1 和Piezo2 组成,参与包括触觉、本体感觉、痛觉等多种机械传导途径[7]。Piezo 通道是一种形似螺旋桨形状的同源三聚体,3 个亚基中38 个跨膜螺旋的异常弯曲排列共同形成了膜平面中的标志性纳米碗构型[8]。Piezo 通道分布广泛,目前已在脊椎动物的肺、膀胱、骨及背根神经节(dorsal root ganglia, DRG)神经元等部位发现其表达[9]。此类通道是一种非选择性阳离子通道,主要对Ca2+通透,此外还对K+、Na+、Mg2+等阳离子及对Cl-也有一定的通透性[3]。Piezo1 在许多经常接受机械刺激的器官中表达并发挥功能,如血管或淋巴管内皮细胞中的Piezo1 调节血管重塑、瓣膜形态形成和血压;成骨细胞中的Piezo1 过表达调节骨重塑;肺泡内皮细胞Piezo1 的激活可保护肺泡-毛细血管屏障结构的完整性;尿路上皮细胞中的 Piezo1 感应到尿液堆积而产生的管壁拉伸刺激后启动排尿反射并促进排尿等[10]。除此之外,Piezo1 的基因突变还可导致人类各个系统疾病的发生,如脱水遗传性干细胞症、先天性淋巴发育不良以及乳腺癌的进展等[11]。
Yoda1 是目前已知唯一的Piezo1 特异性激活剂[12]。Syeda 等[13]通过细胞电生理学实验证实Yoda1 可显著影响Piezo1 的敏感性,同时也可通过稳定已开放的通道减缓失活动力学,甚至在没有机械刺激的情况下,也可引起轻微的Piezo1 激活。Piezo1 的抑制剂有很多,包括钌红、淀粉样蛋白β、饱和脂肪酸、多不饱和脂肪酸以及GsMTx4 等,其中GsMTx4是当前应用最广泛的Piezo1抑制剂之一。GsMTx4 是一种蜘蛛毒液肽,可选择性地抑制属于Piezo 和TRP 通道家族的机械敏感性阳离子通道[12]。此外,Velasco-Estevez 等[14]研究证实GsMTx4 可抑制溶血磷脂酰胆碱(lyso-phosphatidylcholine, LPC)刺激Piezo1 引起的脱髓鞘作用及神经元损伤,同时GsMTx4 还可抑制LPC 所诱导的星形胶质细胞及小胶质细胞的活化。GsMTx4 是一种重要的药理学工具,在未来研究Piezo1 的生理学功能中至关重要。
二、巨噬细胞与炎症反应
巨噬细胞是体内吞噬作用最强的细胞,具有高度可塑性,在机体生长发育过程中主要发挥吞噬和抗原提呈作用,同时还参与调节炎症反应、血管生成等病理生理过程。受到刺激的巨噬细胞可极化为经典型巨噬细胞(M1 型、促炎型巨噬细胞)和替代性活化巨噬细胞(M2 型、抗炎型巨噬细胞)[15]。M1 型巨噬细胞通过分泌促炎性细胞因子和趋化因子(白细胞介素-6、白细胞介素-12 等),并专职提呈抗原,参与正向免疫应答,发挥免疫监视的功能[16]。M2 型巨噬细胞仅有较弱抗原提呈能力,并通过分泌抑制性细胞因子白细胞介素-10 或转化生长因子-β (transforming growth factor-β, TGF-β) 等下调免疫应答,在免疫调节中发挥重要作用[17]。机体在发生炎症反应时,细胞所处物理环境会发生显著改变,进而刺激巨噬细胞等免疫细胞上的机械敏感性受体,引起相应信号转导通路激活表现出免疫应答反应。
三、Piezo1 调节巨噬细胞参与炎症反应
1.信号通路
(1) Piezo1-CaMKII-Mst1/2-Rac1:巨噬细胞是一类具有吞噬作用的特殊免疫细胞。在细胞感染期间,巨噬细胞表面的Toll 样受体(Toll-like receptors,TLR)可识别入侵的微生物从而引起先天免疫应答反应。有研究表明,由TLR 激活的Hippo 激酶Mst1和Mst2 (Mst1/2)在巨噬细胞抗炎反应中发挥着关键作用[18]。Geng 等[19]使用大肠杆菌处理骨髓来源巨噬细胞(bone marrow-derived macrophages, BMDM)时发现Piezo1 与TLR4 的显影高度重合。进一步的实验发现,在感染性腹膜炎小鼠中构建盲肠结扎穿刺模型(cecum ligation and puncture, CLP)可致80%的Piezo1 敲除小鼠死亡,而仅有40%的Piezo1 野生型小鼠死亡。同时可观察到Piezo1 敲除小鼠的脾脏、肺、肝脏和肾脏的细菌感染显著高于Piezo1 野生型小鼠。这些结果表明,Piezo1 可能是通过调控TLR4 信号活化Mst1/2,从而调控巨噬细胞抗炎反应而发挥作用。
Piezo1 是一种主要对Ca2+通透的离子通道,激活后促进Ca2+流入细胞质,Yoda1 可加速这一进程[20]。钙/钙调素依赖的蛋白激酶II (Ca2+/calmodulin-dependent protein kinase II, CaMKII)是一种丝氨酸/苏氨酸蛋白激酶,它可以磷酸化细胞内的多种蛋白从而使细胞内的Ca2+浓度提高[21]。当用Yoda1处理生长在无钙培养基的BMDM 时,结果显示Mob1(Mst 生理底物)磷酸化减少,表明细胞外钙的去除可抑制Yoda1 诱导的Mst1/2 活化。这些结果提示Ca2+是Piezo1 激活激酶Mst1/2 的重要第二信使。当用自分泌肽-2 相关抑制肽(autocamtide-2-related inhibitory peptide, TFA,一种高度特异性和强效的CaMKII 抑制剂)处理巨噬细胞,结果表明抑制CaMKII 可消除Yoda1 对Piezo1 的激活作用[19]。这些结果表明,机械激活的离子通道Piezo1 通过钙信号诱导的CaMKII-Mst1/2 轴的激活来调节巨噬细胞的杀菌活性。
巨噬细胞的吞噬作用主要取决于肌动蛋白细胞骨架的重组。这一过程受小GTP 酶蛋白家族的调节。Rac1 是小GTP 酶蛋白家族的代表性分子,当使用Yoda1 处理BMDM 时发现只有Rac1 被激活,并且激活的程度在Piezo1 缺陷型和野生型小鼠中有显著差异,但是在Mst1/2 缺陷的BMDM 中施加Yoda1处理后并没有观察到野生型BMDM 中Rac1-GTP(Rac1 的活化形式)量的增加[19]。这些结果表明,Piezo1 通过激活巨噬细胞Mst1/2,从而调控Rac1介导信号转导增强巨噬细胞吞噬细菌的作用。脂多糖(lipopolysaccharides, LPS)刺激或大肠杆菌感染促进了相应的TLR4 受体与机械传感器Piezo1 的结合,以诱导钙内流,激活CaMKII-Mst1/2-Rac1 轴来调节巨噬细胞的杀菌活性。抑制CaMKII 或敲除Mst1/2或Rac1 会导致细菌清除率降低,可产生与Piezo1缺乏相同的后果[19]。
以上研究表明,细菌感染或LPS 刺激时,巨噬细胞的Piezo1 活化可通过介导Ca2+内流,进而激活胞内CaMKII-Mst1/2-Rac1 通路调控巨噬细胞参与炎症反应,保护机体免受损害(见图1)。
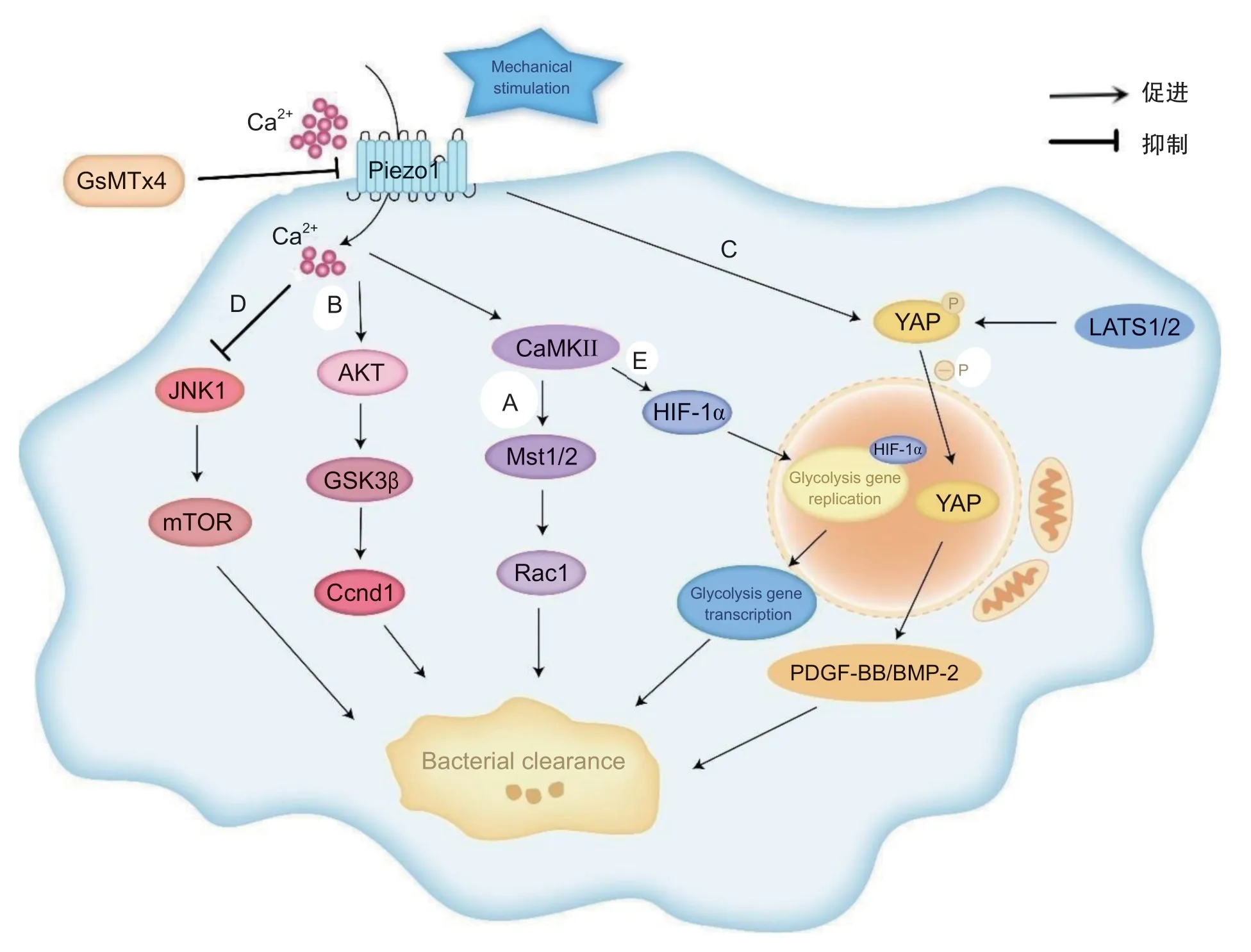
图1 Piezo1 信号通路调节巨噬细胞炎症反应示意图
(2)Piezo1-AKT-GSK3β-Ccnd1:巨噬细胞在接受机械刺激并向M1 型转化后,可在局部炎症微环境中发挥调节正畸牙齿移动(orthodontic tooth movement, OTM)的作用[22]。Xu 等[23]构建了OTM 模型,并通过该模型发现机械刺激可在人和小鼠中显著诱导巨噬细胞增殖,并且上调BMDM 中Piezo1 的表达参与炎症反应。使用Piezo1 抑制剂或者敲除Piezo1 可减少巨噬细胞增殖进而延缓OTM,减弱杀菌活性。
Cyclin D1 (Ccnd1)是一种调节细胞周期不可或缺的蛋白质,是Piezo1 激活的AKT-GSK3β 通路的潜在下游靶因子,通过增强Rb 磷酸化促进巨噬细胞发挥抗炎作用[23]。Xu 等[23]在Ccnd1 敲除的转基因小鼠中研究发现, Ccnd1 敲除可降低机械力刺激所致的巨噬细胞活化及Rb 磷酸化,抑制牙周巨噬细胞的增殖,进而延迟OTM,而Ccnd1 的过表达可明显刺激巨噬细胞增殖,从而逆转因Piezo1 拮抗剂GsMTx4 抑制的巨噬细胞杀菌能力。当BMDM 受机械刺激后,Piezo1 活化导致Ca2+内流,细胞内Ca2+浓度显著升高,可激活下游AKT-GSK3β-Ccnd1 轴促进巨噬细胞增殖,该增殖是OTM 期间巨噬细胞发挥抗炎作用的关键过程(见图1)。
(3)Piezo1-YAP:最近的研究发现,巨噬细胞极化状态的变化和细胞因子的分泌是促进成骨和血管生成的潜在机制[24]。在骨科手术中,生物材料置入会刺激巨噬细胞极化,进而产生炎症-组织增殖-组织成熟这一连续的先天免疫反应[25]。有研究表明,M1 巨噬细胞可分泌血管内皮生长因子(vascular endothelial growth factor, VEGF)促进血管的萌发和延伸。M2 巨噬细胞分泌血小板衍生生长因子-BB(platelet derived growth factor-BB, PDGF-BB)和骨形态发生蛋白-2 (bone morphogenetic proteins-2, BMP-2)有助于血管成熟、稳定和成骨[25]。Luo 等[25]研究提示骨置入材料在早期可将巨噬细胞极化为促炎型(M1),而在后期可将巨噬细胞极化为抗炎型(M2),从而在更大程度上促进骨缺损中的成熟骨的形成。巨噬细胞的抗炎型增加(即M2 多于M1),最终可缓解机体的炎症反应。
静息状态下,巨噬细胞内LATS1/2 可调控YAP磷酸化并抑制其生物学活性。当细胞接受刺激后可致YAP 发生去磷酸化并转运至细胞核发挥作用,调节巨噬细胞参与炎症反应[25]。Tang 等[26]研究发现用Ti2448 预处理的巨噬细胞可通过增加PDGF-BB和BMP-2 分泌,显著促进血管生成和成骨分化,从而证实Ti2448 通过Piezo1-YAP 信号轴介导的巨噬细胞极化和相关细胞因子分泌促进血管生成和成骨。在对生物置入性材料表面培养的巨噬细胞进行免疫荧光染色和免疫印迹后也发现表面的巨噬细胞表现出高Piezo1 和YAP 表达。该研究提示,当巨噬细胞表面的Piezo1 通道受到植入性材料的刺激后,导致细胞质中被LATS1/2 抑制的磷酸化的YAP发生去磷酸化并转运至细胞核,进而促进M1 型巨噬细胞向M2 型巨噬细胞转化,释放PDGF-BB 和BMP-2 调控炎症反应,从而促进血管生成和成骨作用(见图1)。
(4)Piezo1-JNK1-mTOR:小胶质细胞在受到LPS 刺激后可引发强烈的免疫反应。Liu 等[27]在高糖诱导的小胶质细胞炎症反应中发现,在不存在GsMTx4 的情况下,较高浓度的葡萄糖显著抑制小胶质细胞炎症反应。若给予GsMTx4 的干预,则显著增加了高浓度葡萄糖(≥60 mM)组中炎性介质的水平,并且葡萄糖浓度越高,GsMTx4 的作用越显著。有研究表明,JNK1 和mTOR 信号通路是参与细胞生存、增殖、运动和分化的主要分子机制,且这两种通路均受细胞内Ca2+信号调节,并已被证明参与Piezo1 的下游机制[28]。Liu 等[27]研究JNK1和mTOR 通路在依赖Ca2+增加的Piezo1 下游机制中的作用,结果显示随着葡萄糖浓度的增加,细胞合成代谢反应降低,表现出细胞内Ca2+水平的升高以及JNK1 和mTOR 的表达水平逐渐降低,当给予GsMTx4 的干预可增加JNK1 和mTOR 的表达,抵消高糖和LPS 的联合作用,增加促炎介质释放,恢复小胶质细胞功能。因此抑制Piezo1 通道减少Ca2+内流可通过JNK1-mTOR 信号通路减少高糖细胞毒性并恢复小胶质细胞介导的炎症反应(见图1)。
2.有氧糖酵解
有氧糖酵解是将葡萄糖转化为丙酮酸的过程,若该过程受到抑制则可影响巨噬细胞活化后的许多功能,如细胞因子分泌、吞噬作用等。有研究表明,M1 巨噬细胞的激活可导致代谢从氧化磷酸化转变为有氧糖酵解引起炎症反应[29]。当巨噬细胞所处微环境发生变化后,其表面的Piezo1 被激活将机械刺激信号转化为由Ca2+内流引起的免疫反应和代谢状态的改变。Leng 等[30]针对无钙培养基中的BMDM施加Yoda1 处理,结果发现巨噬细胞中HIF-1α(调节多种糖酵解相关基因表达的主要转录因子)及其核HIF-1α 蛋白水平降低,有氧糖酵解以及炎症因子分泌水平下降,产生与Piezo1 缺陷BMDM 相似的效应,提示HIF-1α 在Ca2+诱导的糖酵解代谢中的关键作用。
既往的研究证实由Piezo1 激活诱导的CaMKII激活参与维持HIF-1α 稳定[31]。Leng 等[30]发现LPS刺激可显著促进正常BMDM 中的CaMKII 磷酸化以及HIF-1α 水平的升高,施加KN93(CaMKII 酶活性抑制剂)处理后则产生相反结果。在使用siHIF-1α阻断BMDM 中HIF-1α 的翻译后,可观察到HIF-1α的下调消除了正常BMDM 和Piezo1 缺陷BMDM之间的差异。多种实验结果表明,当细胞微环境发生变化后,首先引起Piezo1 的激活增加Ca2+内流,通过Ca2+-CaMKII-HIF-1α 轴使HIF-1α 易位到细胞核并启动多个糖酵解基因的复制和转录,最终实现吞噬杀菌的作用(见图1)。
四、展望
Piezo1 是新型哺乳动物机械门控阳离子通道,是重要的膜蛋白,在机械刺激引起巨噬细胞环境变化从而导致的炎症反应中发挥着至关重要的作用。Piezo1 将机械损伤信号转化为巨噬细胞内炎症级联反应,以驱动炎症的发生。目前的研究表明,Piezo1 药物可作为治疗机械应激相关免疫炎症疾病的潜在靶点,是预防炎症的有力手段。但是,限于目前的研究水平,Piezo1 的药理作用仍然局限于溶解度和稳定性较差的低亲和力药物,如Yoda1 和GsMTx4,而这些药物并不适用于体内[20]。因此,需要研究人员做更多的工作来找到更多的治疗药物。
在外周感觉系统中,Piezo 是研究机械疼痛传导最有潜力的通道。既往的研究表明Piezo2 主要存在于背根神经节、三叉神经节等初级感觉神经元,参与部分机械疼痛反应,但是最近的研究发现,Piezo1 的mRNA 可在小鼠DRG 神经元中表达,并且证实Yoda1 通过激活DRG 神经元中的Piezo1,诱导细胞内钙的增加[32]。这些研究提示Piezo1 可能参与调控疼痛的过程。因此,进一步研究Piezo1在疼痛中的调控作用,可能为临床治疗疼痛提供一潜在靶位。
利益冲突声明:作者声明本文无利益冲突。
