电针预处理对切口痛大鼠中脑导水管周围灰质5-HT7 受体表达的影响*
2024-02-29吕志峰王洋吕楠任伟东李梦杰周友龙方
吕志峰王 洋吕 楠任伟东李梦杰 周友龙方 洁
(1 河南中医药大学第一附属医院麻醉科,郑州 450000;2河南中医药大学第一临床医学院,郑州 450000;3河南中医药大学第三临床医学院,郑州 450000)
术后疼痛严重影响病人术后康复,其中10%~50%的病人可由急性疼痛逐渐转变为慢性疼痛,严重影响病人的精神状态和生活质量[1]。随着舒适化医疗和加速康复外科理念的提出,如何安全有效缓解术后疼痛成为临床关注的重点。临床镇痛药物包括非甾体抗炎药、阿片类镇痛药、局部麻醉药等,但这些镇痛药物可引发诸多不良反应,如药物耐受、药物依赖、胃肠功能以及认知功能障碍等[2]。电针疗法以穴位针灸为基础,结合电流刺激,通过抑制疼痛信号传递、调节炎症因子释放、改善免疫细胞功能等方式发挥抗炎镇痛的作用[3]。然而,电针具体通过何种途径发挥镇痛作用目前尚未完全明确。
中脑导水管周围灰质(periaqueductal gray, PAG)是伤害性刺激的中继站,向上传递痛觉信息,向下调控疼痛反应。研究表明,其功能与PAG 释放的神经递质及表达的蛋白关系密切,包括5-羟色胺(5-hydroxytryptamine, 5-HT)、c-Fos 蛋白、5-HT7受体(5-HT7R)等[4]。c-Fos 是一种原癌基因,又被称为即刻早期反应基因,当机体受到外界刺激后,诱导神经元活性增加,c-Fos 蛋白表达明显升高,因此炎症因子c-Fos 蛋白通常被认为是神经元活性的标记蛋白[5]。5-HT 是单胺类神经递质,具有传递痛觉信息、调节体温、睡眠等功能。研究发现,其生理作用取决于作用受体亚型和作用部位[6]。5-HT7R 是5-HT 受体家族中最后发现的受体亚型,广泛存在于背根神经节、脊髓背角、PAG 等部位,表达于神经元细胞膜,参与情绪、学习记忆以及疼痛等功能调节[7]。因此我们推测电针镇痛可能与PAG 中5-HT7R的表达有关。
Brennan法是目前较成熟的术后急性疼痛模型,足趾部组织损伤使炎症介质及致痛因子释放增加,从而引起手术区域异位痛和痛觉敏感[8]。“环跳”穴和“足三里”穴分别是足少阳胆经和足阳明胃经的重要腧穴,针灸两穴均可达到疏通经络、改善气血、调节肢体功能之效[9]。因此,本研究通过重复电针预处理“足三里”和“环跳”穴,观察足趾部切口痛大鼠的行为学变化、脑脊液中5-HT 水平、PAG 中c-Fos 蛋白和5-HT7R 表达,探讨电针预处理缓解术后痛觉敏感的可能作用机制,为临床镇痛提供新思路、新方法。
方 法
1.实验动物及分组
本研究选择SPF 级雄性SD 大鼠40 只,7~10周龄,体重220~350 g,由北京华阜康生物科技股份有限公司提供(实验动物许可证号:SCXK (京)2019-0008)。该实验已通过河南中医药大学实验动物伦理委员会审批(实验动物伦理审查批准编号:DWLL202108007)。
大鼠在温度22℃ ~24℃、湿度50%~60%、12 h/12 h 昼夜环境下适应性饲养1 周,自由饮食水。将大鼠按随机数字表法随机均等分为四组(n= 10):对照组(Con 组,既不电针刺激也不造切口痛);切口痛模型组(IP 组,仅造切口疼痛模型);正常+电针预处理组(Con + EA 组,仅行电针预处理);模型+电针预处理组(IP + EA 组,造切口痛模型+电针预处理)。
2.主要仪器及试剂
华佗牌电子针疗仪(苏州医疗用品厂有限公司,SDZ-V 型),智能热板仪(合肥必海微软件科技有限公司,ZH-YLS-6BS),vonFrey 纤维丝(Danmic Global 公司,37450-275),华佗牌一次性针灸针(苏州医疗用品厂有限公司,222104),正置荧光显微镜(日本尼康),5-HT 酶联免疫吸附测定试剂盒(Elabscience,E-EL-0033c),兔抗5-HT7R 抗体(Immunoway 公司,YT4409),兔抗c-Fos 抗体(Immunoway 公司,YT0884),R-PE 偶联山羊抗兔IgG(武汉三鹰生物技术有限公司,SA00008-2)。
3.实验方法
(1)电针预处理:造模前,用大鼠固定器对大鼠加以固定,参照大鼠穴位图谱,电针刺激Con + EA组和IP + EA 组大鼠右侧“足三里”和“环跳”穴(频率为2/10 Hz 的疏密波,刺激强度数值为1 档,每日1 次30 min),以大鼠右后肢随着电针频率轻微抖动作为电针刺激有效的标志,每日1 次,同一时间点连续刺激5 天。
(2)足趾部切口痛大鼠模型:最后一次电针刺激24 h 后,2%异氟烷吸入麻醉大鼠,常规消毒,按Brennan 法建立足趾部切口痛模型:沿大鼠趾部方向,在大鼠右足跟近端0.5 cm 处划一纵行切口,长度约1 cm,划开皮肤、皮下筋膜,暴露肌肉,用镊子分离并挑起肌肉,棉签按压止血,规范缝合皮肤,术后碘伏消毒并涂抹红霉素软膏。
(3)机械刺激缩足反射阈值(mechanical withdrawal threshold, MWT)测定:分别在第1 次电针预处理前2 h (T1)、术前2 h (T2)、术后4 h (T3)、术后24 h (T4)时测定MWT,采用标准化的vonFrey 纤维针刺激大鼠右后趾部切口附近区域,当纤维丝弯曲为S 形,持续6~8 s,观察大鼠缩足反应。选取0.4 g、0.6 g、1.0 g、1.4 g、2 g、4 g、6 g、8 g、10 g、15 g 这10 根纤维丝,参照up-and-down 法,首先选取2.0 g 均匀缓慢用力,当大鼠右足出现躲闪、抬起或舔咬,用“X”表示,接下来选择低一等级的纤维丝;否用“O”表示,接着选高一等级的纤维丝。当首次出现“XO”或“OX”时,再继续测试4 次,并记录最后一次使用的纤维丝强度,计算50%机械缩足阈值。若实验中出现0.4 g 仍有阳性反应或15 g仍为阴性反应,则刺激强度为0.4 g 或15 g。每个时间点测量3 次,每次间隔5 min,取其平均值。50%机械缩足阈值= (10[Xf+kδ])/10000(Xf 为最后一次使用的纤维针的log 值;k 为不同序列对应值;δ 为所用刺激强度的log 值均差,此处约为0.174)。
(4)热痛阈值测定:使用智能热板仪测定大鼠热缩足潜伏期(thermal withdrawal latency, TWL)。设置热板仪温度为52℃±0.2℃,达到温度后将其右后足贴于热板,同时开始计时,当大鼠有明显逃避动作时记时结束,终止时间为30 s。每个时间点测量3 次,每次间隔15 min,取其平均值,测定时间点与MWT 时间点一致。
(5)脑脊液提取:在最后一次行为学测试后,用2%异氟烷将大鼠麻醉后固定至合适状态,剃去头背部毛发,切开皮肤,找到枕骨隆凸解剖位置,用1 ml 注射器滑至枕骨大孔后,针尖斜面向上,与头部保持135°缓慢进针,待感受到明显的落空感时,停止进针,缓慢抽取脑脊液。后续将脑脊液置入4℃低温高速离心机进行离心,2500 rpm/min、20 min,取上清液至液氮速冻后于-80℃冰箱冻存。
(6)灌注、固定、取材:抽取脑脊液完成后,将大鼠改为仰卧位,切开皮肤、胸骨,暴露心脏,针头经左心室进入升主动脉,剪开右心耳,依次推注0.9%氯化钠注射液及4%多聚甲醛固定液进行心脏灌注。灌注完毕后剪开头部皮肤,打开颅骨,取出脑组织,置于4%多聚甲醛固定液中待测。
(7)酶联免疫吸附(ELISA):依据 ELISA 说明,先后加入脑脊液及生物素标记抗体进行反应,随后磷酸缓冲盐溶液(phosphate buffer saline, PBS),洗去未结合物质,加入辣根过氧化物酶(horseradish peroxidase, HRP)复合物,再次洗涤后依次加入3, 3',5, 5'-四甲基联苯胺(3, 3', 5, 5'-tetramethylbenzidine,TMB)显色液及终止液,在450 nm 波长检测样本吸光度并制作标准曲线,根据标准曲线计算5-HT 含量。
(8)免疫组化及免疫荧光:取固定的脑组织标本,洗涤脱水后石蜡包埋制备切片,脱蜡消除内源性过氧化物酶影响后蒸馏水清洗,PBS 浸泡,正常血清封闭非特异性位点后,加入c-Fos 或5-HT7R 抗体工作液,过夜孵育,PBS 冲洗后加入二抗,后续进行显色、复染、脱水、透明、制片等步骤,置于显微镜观察拍照,使用Image J 软件分析结果。
4.统计学分析
采用SPSS 26.0 统计学软件进行数据分析,计量资料用均数±标准差(±SD)表示,两组间比较采用两独立样本t检验,三组或三组以上比较采用单因素方差分析,组间比较采用LSD 检验,P<0.05 表示差异有统计学意义。
结 果
1.电针预处理对切口痛大鼠MWT 影响
四组大鼠不同时间点MWT 比较见图1。在T1、T2时间点,四组大鼠两两相比,MWT均无明显差异。T3、T4 时间点,与Con 组相比,IP 组痛阈值显著降低(P< 0.01);与IP 组相比,IP + EA 组大鼠的痛阈值明显升高(P< 0.05)。表明电针预处理可提高切口痛大鼠MWT,缓解机械性痛觉敏感。
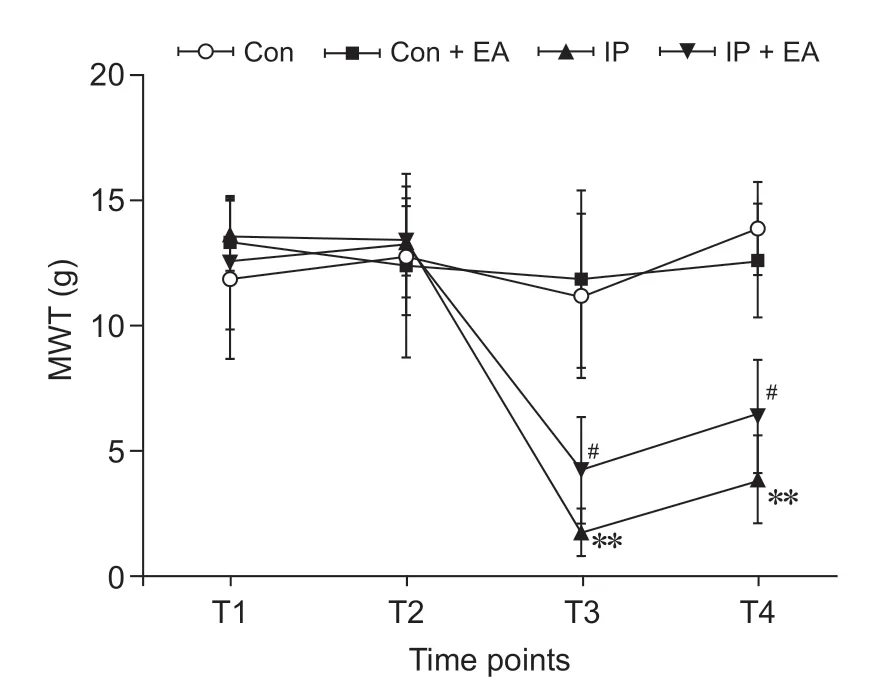
图1 四组大鼠四个时间点MWT 比较(n = 10,±SD)**P < 0.01,与Con 组相比;#P < 0.05,与IP 组相比Fig.1 Comparison of MWT at four time points in each group of rats (n = 10,±SD)**P < 0.01, compared with group Con; #P < 0.05,compared with group IP.
2.电针预处理对切口痛大鼠TWL 影响
四组大鼠不同时间点TWL 比较见图2。在T1、T2 时间点,四组大鼠两两相比,TWL 均无明显差异。T3、T4 时间点,与Con 组相比,IP 组痛阈值明显降低(P< 0.05);与IP 组相比,IP + EA 组大鼠痛阈值显著升高(P< 0.01)。表明电针预处理可提高切口痛大鼠TWL,缓解热痛觉敏感。

图2 四组大鼠四个时间点TWL比较(n= 10,±SD)*P< 0.05,与Con组相比; ##P< 0.01,与IP 组相比Fig.2 Comparison of TWL at four time points in each group of rats(n=10,x±SD)*P< 0.05,comparedwith group Con; ##P < 0.01,compared with group IP.
3.电针预处理对切口痛大鼠脑脊液中5-HT 表达影响
ELISA 法检测四组大鼠脑脊液中5-HT 浓度含量,结果见图3。与Con 组相比,IP 组和IP + EA组大鼠脑脊液中5-HT 的浓度均显著升高(P< 0.01),Con + EA 组脑脊液中5-HT 的浓度高于Con 组(P<0.05);其余各组两两相比,均无显著性差异。
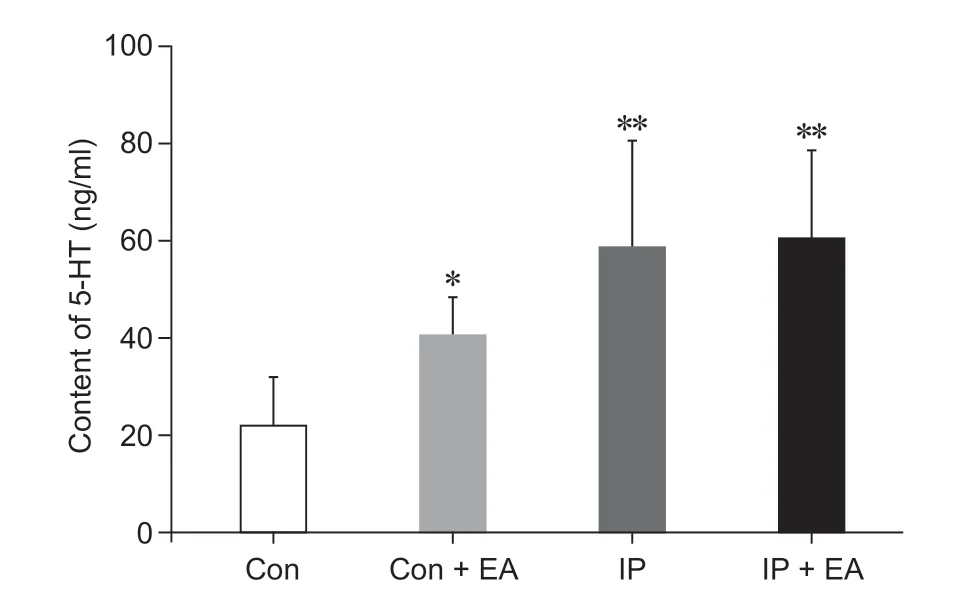
图3 四组大鼠脑脊液中5-HT 浓度比较(n = 3,±SD)*P < 0.05,**P < 0.01,与Con 组相比Fig.3 Comparison of 5-HT concentrations in cerebrospinal fluid of rats (n = 3,±SD)*P < 0.05, **P < 0.01, compared with group Con.
4.电针预处理对切口痛大鼠PAG 中c-Fos 蛋白表达影响
四组大鼠PAG 中c-Fos 蛋白免疫组化见图4。与Con 组相比,IP 组大鼠PAG 中c-Fos 蛋白表达显著增多(P< 0.01);与IP 组相比,IP + EA 组大鼠PAG 中c-Fos 蛋白明显减少(P< 0.05);其余两两相比差异无统计学意义(见图5)。表明在疼痛状态下,机体c-Fos 蛋白合成明显增加,而电针预处理可减少切口痛大鼠PAG 中c-Fos 蛋白表达。

图4 四组大鼠PAG 中c-Fos 蛋白表达黑色箭头指向c-Fos 蛋白,标尺= 50 μm,放大倍数×400Fig.4 Expression of c-Fos protein in the PAG of rats The black arrows indicate c-Fos protein.Scale bar =50 μm, magnification ×400.
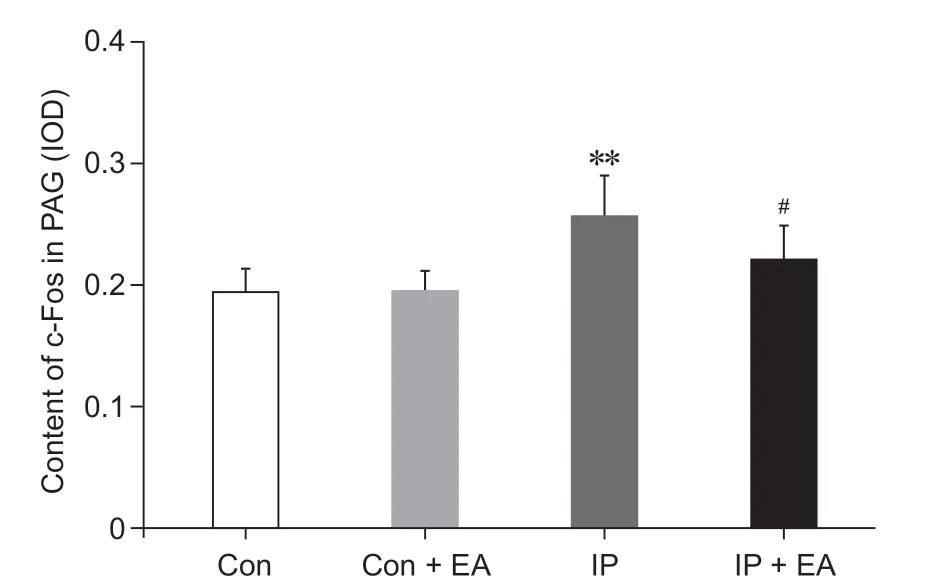
图5 四组大鼠PAG 中c-Fos 蛋白含量比较(n = 3,±SD)#**P < 0.01,与Con 组相比;P < 0.05,与IP 组相比Fig.5 Comparison of c-Fos protein content in the PAG of rats (n = 3,±SD)**P < 0.01, compared with group Con;#P < 0.05,compared with group IP.
5.电针预处理对切口痛大鼠PAG 中5-HT7R 表达影响
四组大鼠PAG 中5-HT7R 免疫荧光见图6。与Con 组相比,Con + EA 组、IP 组、IP + EA 组PAG中5-HT7R 的表达明显上调(P< 0.05);与IP 组相比,IP + EA 组PAG 中5-HT7R 的表达明显增多(P< 0.05,见图7),表明电针预处理可上调切口痛大鼠PAG中5-HT7R 表达。

图6 四组大鼠PAG 中5-HT7R 蛋白表达白色箭头指向5-HT7R 蛋白,标尺 = 50 μm,放大倍数 ×400Fig.6 Expression of 5-HT7R protein in the PAG of rats The white arrows indicate 5-HT7R protein, Scale bar =50 μm, magnification ×400.
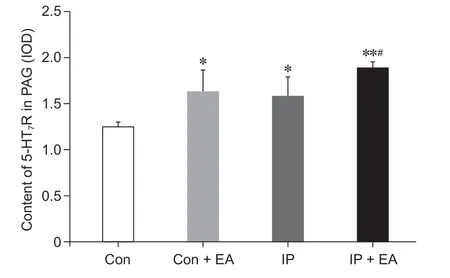
图7 四组大鼠PAG 中5-HT7R 蛋白含量比较(n = 3,±SD)*P < 0.05,**P < 0.01,与Con 组相比;#P < 0.05,与IP 组相比Fig.7 Comparison of 5-HT7R protein content in PAG of rats(n = 3,±SD)*P < 0.05, **P < 0.01, compared with group Con;#P < 0.05, compared with group IP.
讨 论
电针刺激是一种物理疗法,不良反应小、无依赖性,对疼痛的预防性治疗疗效显著。研究发现,在足底切口痛大鼠模型中分别用电针和吗啡进行多次干预,电针和吗啡均可通过激活阿片类受体,抑制脊髓背角处c-Fos 蛋白表达,发挥镇痛作用;但多次吗啡注射出现耐药性,而重复电针治疗可使镇痛效应累积[10]。研究证实,在适量情况下重复电针刺激可抑制脊髓内胶质细胞活化,促进脑干区域部分神经元兴奋,合成释放多种镇痛物质,重构突触结构,继而实现镇痛效应的累积[11]。另有研究发现,不同频率电针镇痛效果不同,这也说明电针镇痛存在优势频率或优势波[12]。相关临床研究证实在术后疼痛中,疏密波镇痛效果优于连续波,因此本研究以重复电针预处理为干预手段,选取2/10 Hz 疏密波,刺激强度数值为1 档,每日1 次30 min,连续刺激5 天,以达到累积镇痛效果。通过测定大鼠的MWT 和TWL 观察其行为学变化,在T3、T4 时间点,与Con 组相比,IP 组大鼠的MWT 和TWL 均明显降低;与IP 组相比,IP + EA 组大鼠痛阈值明显升高,说明电针干预具有镇痛效果,可明显改善术后疼痛引起的痛觉敏化现象。
正常生理状态下,细胞中很少有c-Fos 蛋白表达,在受到外界刺激后,短期内中枢神经系统神经元活化,机体内c-Fos 基因被迅速激活,经过转录、翻译等一系列过程,合成c-Fos 蛋白。c-Fos 蛋白参与机体多种生理活动,包括大脑发育、学习记忆、细胞增殖分化、信号转导和疼痛调控等[13]。相关研究发现,在偏头痛大鼠模型中PAG 内c-Fos 蛋白显著升高,而电针预处理可明显减少c-Fos 蛋白表达[14]。本研究中,通过免疫组化检测各组大鼠术后24 h 时PAG 中c-Fos 蛋白表达,发现与Con 组相比,IP 组大鼠PAG 中c-Fos 蛋白表达显著上升;与IP 组相比,IP + EA 组大鼠的c-Fos 蛋白表达有所下调,这与大鼠痛阈值变化相一致,显示电针预处理可下调大鼠PAG中c-Fos 蛋白,缓解术后疼痛引起的痛觉敏感现象。
研究表明在疼痛模型中,中枢核团和脑脊液内5-HT 含量明显增加,这说明机体可自主合成释放5-HT 来对抗疼痛[15]。然而,5-HT 对疼痛调节作用取决于其所处部位、作用受体亚型、疼痛模型等,并不是单一高浓度抑痛、低浓度促痛或者外周促痛、中枢镇痛[6]。Brenchat 等[16]发现在疼痛过程中PAG 内的5-HT7R 表达明显上调,说明疼痛刺激可以促进中枢神经系统中神经元表达5-HT7R。而应用5-HT7R 激动剂可以提高机体痛阈值,缓解疼痛[17]。本研究中,与Con 组相比,Con + EA 组、IP 组和IP + EA 组5-HT 及5-HT7R 表达均有所升高,其中IP + EA 组5-HT7R 活化程度更显著。这些实验结果与其他研究结果一致。切口痛可增加机体脑脊液中5-HT 浓度和PAG 中5-HT7R 蛋白表达,电针可上调PAG 中5-HT7R 的表达,这也说明电针预处理可能通过5-HT7R 抑制疼痛信号的传递从而发挥抗炎镇痛的作用。然而本研究仅提出了一种电针镇痛的可能机制,要明确这一镇痛机制,还需加入5-HT7R拮抗剂或激动剂来进一步行分子生物学验证;同时,对电针干预缓解术后痛觉敏感的最佳时机、最优方式也需进行探寻比较。
综上所述,切口痛大鼠手术区域可发生痛觉敏感,而电针预处理可明显提高切口痛大鼠MWT 和TWL,降低PAG 中c-Fos 蛋白表达,改善大鼠痛觉敏感现象。其镇痛机制可能与上调PAG 中5-HT7R蛋白表达有关。
利益冲突声明:作者声明本文无利益冲突。
