miR-125a靶向转录无调性碱性螺旋环螺旋转录因子8对肺腺癌恶性进展的影响
2024-02-02姜昌瑞张楚函刘洋李玥
姜昌瑞,张楚函,刘洋,李玥
(中国医科大学附属第一医院 1. 胸外科;2.输血科,沈阳 110001)
肺腺癌是起源于上皮组织的恶性肿瘤,在我国各种恶性肿瘤中发病率和死亡率居首位,与吸烟、空气污染、放射性暴露以及肺部真菌感染等密切相关[1]。绝大多数肺腺癌早期无明显症状,发现时已为晚期,治疗效果差,患者的5年生存率很低[2]。因此,发现和鉴定肺腺癌早期诊疗的分子标志物具有重要意义。
无调性碱性螺旋环螺旋转录因子8 (atonal homolog 8,ATOH8) 是碱性螺旋环螺旋转录因子超家族A组成员,能够与DNA E-box序列直接结合,调控多个下游基因的表达,参与胚胎发育、器官发育及多种肿瘤的发生发展[3-5]。然而,ATOH8在肺腺癌中的作用及潜在机制尚不清楚。因此,本研究通过在线数据库分析结合分子生物学实验探讨ATOH8在肺腺癌中的作用及异常表达的潜在调控机制,为发现肺腺癌的分子标志物奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 标本:30例肺腺癌及癌旁正常组织标本取自中国医科大学附属第一医院胸外科,术后立即置于液氮中保存备用。标本均经病理学检查确诊。所有患者知情同意,本研究获得医院医学伦理委员会批准。
1.1.2 细胞:人肺腺癌细胞系A549 (中科院上海细胞库)。
1.1.3 试剂:RPMI1640培养基及胎牛血清 (以色列BI生物科技有限公司);TRIzol和PCR相关试剂 (中国上海宝生物工程有限公司);SDS-PAGE凝胶配制试剂盒和ECL化学发光液 (中国上海碧云天生物科技发展有限公司);引物和ATOH8 siRNA (中国上海生工生物工程股份有限公司);兔源ATOH8抗体、鼠源GAPDH抗体、辣根过氧化物酶标记的山羊抗兔二抗和辣根过氧化物酶标记的山羊抗鼠二抗 (中国武汉三鹰生物技术有限公司);细胞转染试剂盒 (法国达科为生物技术有限公司);RIPA裂解液和蛋白上样缓冲液 (中国上海碧云天生物技术有限公司);蛋白Marker (美国赛默飞世尔科技有限公司);CCK-8(中国南京凯基生物科技有限公司);6孔板及96孔板(美国康宁生命科学有限公司)。
1.2 方法
1.2.1 实时PCR:应用TRIzol提取组织和细胞全RNA,按照逆转录试剂盒说明书将mRNA逆转录为cDNA。以cDNA为模板进行PCR,体系配制参考TB Green Real-time PCR试剂盒说明书。每个样本设置3个复孔。以2-ΔΔCT法计算相对表达量,以GAPDH作为内参,目的基因与内参基因表达量的比值表示目的基因相对表达水平。引物序列见表1。

表1 引物序列Tab.1 Primer sequences
1.2.2 细胞转染:收集对数增殖期的A549细胞,以2×105/孔接种于6孔板中,培养至融合度为70%~90%。按照jet-Prime (PolyPlus) 试剂说明书,将ATOH8 过表达载体及对照组转染人肺腺癌细胞,48 h后收集各组细胞进行转染效率分析和增殖能力检测。
1.2.3 Western blotting:收集细胞,加入50 μL的RIPA细胞裂解液,震荡混匀,冰上裂解20 min,在4 ℃离心机中12 000 r/min离心10 min。收集上清液,按照BCA蛋白定量试剂盒检测蛋白浓度。加入5×蛋白上样缓冲液并混匀,100 ℃煮沸5~10 min。经10% SDSPAGE凝胶分离后,转印至PVDF膜上。6%脱脂牛奶封闭1 h后,加入特异性一抗孵育过夜。第2天去除一抗并洗涤后,加入二抗,37 ℃孵育1 h,通过ECL化学发光法检测蛋白表达水平。
1.2.4 CCK-8法检测细胞迁移能力:胰蛋白酶消化转染后细胞,将5 000/mL细胞悬液接种于96孔板中,放置无菌培养箱中。分别于24 h、48 h、72 h、96 h加入CCK-8,并置于37 ℃培养箱继续培养2 h,酶标仪450 nm处检测吸光度。
1.3 在线数据库
利用UALCAN (https://ualcan.path.uab.edu) 数据库分析ATOH8在肺腺癌中的表达水平差异、启动子区甲基化水平及其与临床分期和TP53突变的关系。利用Timer 2.0 (https://cistrome.shinyapps.io/timer/) 分析ATOH8表达水平与肺腺癌5年生存率的关系。利用TargetScan (https://www.targetscan.org) 分析和预测能够与ATOH8上游结合的微RNA (microRNA,miRNA)。
1.4 统计学分析
采用SPSS 21.0统计软件进行统计分析,ATOH8在不同组织中的差异表达分析采用配对样本t检验,ATOH8和miR-125a在细胞中的表达水平差异分析及细胞增殖能力差异分析采用独立样本t检验,数据以±s表示,P< 0.05为差异有统计学意义。
2 结果
2.1 ATOH8在肺腺癌中表达下调
UALCAN数据库在线分析结果显示,ATOH8在包括肺腺癌在内的多种肿瘤中表达水平显著降低(图1A)。实时PCR检测ATOH8在肺腺癌中的表达水平,结果显示与癌旁正常组织相比,ATOH8在肺腺癌中表达水平显著下调 (P< 0.01,图1B)。此外,在肺腺癌患者中,长期吸烟者ATOH8表达水平更低(P< 0.05,图1C)。
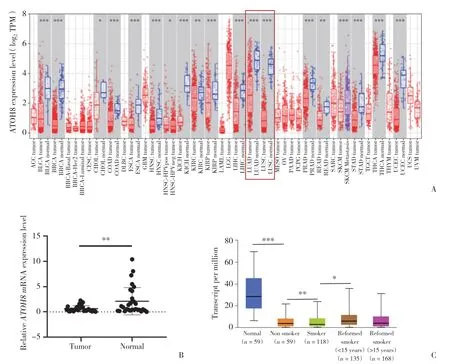
图1 ATOH8在肿瘤组织中表达水平的分析和检测结果Fig.1 ATOH8 expression levels in carcinoma tissues
2.2 ATOH8 能够抑制肺腺癌细胞的增殖能力
将ATOH8 过表达载体或对照组空载体质粒转染入A549细胞后48 h,实时PCR和Western blotting检测结果显示,ATOH8 过表达载体能够显著增加ATOH8mRNA和蛋白表达 (P< 0.05) (图2A、2B)。CCK-8检测结果显示,ATOH8 过表达能够显著抑制A549细胞的增殖能力 (P< 0.05),见图2C。
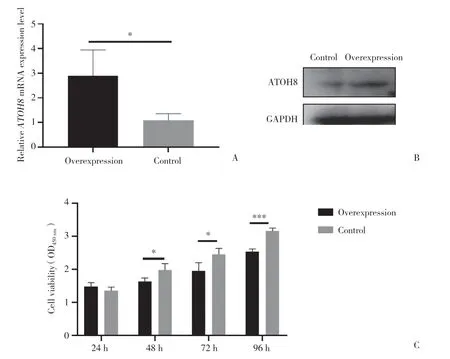
图2 ATOH8过表达能够降低肺腺癌细胞的增殖能力Fig.2 Effect of ATOH8 overexpression on lung adenocarcinoma cell survival
2.3 ATOH8表达水平与肺腺癌患者生存率的关系
TIMER数据库在线分析结果显示,ATOH8表达水平较高者5年生存率显著升高,见图3。

图3 ATOH8对肺腺癌患者生存率的影响Fig.3 Effect of ATOH8 expression levels on the survival of patients with lung adenocarcinoma
2.4 miR-125a靶向抑制ATOH8的表达
通过TargetScan预测,ATOH8的3’非翻译区 (untranslated regions,UTR) 存在多个具有潜在结合能力的miRNA。其中,miR-125a能够与ATOH8的3’UTR种属间保守区结合,且结合位点较多,提示miR-125a对ATOH8表达水平存在潜在的调控作用 (图4A)。因此,本研究将miR-125a 模拟物、抑制物及阴性对照转染A549细胞后48 h,实时PCR和Western blotting检测结果显示,miR-125a模拟物和抑制物能够分别显著抑制和促进ATOH8蛋白表达 (P< 0.05) (图4B、4C)。
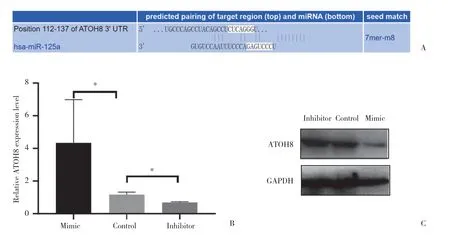
图4 miR-125a靶向抑制ATOH8表达水平Fig.4 miR-125a directly inhibits ATOH8 expression levels
2.5 miR-125a与肺腺癌进展密切相关
UALCAN数据库在线分析结果显示,miR-125a在肺腺癌中表达水平显著升高 (P< 0.05,图5A),在吸烟的肺腺癌人群中miR-125a表达水平显著升高(P< 0.05,图5B)。此外,miR-125a表达水平在中晚期和存在淋巴转移的肺腺癌中显著升高 (P< 0.05,图5C、5D)。

图5 miR-125a在肿瘤组织中表达水平与肺腺癌进展的关系Fig.5 The relationship between miR-125a and lung adenocarcinoma progression
3 讨论
转录因子也称为反式作用因子,能够与DNA 序列直接结合激活或抑制靶基因的表达,在癌症的发生和发展中具有重要作用[6]。ATOH8是碱性螺旋环螺旋转录因子,具有众多靶基因,在包括乳腺癌、肝癌和结直肠癌在内的多种肿瘤的发生发展中起作用[7-9]。除此之外,ATOH8还能够与脯氨酸和丝氨酸富集区域结合,调控P53和HEX等多个靶基因[10-11]。本研究发现ATOH8在肺腺癌中显著上调,且能够显著抑制肺腺癌细胞的增殖能力,与肺腺癌患者的5年生存率密切相关。提示ATOH8参与肺腺癌的发生发展,是潜在的抑癌基因,与CHEN等[12]在肝癌中的研究结果一致。然而,ATOH8在肺腺癌中表达失调的机制知之甚少。
miRNA是一类内源性的小RNA,长度约20~24 bp,能够通过与靶基因的3’UTR结合在转录后水平调控基因的表达,在细胞内具有多种重要的调节作用[13]。预测发现miR-125a能够与ATOH8的3’UTR种属间保守区结合,且结合位点较多,分子生物学验证结果显示miR-125a能够抑制ATOH8表达水平。研究[14]显示,miR-125家族成员miR-125a和miR-125b具有促癌和抑癌的双重作用。在结直肠癌中,miR-125a可通过HIF-1α抑制肿瘤细胞增殖和转移,发挥潜在的抑癌作用[15]。miR-125a能够抑制乳腺癌细胞自噬参与肿瘤进展的调控。miR-125a能够通过GALNT14抑制卵巢癌细胞的恶性增殖和侵袭[16]。然而,有研究[17]发现miR-125a能够通过p53抑制非小细胞肺癌凋亡。此外,血清中miR-125a表达水平可作为非小细胞肺癌的潜在诊断标志物[18]。本研究发现miR-125a表达水平与吸烟密切相关,且与肺腺癌的增殖和淋巴转移相关,是ATOH8在肺腺癌中表达失调的原因之一。
综上所述,本研究发现ATOH8在肺腺癌组织中下调,且能够抑制肺腺癌细胞的存活能力,是潜在的抑癌基因,参与肺腺癌的发生发展。miRNA是转录后调控基因表达水平的重要因子,经预测和鉴定发现miR-125a能够抑制ATOH8的表达水平,是ATOH8在肺腺癌中表达下调的潜在分子机制。生物信息学分析发现miR-125a受吸烟影响,且与肺腺癌的恶性进展和淋巴转移相关。但是,miR-125a下游靶基因及其影响的信号通路未被完全揭示,仍需更加深入全面的探讨。此外,ATOH8在肺腺癌中的靶基因及参与的信号通路也仍有待进一步研究。
