高盐饮食导致小鼠卵巢组织线粒体功能异常
2024-02-02侯恩太顾晓阳倪士峰李新宇乔杰
侯恩太,顾晓阳,倪士峰,李新宇,乔杰
(1. 北京大学第三医院妇产科生殖医学中心,北京 100191; 2. 国家妇产科疾病临床医学研究中心 (北京大学第三医院),北京 100191; 3. 辅助生殖教育部重点实验室 (北京大学),北京 100191; 4. 北京市生殖内分泌与辅助生殖技术重点实验室,北京 100191; 5. 西北大学生命科学学院中药系,西安 710069)
随着饮食方式的变化,特别是加工食品和快餐食品的消费量迅速增加,人们饮食中盐的摄入量也显著增加[1]。然而,摄入过量的盐通常被认为是高血压、心血管疾病等许多疾病的诱因[2]。这些高盐摄入导致的疾病有一个共同的病理表现,即相应器官组织的氧化应激增强和线粒体功能异常[3]。
高盐摄入还会抑制卵巢中卵泡的发育[4],然而高盐摄入对卵巢功能的影响及其机制尚不明确。本课题组的前期研究[5]发现,高盐饮食可导致小鼠卵巢组织中氧化应激增强,代谢模式改变。而卵巢氧化还原体系的平衡和代谢的稳态又与线粒体密切相关,线粒体是细胞代谢的中心,是细胞内活性氧(reactive oxygen species,ROS) 的主要来源,也是ROS攻击的重要靶点之一[5-6]。卵巢细胞线粒体的质量和数量是决定卵巢功能的关键因素。然而,目前尚不清楚高盐饮食后小鼠卵巢氧化应激增强和代谢模式改变是否会影响卵巢线粒体的功能。因此,本研究通过分析高盐饮食后小鼠卵巢组织中线粒体的功能,揭示高盐饮食影响小鼠卵巢组织线粒体功能的可能机制。
1 材料与方法
1.1 实验动物
20只雌性ICR小鼠,6周龄,购于北京维通利华实验动物技术有限公司。饲养环境温度20~23 ℃,湿度 (50±5) %。正常盐饲料AIN-93G (0.4% NaCl) 和高盐饲料 (AIN-93G+8%NaCl),均购于北京博泰宏达生物科技公司。正常盐饲料饲养1周后,将小鼠随机分成正常盐饮食 (NSD) 组和高盐饮食 (HSD) 组,每组10只。NSD组小鼠继续喂养正常盐饲料。HSD组小鼠在7周龄时改用高盐饲料。喂养4周后,从眼眶后静脉丛采集血样。血液采集后,室温静止30 min,之后4 ℃、1 600g离心10 min去除血凝块,血清等分于冻存管中,-80 ℃下保存。取出卵巢后立即用冷盐水冲洗,在液氮中快速冷冻,并在-80 ℃下保存。采用冷冻组织制备组织匀浆,用于活性测定、Western blotting和代谢物分析。本研究获得北京大学第三医院实验动物中心伦理委员会批准。
1.2 细胞培养
人卵巢颗粒细胞COV-434在含10%胎牛血清的高糖DMEM中培养,置于37 ℃、5%CO2的细胞培养箱内培养。正常培养基中的NaCl终浓度为139 mmol/L,高盐培养基中的NaCl终浓度为179 mmol/L。
1.3 ROS和H2O2水平的测定
1.3.1 组织中ROS含量的测定:将组织样品在冷HEPES缓冲液 (20 mmol/L,pH7.5) 中充分匀浆。匀浆液在4 ℃、12 000g离心30 min,取上清进行分析。使用BCA蛋白质测定试剂盒 (P0012S,上海碧云天生物技术有限公司) 测定上清蛋白浓度。将卵巢组织提取物 (100 μL) 与20 μmol/L 2,7-二氯二氢荧光素二乙酸盐 (H2DCFDA,美国Invitrogen公司) 孵育。酶标仪检测,激发光 488 nm,发射光 538 nm。ROS 相对含量=荧光强度/蛋白量 (100 μL卵巢组织提取液中蛋白含量)。
1.3.2 细胞中ROS含量的测定:细胞中ROS含量采用H2DCFDA测定。H2DCFDA母液用DMSO配制,母液浓度为10 mmol/L,-20 ℃避光保存。测定时用无血清无抗生素DMEM培养基稀释母液1 000 倍,即浓度为10 μmol/L的工作液。6孔板中,按1 mL/孔加入H2DCFDA工作液,37 ℃孵育30 min;弃H2DCFDA染色液,预冷的PBS清洗细胞3次;加入细胞裂解液,300 μL/孔,轻轻摇晃,让裂解液铺均匀,冰浴中裂解10 min,避光操作;小心刮取细胞,并将细胞悬液转移至1.5 mL EP管中,4 ℃、13 000g离心10 min;上清转移到新的EP管中,然后加样到96孔板,150 μL/孔,并用细胞裂解液作对照。酶标仪检测,激发光 488 nm,发射光538 nm;使用 BCA 试剂盒测定上清蛋白浓度。ROS相对含量=荧光强度/蛋白量 (150 μL细胞裂解上清中蛋白含量)。
1.3.3 组织和细胞中H2O2含量的测定:采用H2O2测定试剂盒 (S0038,上海碧云天生物技术有限公司),具体操作按说明书进行。
1.4 Western blotting
分析抗体及其稀释比例:超氧化物歧化酶 (superoxide dismutase,SOD) 1和SOD2 (1 ∶5 000)、Nrf2(1 ∶2 000),购自中国Proteintech公司;电子传递链复合物 (Complex) Ⅰ (1 ∶1 000)、Complex Ⅱ (1 ∶1 000)、Complex Ⅲ (1 ∶1 000)、Complex Ⅳ (1 ∶1 000)、Complex Ⅴ (1 ∶1 000),购自美国Abcam公司;β-actin (1 ∶5 000)、抗小鼠二抗 (1 ∶5 000)、抗兔二抗 (1 ∶5 000),购自美国CST公司。采用Thermo Super Signal West Pico试剂盒 (美国Thermo公司) 进行化学发光,使用ImageJ软件进行定量分析。
1.5 ATP含量测定
组织、血清和细胞中ATP含量的测定采用美国Promega公司试剂盒 (G7570),具体操作按照说明书进行。在Infinite M200 PRO酶标仪 (瑞士Tecan公司)中记录发光,积分时间为5 s/孔。
1.6 SOD和琥珀酸脱氢酶 (succinate dehydrogenase,SDH) 活性的测定
组织和细胞中SOD1和SOD2活性的测定按照试剂盒 (S0103,上海碧云天生物技术有限公司) 说明书进行。组织和细胞中SDH活性的测定按照试剂盒(A022-1-1,南京建成生物工程研究所) 说明书进行。
首先,在人才结构分布上,北京、天津、河北省的人才主要集聚在党政机关、企事业单位。河北省党政机关、企事业单位人才分布高达70%,而企业所需的高层次经营管理人才严重缺失,呈现出行业结构性失衡的特点。
1.7 统计学分析
使用GraphPad Prism 9.0软件进行数据处理。数据以±s表示,使用Student’st检验或方差分析进行比较。P< 0.05为差异有统计学意义。
2 结果
2.1 HSD组小鼠卵巢组织中ROS和H2O2 水平升高
本课题组前期研究发现,高盐饮食后小鼠卵巢组织氧化应激增强。为了进一步研究高盐饮食后卵巢组织氧化应激增强对卵巢组织线粒体功能的影响,本研究首先测定了高盐饮食后小鼠卵巢组织中ROS和H2O2的水平。结果发现,与NSD组相比,HSD组小鼠卵巢组织中ROS和H2O2水平显著升高 (P<0.01,图1A、1B)。这与本课题组前期研究的结果一致,即高盐饮食可导致小鼠卵巢组织中ROS积累。
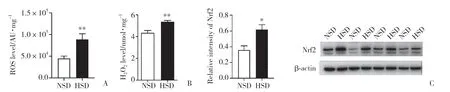
图1 高盐饮食后小鼠卵巢组织中ROS、H2O2水平和Nrf2蛋白表达水平Fig.1 ROS and H2O2 levels and Nrf2 protein expression level in mouse ovarian tissue after a high salt diet
为了进一步验证高盐饮食改变了卵巢组织氧化还原稳态,检测小鼠卵巢组织中Nrf2蛋白表达情况。结果发现,HSD组小鼠卵巢组织中Nrf2蛋白表达水平显著升高 (P< 0.05,图1 C)。
2.2 HSD组小鼠卵巢组织中SOD2的活性和表达水平升高
为了揭示高盐饮食导致的ROS增加对小鼠卵巢组织线粒体的影响,首先检测卵巢组织中SOD1和SOD2的活性和蛋白表达水平。结果发现,与NSD组相比,HSD组小鼠卵巢组织中SOD1的活性和蛋白表达水平呈上升趋势,但无统计学差异 (图2A、2C),而卵巢组织线粒体中SOD2的活性和蛋白表达水平显著升高 (P< 0.05,图2B、2C)。

图2 高盐饮食后小鼠卵巢组织线粒体中SOD1和SOD2的活性和表达水平Fig.2 Activities and expression level of SOD1 and SOD2 in mouse ovary mitochondria after a high salt diet
2.3 HSD组小鼠卵巢组织线粒体功能异常
进一步分析HSD组小鼠卵巢组织中ComplexⅠ~Ⅴ的表达水平,结果显示,与NSD组相比,HSD组小鼠卵巢组织中Complex Ⅰ表达水平显著下降 (P<0.05,图3A),但Complex Ⅴ表达水平显著升高 (P<0.05,图3A),Complex Ⅱ、Complex Ⅲ和Complex Ⅳ表达水平呈下降趋势,但无统计学差异 (图3 A)。

图3 高盐饮食后小鼠卵巢组织中线粒体电子传递链复合物表达水平和SDH活性以及卵巢组织和血清中ATP含量Fig.3 Expression level of mitochondrial electron transport chain complexes and SDH activity in the mouse ovary and ATP content in the mouse ovary and serum after a high salt diet
为了验证高盐饮食对卵巢组织线粒体功能的影响,分析小鼠卵巢组织中SDH活性。结果显示,与NSD组相比,HSD组小鼠卵巢组织中SDH活性显著降低 (P< 0.01,图3B)。
Complex Ⅰ~Ⅴ表达水平异常、SDH活性不足可能直接影响线粒体的三羧酸循环和ATP合成。为了进一步验证高盐饮食对卵巢组织线粒体功能的影响,分析小鼠血液和卵巢组织中ATP含量。结果显示,与NSD组相比,HSD组小鼠血清和卵巢组织中ATP含量显著下降 (P< 0.01,图3C、3D)。
2.4 高盐处理后COV-434细胞中ROS和H2O2 水平升高
为了进一步验证高盐对卵巢线粒体功能的影响,检测培养的COV-434细胞中ROS和H2O2水平。结果显示,高盐条件下培养的COV-434细胞中ROS和H2O2水平显著升高 (P< 0.01,图4)。

图4 高盐处理后COV-434细胞中ROS和H2O2水平Fig.4 Levels of ROS and H2O2 in COV-434 cells after a high salt treatment
2.5 高盐处理后COV-434细胞中SOD2的活性和表达水平增加
高盐处理后,COV-434细胞中 SOD2的活性和表达水平明显增加 (P< 0.05,图5)。细胞水平的结果说明,高盐处理后COV-434细胞中ROS升高影响到了线粒体,线粒体是ROS重要的转化部位。

图5 高盐处理后COV-434细胞中SOD2活性和表达水平Fig.5 Activity and expression level of SOD2 in COV-434 cells after a high salt treatment
2.6 高盐处理后COV-434细胞线粒体功能异常
在细胞水平上进一步分析高盐处理后COV-434细胞中Complex Ⅰ~Ⅳ表达水平、SDH活性以及ATP含量。结果显示,高盐处理后COV-434细胞中Complex Ⅰ和Complex Ⅱ表达水平显著下降 (P< 0.05,图6A),但Complex Ⅴ表达水平显著升高 (P< 0.05,图6A),SDH活性显著降低 (P< 0.01,图6B),ATP含量显著下降 (P< 0.01,图6C)。细胞水平的结果进一步验证了高盐可导致细胞线粒体功能异常。
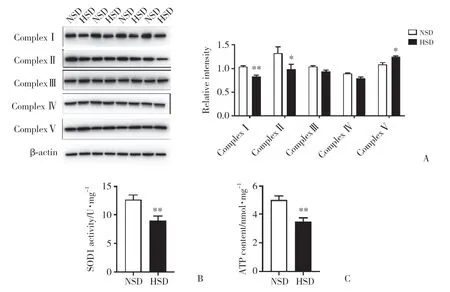
图6 高盐处理后COV-434细胞中线粒体电子传递链复合物表达水平、SDH活性和ATP含量Fig.6 Expression level of mitochondrial electron transport chain complexes,SDH activity,and ATP content in COV-434 cells after a high salt treatment
3 讨论
3.1 Complex表达异常可能是高盐饮食后卵巢线粒体功能紊乱的主要诱发因素之一
线粒体作为细胞的能量供给站,线粒体Complex Ⅰ~Ⅴ在电子传递过程中形成质子梯度,质子梯度驱动Complex Ⅴ合成ATP。Complex表达水平异常直接影响线粒体的功能[3]。Complex Ⅰ为线粒体呼吸链的第一个酶,作为主要的电子受体,其亚单位结构和功能损伤会引起线粒体氧化磷酸化功能失调,ATP供给能力下降[7]。本研究首次报道了高盐饮食可引起小鼠卵巢组织线粒体功能紊乱,这可能与高盐饮食后卵巢组织线粒体Complex Ⅰ亚单位表达水平降低有关。
SDH是连接氧化磷酸化与电子传递的枢纽之一,是唯一嵌入到线粒体内膜的酶,其活性一般可作为评价三羧酸循环运行程度的指标,是反映线粒体功能的标志酶之一[8]。高盐摄入后小鼠卵巢组织SDH活性显著降低,反映出高盐摄入破坏了线粒体氧化磷酸化与电子传递的稳态,导致三羧酸循环效率降低。而高盐摄入后小鼠卵巢组织线粒体ComplexⅤ表达水平升高可能为一种应激反应,以减少线粒体供能差异。
有研究[9]报道,小鼠卵母细胞中线粒体电子传递链的破坏可导致减数分裂纺锤体异常和胚胎植入前电位降低。本研究证实,高盐饮食导致线粒体Complex表达水平异常。高盐摄入是否影响小鼠卵母细胞的减数分裂,是需要进一步研究的问题。
3.2 高盐饮食与卵巢线粒体DNA突变
线粒体是影响卵母细胞质量的主要因素,在卵巢疾病、卵巢衰老等过程中均扮演重要角色[10]。线粒体内高水平的ROS自由基可能导致线粒体DNA突变,进一步导致线粒体DNA和核DNA在转录翻译功能性电子传递链蛋白时失去同步性,从而导致电子传递链部分解偶联[11-12]。事实上,线粒体DNA与电子传递链非常接近,缺乏保护性组蛋白,修复机制有限,线粒体DNA的突变率几乎是核DNA的25倍[13]。本研究发现,高盐摄入后卵巢组织ROS水平显著升高,增加的ROS进而可能导致线粒体DNA突变。而线粒体DNA突变又将进一步导致ROS积累和线粒体DNA突变增加[14]。上述恶性循环可能导致线粒体DNA突变呈指数级增加,其影响的线粒体功能异常范围可能从ATP减少到细胞周期停滞甚至凋亡[15]。因此,研究高盐饮食与卵巢组织线粒体DNA的关系可能有助于了解高盐影响卵巢功能和卵巢衰老的生物学机制。
氧化平衡通过多种酶促和非酶促防御机制 (如SOD、谷胱甘肽过氧化物酶和谷胱甘肽) 在体内得到控制。有趣的是,通过分析SOD1和SOD2的活性和表达水平,本研究发现仅线粒体特异的SOD2蛋白被显著诱导表达,表明线粒体可能在高盐诱导的氧化应激中具有关键作用,有必要进一步分析高盐饮食后线粒体内氧化还原体系的变化,揭示线粒体在高盐诱导的氧化应激中的作用机制。
综上所述,本研究首次报道了高盐饮食可导致小鼠卵巢组织线粒体氧化稳态失衡、电子传递链异常、三羧酸循环受阻、ATP水平不足等线粒体功能障碍。长期高盐摄入作为一种环境因素,可能通过损害线粒体功能和减少ATP的产生导致小鼠卵巢组织细胞凋亡甚至衰老。本研究为探讨摄入过量食盐导致卵巢损伤的机制提供了参考,并强调了控制盐摄入量的重要性。
