不同发育时期澳洲坚果叶片花青素分析
2024-02-02史鹏飞施蕊蔡婷婷李彪
史鹏飞 施蕊 蔡婷婷 李彪
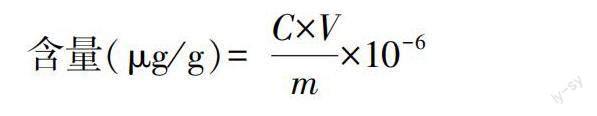



摘要 [目的]探究不同發育时期澳洲坚果叶片花青素的含量变化。[方法]以云南省临沧市澳洲坚果种植基地广泛种植的优良品种O.C.为研究材料,利用超高效液相色谱-串联质谱(UPLC-MS/MS)检测不同发育时期(开花后30、60、90d,分别标记为S、S、S)澳洲坚果叶片花青素含量。[结果]澳洲坚果叶片中共检测出108种代谢产物,S较S共有7种显著差异代谢物质,S较S共有18种显著差异代谢物质,S较S共有20种显著差异代谢物质。以S为对照,S有1个物质含量上调,5个物质含量下调;而S有5个物质含量上调,13个物质含量下调。以S为对照,S有6个物质含量上调,14个物质含量下调。S、S、S样品比较,共有6种显著差异代谢物,分别是芍药花色素-3-O-半乳糖苷、芍药花色素-3-O-阿拉伯糖苷、锦葵色素-3-O-半乳糖苷、锦葵色素-3-O-阿拉伯糖苷、锦葵色素-3-O-葡萄糖苷和柚皮素,且这6种共有显著差异代谢物主要在S时期合成,且含量随着叶片的生长而下降。[结论]该研究结果为坚果叶片的高值化利用提供了新思路。
关键词 澳洲坚果叶片;不同发育时期;花青素含量
中图分类号 TS255.7
文献标识码 A
文章编号 0517-6611(2024)02-0181-06
doi:10.3969/j.issn.0517-6611.2024.02.040
开放科学(资源服务)标识码(OSID):
Analysis of Anthocyanins in Macadamia Leaves at Different Developmental Stages
SHI Peng-fei,SHI Rui,CAI Ting-ting et al
(1.Key Laboratory for Forest Resources Conservation and Utilization in the Southwest Mountains of China,Ministry of Education/International Ecological Foresty Research Center of Kunming/Forestry College of Southwest Forestry University,Kunming,Yunnan650224;2.Yunnan Forestry Technological College,Kunming,Yunnan650224)
Abstract [Objective]To explore the changes of anthocyanin content in macadamia leaves at different developmental stages.[Method]Using the excellent variety O.C.widely planted in the Macadamia nut planting base in Lincang City of Yunnan Province as the research material,the anthocyanin content of macadamia leaves at different developmental stages (30,60,and90days after flowering,labeled as S,Sand S) was detected using ultra high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS).[Result]A total of108metabolites were detected in macadamia leaves.There were7significantly different metabolites in Scompared with S,18significantly different metabolites in Scompared with S,and20significantly different metabolites in Scompared with S.Taking Sas the control,the content of1substance was up-regulated and the content of5substances was down-regulated in S,and5substances were up-regulated and13substances were down-regulated in S.Compared with S,Shad6substances up-regulated and14substances down-regulated.Compared with the three samples S,Sand S,there were6significantly different metabolites,which were paeoniflorin3-O-galactoside,paeoniflorin3-O-arabinoside,malva pigment-3-O-galactoside,malva pigment-3-O-arabinoside,malva pigment-3-O-glucoside and naringenin.The metabolites were mainly synthesized in Speriod,and their contents decreased with the growth of leaves.[Conclusion]The results of this study provide new ideas for high value utilization of nut leaves.
Key words Macadamia leaves;Different developmental stages;Anthocyanin content
基金项目 国家自然科学基金项目(32260720);国家重点研发计划项目 (2021YFD1000202);国家现代农业产业技术体系(CARS-21-05B);云南省重大科技专项(202102AE090042,202002AA10007,2019ZG00901);云南省千人计划高端外国专家专项(2019013);云南省级财政林业科技推广示范专项(〔2020〕ts09号);外专引智项目(G2021039002,202105AQ130011);昆明市科技揭榜制项目(2021JH002)。
作者简介 史鹏飞(1987—),男,河北沧州人,经济师,硕士,从事林业项目管理及造林技术研究。*通信作者,高级工程师,博士,从事林业工程技术及农林病虫害防治研究。
收稿日期 2022-12-01;修回日期 2023-02-14
澳洲坚果(Macadamia integrifolia F.Mull),又称夏威夷果,原产于澳大利亚,属山龙眼科(Proteaceae)澳洲坚果属(Macadamia)常绿乔木果树。1979年开始进行环境适应性试验发展至今,我国已成为世界上澳洲坚果种植面积最大的国家。经过近40年的研究与发展,我国澳洲坚果种植面积已超越澳大利亚和南非,广东、广西、云南、福建、四川、重庆、贵州等地已均有种植。我国已成为澳洲坚果种植面积最大的国家,对此相关研究也日益增多。当前,国内外对澳洲坚果的研究主要集中于种植技术、病虫害防治、果仁油脂加工及副产物的综合利用等,但对叶片的相关报道相对比较少。Stephenson等研究了澳洲坚果产量与叶片营养状况、气候、品种、土壤等的关系,而Herbert等对昆士兰东南部澳洲坚果叶片中氮、钾、磷、钙、硼等的营养水平季节性模式进行研究。已有研究表明,植物叶片中含有丰富的花青素等活性成分,如芒果、番石榴等。
花青素广泛存在于开花植物(被子植物)中,是一种酚类化合物,据统计,花青素广泛存在于27个科73个属植物中。酚类化合物是植物界中最重要的族群之一,是植物中含量最高的次生代谢产物,通常以酯或糖苷形式存在。花青素的基本结构为3,5,7-羟基-2-苯基苯并芘喃,大多数花青素在花色基元的3-、5-、7-碳位上有取代羟基。由于其结构中R1和R2碳位上的取代基不同,形成了各种各样的花青素,目前已知的有20种花青素,在植物中常见的有6种,分别为天竺葵素、矢车菊素、飞燕草素、芍药花色素、矮牵牛素和锦葵色素。研究表明,花青素与植物抗逆性相关,能提高植物抗低温、干旱和强光等逆境的能力,降低植物紫外辐射和病害的程度,保护植物,减轻损伤。同时,因其具有清除自由基、提高抗氧化性、保护血管、降低血脂、抗肿瘤等一系列生理功能,被广泛应用于药品、保健品、化妆品以及动物生产等领域。澳洲坚果在种植的过程中修枝整形是树形管理的重要手段,修剪下来的大部分树叶都没有被充分利用,近年来有澳洲坚果叶茶的研究,澳洲坚果叶茶中酚类物质占总挥发性成分的36.86%,说明澳洲坚果叶中的花青素对澳洲坚果叶茶中的香气具有重要的贡献,且部分花青素具有抗氧化作用。相关研究利用气相色谱-质谱联用仪鉴定澳洲坚果幼叶挥发性成分,由此鉴定出对羟基苯甲醛、3,5-二叔丁级-4-羟基苯甲醛2种酚类挥发性成分。因此,该研究采用代谢组学方法,探究不同发育时期澳洲坚果叶片花青素的含量和代谢途径,为坚果叶片花青素在澳洲坚果叶茶、药品、化妆品等方面的开发利用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试材料。从云南省临沧市大雪山乡澳洲坚果种植基地(24°02′N,99°44′E)选取长势良好、叶片无病虫害的O.C.品种澳洲坚果树,根据澳洲坚果叶片不同发育时期花青素含量的变化,分别采集花后30、60、90d的健康叶片(分别标记为S、S和S),每个时期设置3组生物学重复,用0℃冰盒带回实验室,洗净,液氮速冻后保存于-80℃超低温冰箱中备用。
1.1.2 试剂。色谱级甲酸(Sigma-Aldrich);优级纯盐酸(信阳市化学试剂厂);色谱级甲醇(Merck)。
1.1.3 试验仪器。MM400球磨仪(Retsch);AS60/220.R2电子天平(RADWAG);KQ5200E超声清洗仪(上海净信);5424R离心机(Eppendorf);MIX-200多管涡旋振荡器(上海净信);QTRAP6500+LC-MS/MS(SCIEX)。
1.2 试验方法
1.2.1 样品处理。冷冻真空干燥试验样品,用30Hz球磨儀研磨1.5min至粉末状,称取50mg粉末状样品,将之溶解在500μL提取液(50%甲醇水溶液,含0.1%盐酸)中;用多管涡旋振荡器涡旋5min,超声清洗仪超声5min,离心机离心3min(12000r/min,4℃),吸取上清液,再重复1次上述步骤;合并2次上清液,用0.22μm微孔滤膜过滤样品,后保存于进样瓶中进行UPLC-MS/MS分析。
1.2.2 UPLC-MS/MS条件。
1.2.2.1 色谱条件。色谱柱为ACQUITY BEH C(2.1mm×100mm,1.7μm);流动相A相为加入0.1%甲酸的超纯水,B相为加入0.1%甲酸的甲醇;洗脱梯度:0.00min 时B相比例设置为5%,到6.00min增加至50%,到12.00min增加至95%,保持2min,到14min降至5%,并平衡2min。流速0.35mL/min;柱温40℃;进样量2μL。
1.2.2.2 質谱条件。正离子模式下质谱电压5500V,气帘气(CUR)241.32kPa,电喷雾离子源(ESI)温度550℃。在Q-Trap6500+ 中,每个离子对是根据碰撞能 (CE)和优化的去簇电压(DP)进行扫描检测。
1.2.3 样本含量测定。取浓度依次为0.01、0.02、0.05、0.10、0.50、1.00、5.00、10.00、50.00、100.00、500.00、1000.00、2000.00、5000.00ng/mL的标准品溶液,进行质谱检测;以横坐标为浓度、纵坐标为峰面积绘制标准曲线。将检测到的数据代入标准曲线线性方程进行计算,得到实际样本中该物质的含量,公式如下:
式中:C为样本中峰面积代入标准曲线得到的浓度(ng/mL);V为提取时所用溶液的体积(μL);m为样本质量(g)。
1.3 数据分析
利用公共数据库及自建数据库MWDB(metware database)鉴定代谢物,利用聚类热图、韦恩图分析不同样本质谱数据,探析各个发育时期坚果叶片代谢特征,结合多元分析处理软件,对差异代谢物进行筛选并分析。
2 结果与分析
2.1 澳洲坚果叶片代谢物的聚类热图
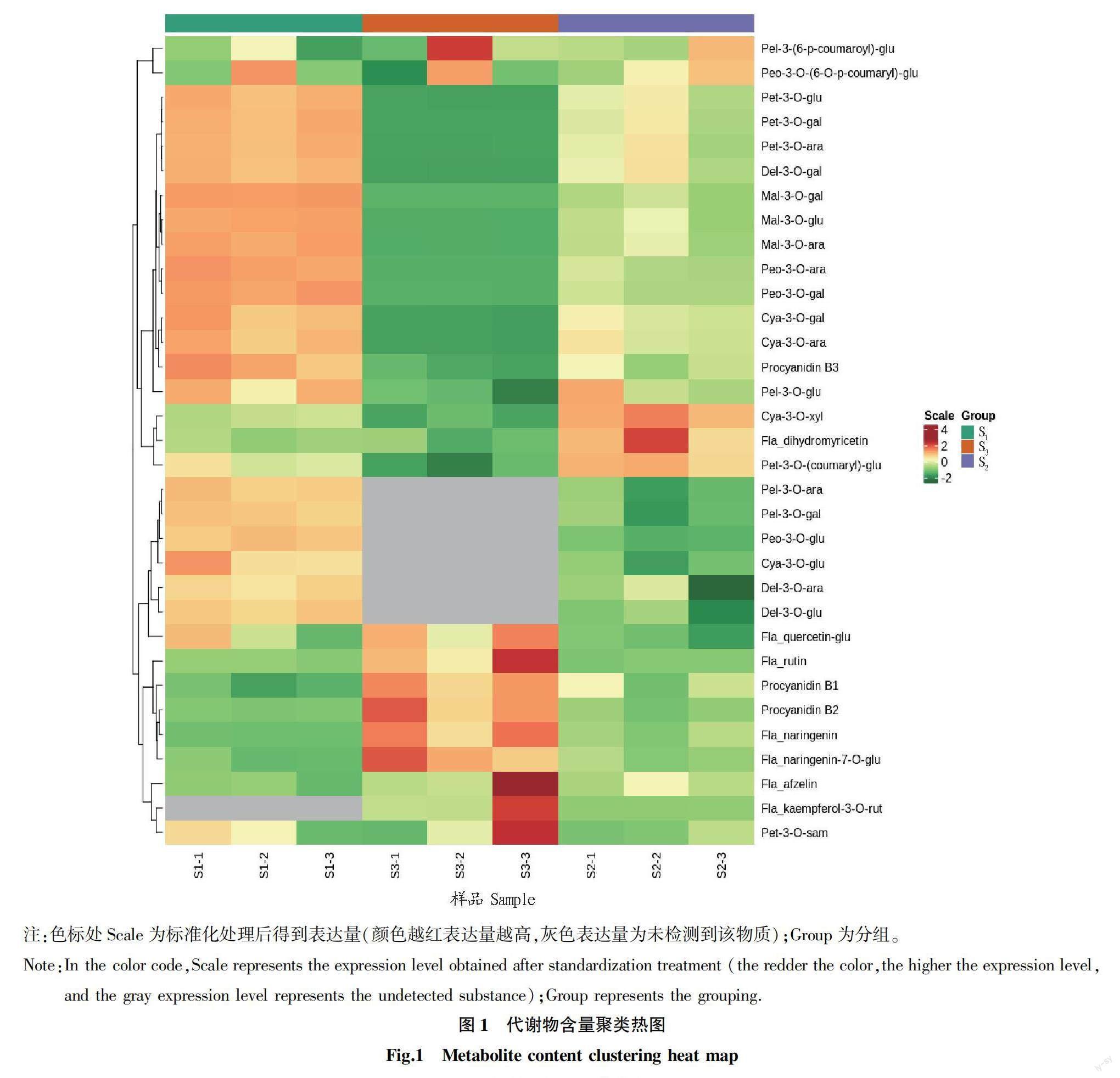
将检测出的数据进行归一化处理,对所有样品进行聚类热图分析,并绘制了聚类热图(图1),显示了不同时期叶片中代谢物变化及代谢物的分类情况。从3个不同发育时期叶片中共检测到108种代谢物,在处理与对照之间比较了108种代谢产物的浓度。从图1可以看出,锦葵色素、芍药花色素表达量随叶片生长时间呈下降趋势,矢车菊素[矢车菊素-3-O-葡萄糖苷(Cyanidin-3-O-glucoside)、芍药花色素[芍药花色素-3-O-葡萄糖苷(Peonidin-3-O-glucoside)、飞燕草素[飞燕草素-3-O-阿拉伯糖苷(Delphinidin-3-O-arabinoside)、飞燕草素-3-O-葡萄糖苷(Delphinidin-3-O-glucoside)]、天竺葵素[天竺葵素-3-O-阿拉伯糖苷(Pelargonidin-3-O-arabinoside)、天竺葵素-3-O-半乳糖苷(Pelargonidin-3-O-glucoside)]在叶片中的含量也随叶片生长时间呈下降趋势,且在S时期未检出。在S时期,黄酮类别中的二氢杨梅黄酮和矢车菊素类别中的矢车菊素-3-O-木糖苷(Cyanidin-3-O-xyloside)表达量相对较高。在S时期,黄酮类别中的山柰酚-3-O-芸香糖苷(Kaempferol-3-O-rutinoside)、异槲皮苷(Quercetin-3-O-glucoside)、柚皮素(Naringenin),天竺葵素类别中的天竺葵素-3-O-对香豆酰葡萄糖苷[Pelargonidin-3-O-(coumaryl)-glucoside],矢车菊素类别中的矢车菊素-3-O-桑布双糖苷(Cyanidin-3-O-sambubioside)等物质表达量相对较高。
2.2 不同发育时期澳洲坚果叶片中代谢物的筛选
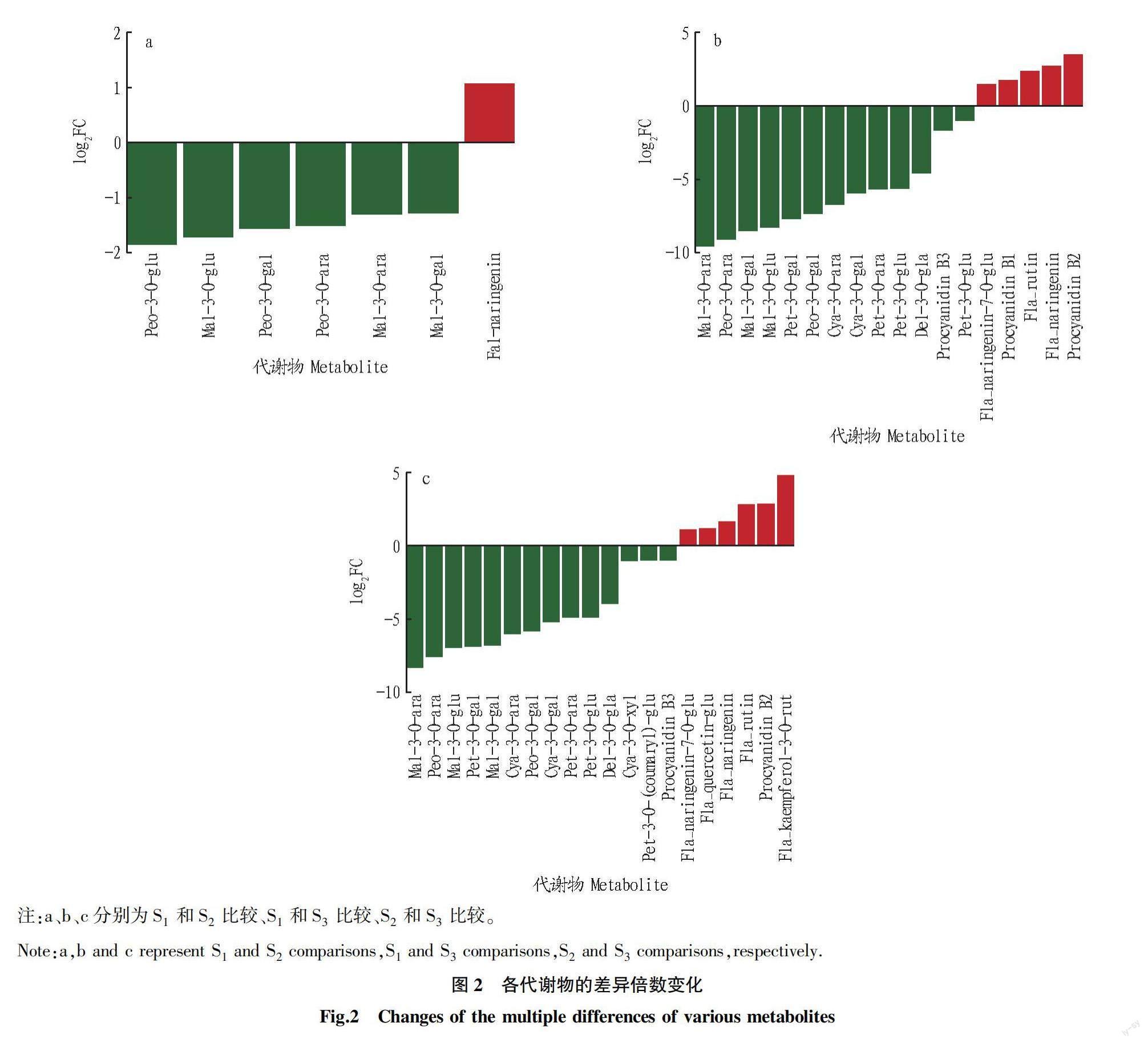
对不同发育时期澳洲坚果叶片(S、S、S)中所有代谢物进行对比分析,筛选出差异显著的代谢物(P≤0.5及FC≥2.0或FC≤0.5),结果如表1所示。从表1可以看出,S和S之间共有7个代谢物呈显著差异,S和S之间共有18个代谢物呈显著差异,S和S之间共有20个代谢物呈显著差异。
在对所检测到的代谢物进行定性和定量分析后,比较各代谢物在不同时期澳洲坚果叶片中的差异倍数变化,结果如图2所示。在澳洲坚果叶片中,相比S样品,S样品中的柚皮素有所上调,而芍药花色素类和锦葵色素类物质中的6种代谢物有所下调;与S样品相比,S样品中有5个物质上调,13个物质下调;与S样品相比,S样品中有6个物质上调,14个物质下调。此现象可能与花青素的代谢途径相关。植物花青素合成途径主要分为3个阶段,第一阶段是类黄酮代谢的初始反应,第二阶段是类黄酮代谢的重要反应,第三阶段是各种花青素的合成阶段。S样品和S样品中芍药花色素和锦葵色素两类物质差异显著,结合花青素的代谢途径可知,黄烷酮和二氢黄烷酮经二氢黄酮醇还原酶(dihydroflavonol reductase,DFR)催化作用,还原C环4位生成不同的无色花色素。随后,这些无色花色素经花青素合成酶(anthocyanidin synthase,ANS)催化作用产生有色花色素;类黄酮-3-葡糖基转移酶(flavonoid-3-glucosyltransferase,3GT/UFGT)催化有色花色素与糖苷结合转化成有色的花色苷。S样品的花青素有芍药花色素和锦葵色素,而S样品和S样品中依次出现了天竺葵素、矢车菊素、飞燕草素、芍药花色素、矮牵牛素和锦葵色素6种花青素,这是由于花青素碳骨架修饰主要包括糖基化、酰基化和甲基化,不同的修饰形成了不同的花青素。花青素酰基化增强花青素的稳定性,阻止花青素水解为无色的查尔酮;甲基化使得花青素的结构、颜色具有多样性。注:色标处Scale为标准化处理后得到表达量(颜色越红表达量越高,灰色表达量为未检测到该物质);Group为分组。
2.3 不同时期澳洲坚果叶片花青素类代谢产物变化的比较
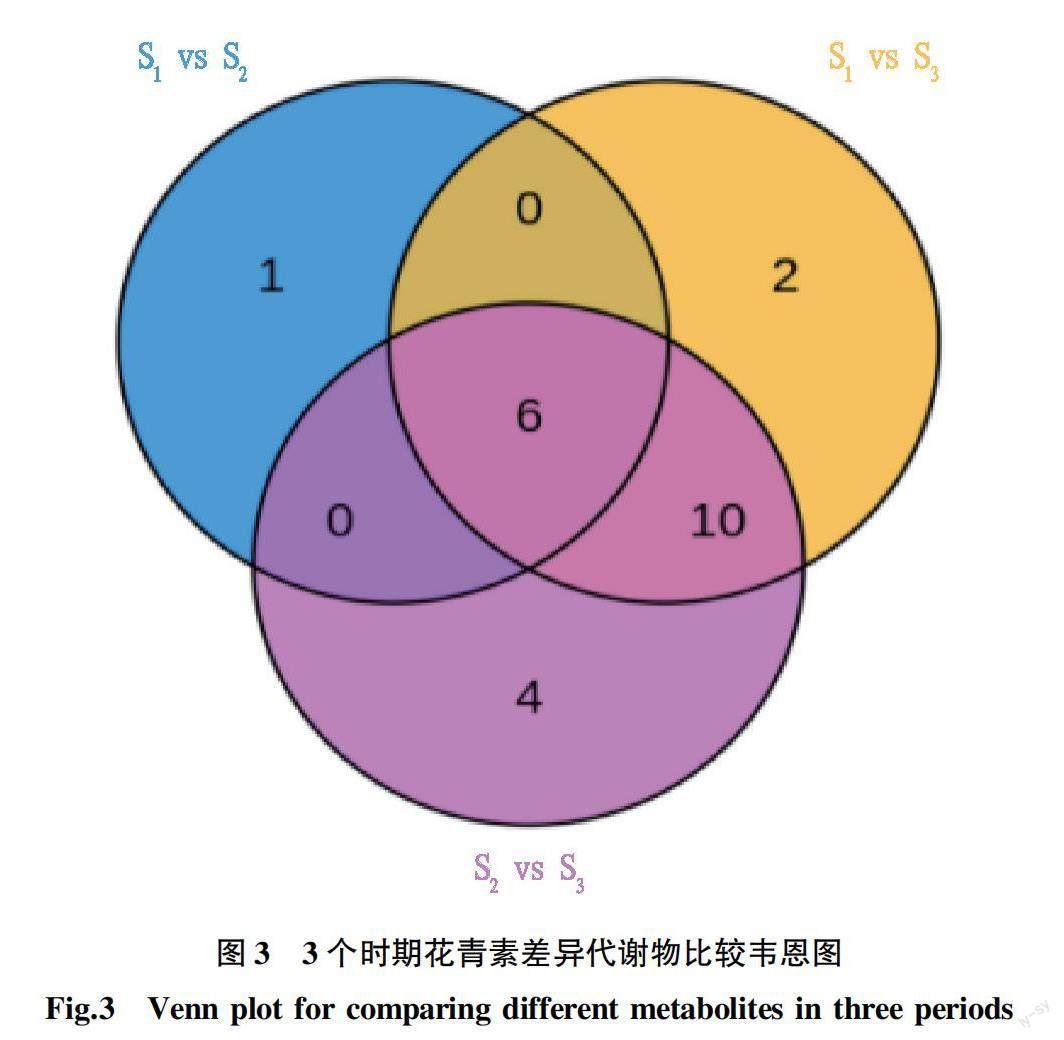
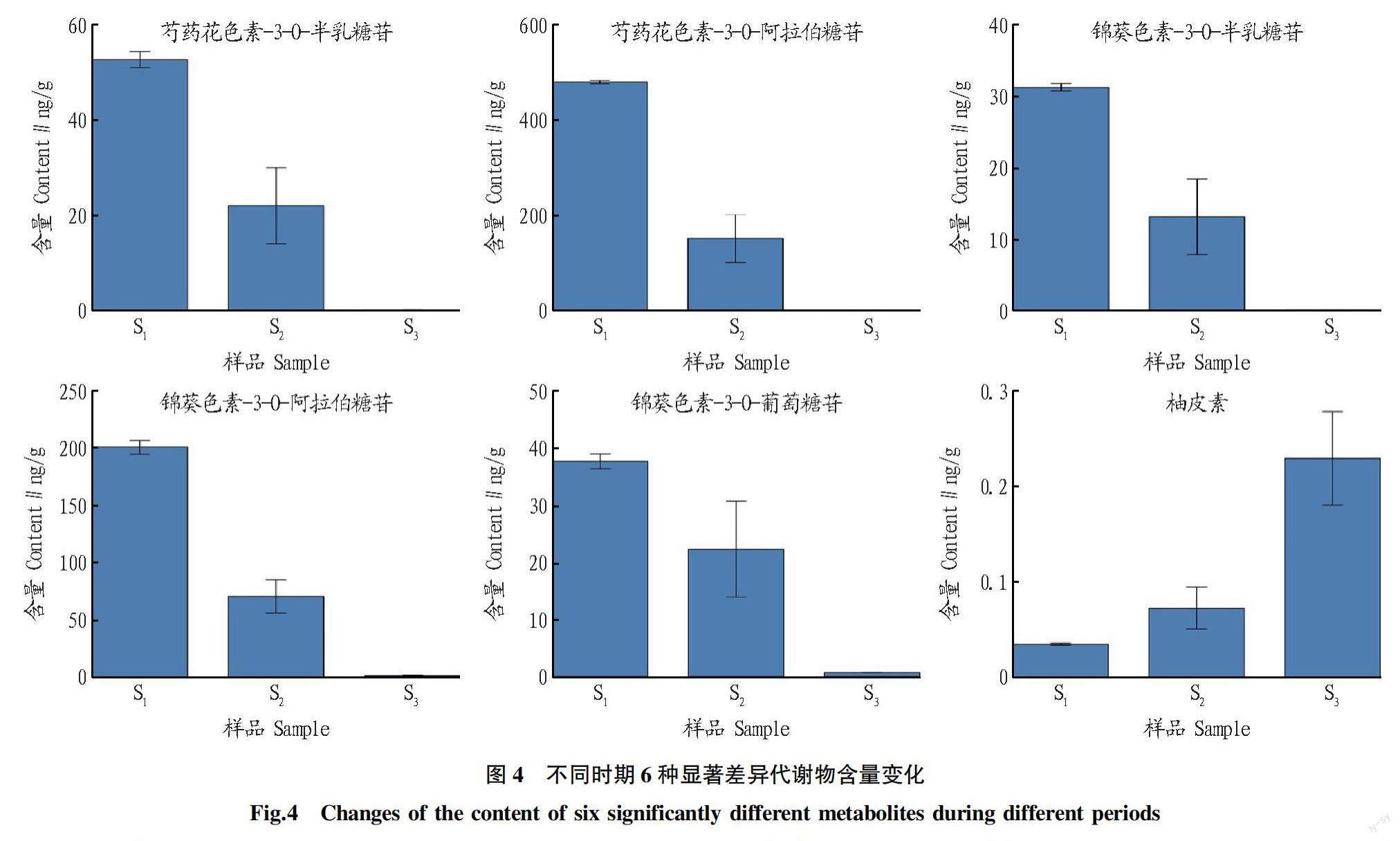
对不同发育期澳洲坚果叶片(S、S、S)花青素类代谢物进行比较,结果显示不同时期的花青素类代谢物有显著差异(图3)。从图3可以看出,S样品和S样品相比,芍药花色素-3-O-葡萄糖苷为S样品特有物质,还有7种异代谢物呈显著差异。与S样品相比,天竺葵素-3-O-葡萄糖苷、原花青素B1是S样品的特有物质,而矢车菊素-3-O-木糖苷、异槲皮苷、山柰酚-3-O-芸香糖苷、矮牵牛素-3-O-对香豆酰葡萄糖苷是S样品的特有物质。S样品和S样品、S样品和S样品相比,分别有18、20种花青素类物质呈显著差异。由韦恩图可知,3个时期共有显著差异代谢物6种,为了更直观地表现每种物质在不同组别之间的含量差异,现绘制6种共有显著差异代谢物含量变化图(图4)。
从图4可以看出,除柚皮素外,5种共同代谢物(芍药花色素-3-O-半乳糖苷、芍药花色素-3-O-阿拉伯糖苷、锦葵色素-3-O-半乳糖苷、锦葵色素-3-O-阿拉伯糖苷、锦葵色素-3-O-葡萄糖苷)含量均随坚果叶片的发育而下降。说明澳洲坚果叶片在不同时期的花青素代谢产物有较大差异,根据研究可知,植物花青素含量的变化除了受自身合成代谢的影响外,还受外界因子(如阳光)的影响。另有研究表明,植物叶片发育的各时期内,花青素含量随光照强度的增加,总体上表现出先增加再减小现象。
2.4 不同时期澳洲坚果叶片花青素类代谢物KEGG通路 代谢物在生物体内相互作用,形成不同的通路。利用图3 3个时期花青素差异代谢物比较韦恩图
Fig.3 Venn plot for comparing different metabolites in three periodsKEGG数据库对代谢物进行注释。由KEGG通路图(图5)可知,相较于S样品,S样品中芍药花色素-3-O-葡萄糖苷(Peonidin-3-O-glucoside)、锦葵色素-3-O-葡萄糖苷(Malvidin-3-O-glucoside)含量显著下调;相较于S、S时期,S时期芍药花色素-3-O-葡萄糖苷(Peonidin-3-O-glucoside)、矮牵牛素-3-O-葡萄糖(Petunidin-3-O-glucoside)含量显著下调;通路中未检测到共有代谢物的含量显著上调。
3 结论与讨论
该试验根据澳洲坚果叶片不同发育时期花青素含量的变化,从O.C.品种澳洲坚果树花后30、60、90d的健康叶片(分别标记为S、S和S)共检测出108种代谢产物,属于天竺葵素、矢车菊素、飞燕草素、芍药花色素、矮牵牛素、锦葵色素、原花青素、黄酮。以S为对照,S有1个物质含量上调,6个物质含量下调;S有5个物质含量上调,13个物质含量下调。以S为对照,S有6个物质含量上调,14个物质含量下调;与S相比,芍药花色素-3-O-葡萄糖苷为S特有物质;与S相比,天竺葵素-3-O-葡萄糖苷、原花青素B1是S的特有物质,矢车菊素-3-O-木糖苷、异槲皮苷、山柰酚-3-O-芸香糖苷、矮牵牛素-3-O-对香豆酰葡萄糖苷是S的特有物质。3个不同时期样品共有显著差异代谢物6种,分别是芍药花色素-3-O-半乳糖苷、芍药花色素-3-O-阿拉伯糖苷、锦葵色素-3-O-半乳糖苷、锦葵色素-3-O-阿拉伯糖苷、锦葵色素-3-O-葡萄糖苷和柚皮素。注:a、b、c分别为S和S比较、S和S比较、S和S比較。
研究表明植物花青素等酚类化合物的合成需要前期营养物质(如还原糖)的合成作为基础,从而使合成花青素的前体物质增多,最终使芍药花色素、锦葵色素等花青素含量积累。该研究中澳洲坚果叶片在花后30d大量累积芍药花色素、锦葵色素、黄酮等物质的含量,可能是澳洲坚果叶片发育前期主要是营养物质的累积,并为后期坚果叶片生长发育和合成其他二次代谢产物做物质准备。此外,根据大量研究可知,澳洲坚果叶片花青素的代谢途径少不了酶和基因的作用。3个时期分别代谢合成了6种花青素,ANS是关键酶,主要作用是将无色花青素转化为有色花青素,是色彩形成的基础物质。而试验中各个时期的花青素种类和含量不尽相同,这可能与ANS的表达相关。亓希武等报道在结紫色果的桑品种“粤椹”中ANS基因表达具有组织特异性,且随着果色加深其表达水平呈上升趋势;结白色果的桑品种“珍珠白”各个组织部位和不同发育时期ANS基因均不表达。Ahn等研究表明紫色品种“结缕草”ANS基因在穗尖及匍匐茎中表达水平较高,绿色品种中表达量明显较低。该试验中,澳洲坚果叶片中的花青素在S时期合成的物质含量到S时下调可能是受合成酶表达的影响,也可能是受到不利环境因子胁迫,如紫外线辐射、低温等。
参考文献
[1]JOHNSON L A S,BRIGGS B G.On the Proteaceae-The evolution and classification of a southern family[J].Bot J Linn Soc,1975,70(2):83-182.
[2]CULL B W,TROCHOULIAS T.The environmental range for commercial macadamia production[C]//Perth:First Australian conference on tree and nut crops.Subiaco:West Australian Nut and Tree Crop Association,1982:54-61.
[3]贺熙勇,陶亮,柳觐,等.我国澳洲坚果产业概况及发展趋势[J].热带农业科技,2015,38(3):12-16,19.
[4]刘晓,陈健.澳洲坚果的起源、栽培史及国内外发展现状[J].西南园艺,1999,27(2):18-20.
[5]孔广红,马静,柳觐,等.乙烯利诱使澳洲坚果落果的研究[J].西南大学学报(自然科学版),2018,40(7):18-24.
[6]蒋桂芝,周程,李子强,等.澳洲坚果黑果病病原鉴定及防治药剂毒力测试[J].热带农业科技,2019,42(1):25-29.
[7]NAVARRO S L B,RODRIGUES C E C.Macadamia oil extraction methods and uses for the defatted meal byproduct[J].Trends Food Sci Technol,2016,54:148-154.
[8]郭刚军,胡小静,彭志东,等.不同压榨方式澳洲坚果油品质及抗氧化活性比较[J].食品科学,2018,39(13):125-132.
[9]帅希祥,杜丽清,张明,等.超声辅助酶解制备澳洲坚果蛋白肽及其抗氧化活性的研究[J].热带作物学报,2017,38(11):2076-2081.
[10]STEPHENSON R A,CULL B W,MAYER D G.Effects of site,climate,cultivar,flushing,and soil and leaf nutrient status on yields of macadamia in south east Queensland[J].Sci Hortic,1986,30(3):227-235.
[11]HERBERT S W,WALTON D A,WALLACE H M.The influence of pollen-parent and carbohydrate availability on macadamia yield and nut size[J].Sci Hortic,2019,251:241-246.
[12]刘刚,姜唯唯,吴京,等.芒果叶不同极性部位提取物的抗氧化活性[J].食品研究与开发,2014,35(11):10-14.
[13]陈智理,杨昌鹏,赵永锋,等.番石榴叶多酚分离纯化工艺研究[J].食品研究与开发,2016,37(24):54-58.
[14]袁媛.郁金香花色苷合成基因的克隆及其表达差异与花色变化的关系[D].上海:上海交通大学,2015.
[15]王华,李茂福,杨媛,等.果实花青素生物合成分子机制研究进展[J].植物生理学报,2015,51(1):29-43.
[16]贾赵东,马佩勇,边小峰,等.植物花青素合成代谢途径及其分子调控[J].西北植物学报.2014,34(7):1496-1506.
[17]HATIER J H B,CLEARWATER M J,GOULD K S.The functional significance of black-pigmented leaves:Photosynthesis,photoprotection and productivity in Ophiopogon planiscapus‘Nigrescens’[J].PRoS One,2013,8(6):1-13.
[18]DE PASCUAL-TERESA S,SANCHEZ-BALLESTA M T.Anthocyanins:From plant to health[J].Phytochem Rev,2008,7(2):281-299.
[19]ESPLEY R V,BOVY A,BAVA C,et al.Analysis of genetically modified red-fleshed apples reveals effects on growth and consumer attributes[J].Plant Biotechnol J,2013,11(4):408-419.
[20]韓树全,罗立娜,范建新,等.澳洲坚果叶茶的品质特征及挥发性成分分析[J].热带作物学报,2019,40(8):1645-1652.
[21]朱泽燕,黄雪松.用气相色谱-质谱联用法分析澳洲坚果幼叶的挥发性成分[J].热带农业科学,2017,37(3):94-99.
[22]吴雪霞,张爱冬,朱宗文,等.植物花青素生物合成代谢途径及调控因子研究[J].上海农业学报,2018,34(4):127-132.
[23]胡可,韩科厅,戴思兰.环境因子调控植物花青素苷合成及呈色的机理[J].植物学报,2010,45(3):307-317.
[24]HICHRI I,BARRIEU F,BOGS J,et al.Recent advances in the transcriptional regulation of the flavonoid biosynthetic pathway[J].J Exp Bot,2011,62(8):2465-2483.
[25]ZHANG Y J,CHU G H,HU Z L,et al.Genetically engineered anthocyanin pathway for high health-promoting pigment production in eggplant[J].Mol Breed,2016,36(5):1-14.
[26]祝志欣,鲁迎青.花青素代谢途径与植物颜色变异[J].植物学报,2016,51(1):107-119.
[27]谭天宇.光强对蓝莓花青素含量动态变化的影响初探[D].贵阳:贵州大学,2021.
[28]ÁLVAREZ-GÓMEZ F,KORBEE N,FIGUEROA F L.Effects of UV radiation on photosynthesis,antioxidant capacity and the accumulation of bioactive compounds in Gracilariopsis longissima,Hydropuntia cornea and Halopithys incurva (Rhodophyta)[J].J Phycol,2019,55(6):1258-1273.
[29]高燕会,黄春红,朱玉球,等.植物花青素苷生物合成及调控的研究进展[J].中国生物工程杂志,2012,32(8):94-99.
[30]李小兰,张明生,吕享.植物花青素合成酶ANS基因的研究进展[J].植物生理学报,2016,52(6):817-827.
[31]JAAKOLA L.New insights into the regulation of anthocyanin biosynthesis in fruits[J].Trends Plant Sci,2013,18(9):477-483.
[32]亓希武,帥琴,范丽,等.桑树花青素合成酶(ANS)基因的克隆及在2种果色桑树中的表达特征[J].蚕业科学,2013,39(1):5-13.
[33]AHN J H,KIM J S,KIM S,et al.De novo transcriptome analysis to identify anthocyanin biosynthesis genes responsible for tissue-specific pigmentation in zoysiagrass(Zoysia japonica Steud.)[J].PLoS One,2015,10(4):1-21.
[34]KALIDHASAN N,BHAGAVAN N B,KANNAN N D.Ultraviolet-B (280-320nm) enhanced radiation induced changes in secondary metabolites and photosystem-Ⅱ of medicinal plant Withania somnifera Dunal.[J].J Med Plant Res,2013,7(42):3112-3120.
[35]宁露云,包满珠,张蔚.低温胁迫对矮牵牛H株系花青素、游离脯氨酸及可溶性糖含量的影响[J].湖北农业科学,2016,55(6):1500-1503.
