周氏啮小蜂CcGSTS1基因的克隆·蛋白表达纯化及酶学特征分析
2024-02-02覃东玉任睿孙美娣李敏潘丽娜
覃东玉 任睿 孙美娣 李敏 潘丽娜

摘要 鉴定一个编码周氏啮小蜂谷胱甘肽S-转移酶序列的全长基因CcGSTS1,系统发育分析发现,该基因与丽蝇蛹集金小蜂NvGSTS6基因具有高同源性。体外表达、纯化的重组CcGSTS1可催化CDNB与GSH结合,最适反应pH为7.0。该试验为进一步研究周氏啮小蜂CcGSTS1基因功能奠定基础。
关键词 周氏啮小蜂;谷胱甘肽S-转移酶;系统发育分析;酶活
中图分类号 Q965.9 文献标识码 A
文章编号 0517-6611(2024)02-0093-04
doi:10.3969/j.issn.0517-6611.2024.02.019
開放科学(资源服务)标识码(OSID):
Cloning,Expression,Purification and Enzyme Activity of CcGSTS1 from Chouioia cunea Yang
QIN Dong-yu,REN Rui,SUN Mei-di et al
(Tianjin Normal University/Tianjin Key Laboratory of Animal and Plant Utilization and Protection,Tianjin 300387)
Abstract In this study,we characterized a full-length gene encoding GST sequences CcGSTS1 from C.cunea.Phylogenetic analysis showed that CcGSTS1 shared the highest identity with NvGSTS6 of Nasonia vitripennis.The recombinant CcGSTS1 showed glutathione-conjugating activity toward CDNB (1-chloro-2,4-dinitrobenzene) and GSH (Glutathione).The optimal reaction pH value is 7.0.This study provides a foundation for further study on the function of CcGSTS1 gene in C.cunea.
Key words Chouioia cunea Yang;Glutathione S-transferases;Phylogenetic analysis;Enzyme activity
基金项目 天津市教委科研计划项目(2019KJ089)。
作者简介 覃东玉(1997—),女,广西来宾人,硕士研究生,研究方向:昆虫学。*通信作者,副教授,博士,从事昆虫学研究。
收稿日期 2023-02-06
昆虫的宿主适应性及杀虫剂抗性与解毒代谢相关蛋白密切相关,主要包括ABC转运蛋白(ATP-binding cassette transporters,ABC)、细胞色素p450(cytochrome P450s,P450s)、羧酸酯酶(carboxylesterases,CarEs)和谷胱甘肽S-转移酶(glutathione s-transferases,GSTs)。谷胱甘肽S-转移酶催化谷胱甘肽(glutathione,GSH)与底物结合,增加代谢产物的水溶性,促进其排出体外。根据谷胱甘肽S-转移酶在细胞内的位置,GSTs可分为3类:胞质GSTs、微粒体GSTs和线粒体GSTs。迄今为止,在昆虫中只发现了胞质GSTs与微粒体GSTs,胞质GSTs通常被分为至少6类:Delta、Epsilon、Omega、Sigma、Theta和Zeta。普遍存在于原核生物和真核生物中谷胱甘肽S-转移酶,除对内源性和外源性化合物的解毒作用以外,还参与多种细胞生理生化反应,如胞内物质运输、激素的生物合成和抗氧化应激等。此外,谷胱甘肽S-转移酶可作为气味降解酶,在昆虫嗅觉感受系统中降解气味分子,如玉米象(Sitophilus zeamais)的SzeaGSTd1可能通过降解宿主挥发物中的辛醇,从而辅助定位宿主,烟草天蛾(Manduca sexta)触角的性信息素敏感感受器中具有触角特异性表达GST,可能通过灭活醛类气味分子来保护嗅觉系统。
蛹寄生蜂周氏啮小蜂(Chouioia cunea Yang)是杨忠岐等在我国筛选出的一种对美国白蛾具有高寄生率的天敌昆虫,在美国白蛾的生物防治中起着关键作用。有关周氏啮小蜂的室内繁育,蜂种复壮,不同温湿度对小蜂寄生率、发育历期、成蜂寿命的影响等方面均已有详尽研究,但有关其对杀虫剂的解毒代谢分子机制尚缺乏研究。Li等在周氏啮小蜂嗅觉分子机制研究中发现,美国白蛾蛹挥发物1-十二烯对小蜂已交配雌性具有较强的引诱性,但其诱发周氏啮小蜂嗅觉反应的分子机制尤其是降解机制尚不明确。笔者从周氏啮小蜂的转录组数据中筛选谷胱甘肽S-转移酶基因,分析该基因的序列保守性及系统进化关系,并克隆CcGSTS1基因,体外诱导、表达并纯化CcGSTS1蛋白,分析该蛋白的活性,旨在为进一步分析CcGSTS1在周氏啮小蜂解毒代谢中的作用或气味降解中的作用奠定基础。
1 材料与方法
1.1 材料
供试昆虫:周氏啮小蜂,由河南省漯河市豫中南林业有害生物天敌繁育研究中心惠赠,在实验室接种于柞蚕蛹(Antheraea pernyi)上进行传代培养。培养条件:温度(25±0.5)℃,相对湿度(70±10)%,光周期14 L∶10 D。
主要试剂和工具酶:总RNA 提取试剂(RNA isolater Total RNA Extraction Reagent)、反转录试剂盒(HiScriptII 1st Strand cDNA Synthesis Kit)、DNA凝胶回收試剂盒(FastPure Gel DNA Extraction Mini Kit)、质粒提取试剂盒(FastPure Plasmid Mini Kit)购自南京诺唯赞生物科技股份有限公司;限制性内切酶、PCR 所需 ExTaq primix 酶购自宝生物工程(大连)有限公司;引物合成及测序由苏州金唯智生物科技有限公司完成;其他如氯仿、异丙醇等试剂均为国产或进口分析纯试剂。
菌种及质粒:大肠杆菌Transetta (DE3) Chemically Competent Cell、Trans1-T1 Phage Resistant Chemically Competent cell 购自北京全式金生物有限公司;原核表达载体pGEXKG1为实验室保存。
1.2 方法
1.2.1 序列分析及系统发育树构建。
周氏啮小蜂谷胱甘肽S-转移酶1(CcGSTS1)碱基序列由笔者所在课题组早期全长转录组测序获得。氨基酸序列由BioEdit软件(Isis Pharmaceuticals,Carlsbad,CA)生成。应用在线服务器(http://www.detaibio.com/sms2/protein_iep.html)计算成熟蛋白质的分子量及等电点。采用Signalp-5.0服务器(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)对信号肽进行预测。通过SMART服务器(http://smart.embl-heidelberg.de/)对CcGSTS1的保守结构域进行分析。应用MEGA 7.0软件align by clustalW程序,选择默认参数进行序列对齐,采用p-distance模型对间隙进行删除,phylogency程序构建系统发育树。
1.2.2 总RNA提取与cDNA合成。
取周氏啮小蜂成虫称重100 mg,用液氮研磨后,按照 RNA isolater Total RNA Extraction Reagent说明书提取总 RNA,经1% 琼脂糖凝胶电泳检测后,根据反转录试剂盒说明书进行反转录反应获得单链 cDNA。
1.2.3 重组表达质粒构建。
根据CcGSTS1的基因序列,利用 Primer 5.0设计特异性引物(sense:CGCGGATCCATGCCTATGGAGCAGATGC,antisense: CCGCTCGAGAAATTGGGTTTTGGGTCGT)。以周氏啮小蜂单链 cDNA 为模板,进行 PCR 扩增,将回收的DNA片段连接在克隆载体pMD 19-T,阳性克隆送测序验证。用BamH Ⅰ/Xho Ⅰ 双酶切并连接表达载体pGEX-KG,将连接产物转化至大肠杆菌E.coli 菌株(Trans1-T1)感受态细胞。挑取单菌落,扩大培养后利用质粒提取试剂盒进行质粒提取。对抽提出的质粒进行双酶切鉴定和测序验证。
1.2.4 重组蛋白原核表达与纯化。
应用重组质粒pGEX-KG-GSTS1转化E.coli Rosetta(DE3) 表达菌株感受态细胞,挑取单菌落进行扩大培养,37 ℃振荡培养至菌液OD为0.8~1.0,加入IPTG 至终浓度为0.4 mmol/L 进行诱导表达,继续振荡培养4 h。收集诱导表达菌体,用PBS缓冲液重悬菌体,超声波破碎后于4 ℃下10 000 r/min 离心15 min。收集上清,与谷胱甘肽树脂,于4 ℃层析柜结合,随后将结合液于4 ℃下 1 200 rcf离心5 min,弃掉上清液,用PBS缓冲液进行洗涤3次,然后加入Thronbim酶,于4 ℃酶切除GST标签,最后加入PBS缓冲液洗脱,收集上清即为纯化的蛋白,在4 ℃ 用透析袋透析去盐(透析液 20 mmol/L Tris-HCl,pH 7.4) 2次,每次4 h。纯化后采用 BCA 法对蛋白质进行定量。然后将10 μL纯化蛋白用 SDS-PAGE 检测,最后存至冰上放至4 ℃冰箱保存,用于酶活性检测分析。
1.2.5 谷胱甘肽S-转移酶活力测定。
CcGSTS1活性测定:反应体系包括100 mmol/L 磷酸盐缓冲液(pH 7.5) ,1 μg CcGSTS1蛋白,GSH 终浓度为 1 mmol/L,CDNB 终浓度为2 mmol/L,在25 ℃条件下检测 340 nm 处的吸光值,以PBS 缓冲液作为对照。每处理重复3次,每1 min 测定1次,共测定 9 min。将所得数值经过整理带入公式求出酶活力。CcGSTS1活力计算公式如下:
比活力[μmol/(min·mg)]=( △OD×V)( ε×T×L×E)
式中:△OD为单位时间内吸光度的变化值,V为酶促反应体积(200 μL) ,ε 为产物的消光系数( 9.6 mmol/cm),T 为反应时间(1 min) ,L 表示光程 (1 cm),E为加入酶量(1 μg)。
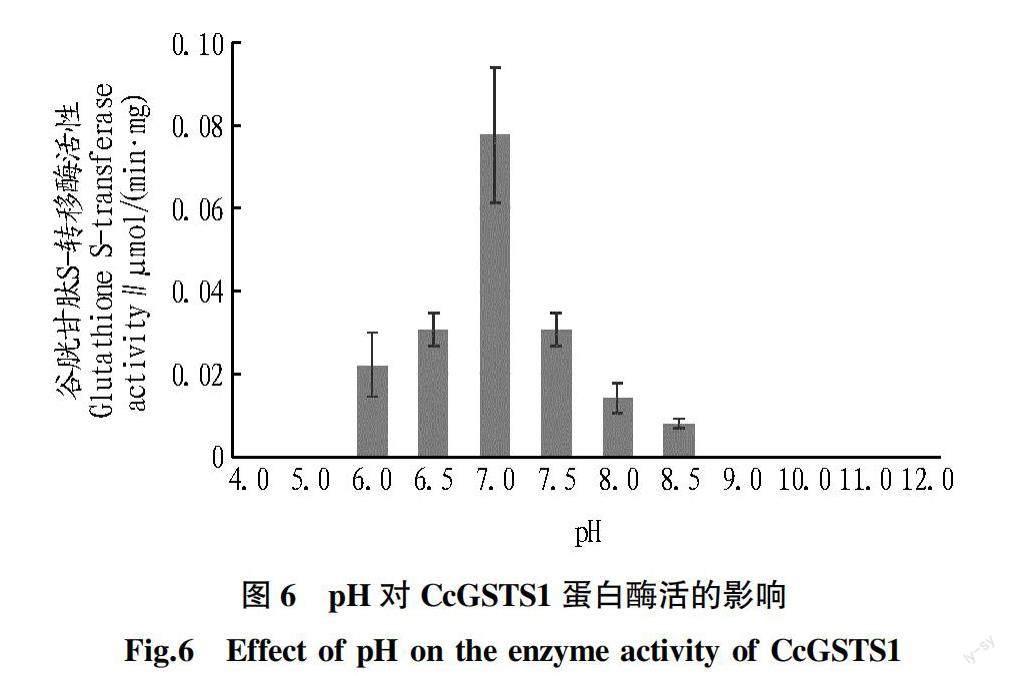
pH对CcGSTS1催化活性的影响:反应体系包括终浓度分别为2 mmol/L CDNB 和1 mmol/L GSH,1 μg目的蛋白,100 mmol/L 磷酸盐缓冲液,同时将反应体系中的100 mmol/L 磷酸盐缓冲液( pH 7.5) 替换成不同pH 梯度缓冲盐溶液(pH 4.0、5.0、6.0、6.5、7.0、7.5、8.0的100 mmol/L 磷酸盐缓冲液,pH 8.5、9.0、10.0、11.0、12.0的100 mmol /L Tris-HCl 缓冲液),反应在25 ℃下进行。每处理进行3次重复。检测在340 nm 处的吸光值,分别于1 min 和6 min各测定1次,按照上述方法测定酶活力。
2 结果与分析
2.1 CcGSTS1蛋白序列
试验前期全长转录组测序获得CcGSTS1基因,该基因全长474 bp,编码157个氨基酸。应用Signalp-5.0在线服务器分析发现,该基因N端无信号肽,说明CcGSTS1是一种非分泌性蛋白,其成熟多肽的计算分子量为18.27 kD,理论pI为6.55。CcGSTS1 蛋白由一个短链接序列 (Lys69-Thr70-Lys71-Leu72-Leu73-Glu74-Leu75-Ala76-Lys77-Glu78-Lys79-Thr80) 连接其N端与C端结构域(图1)。
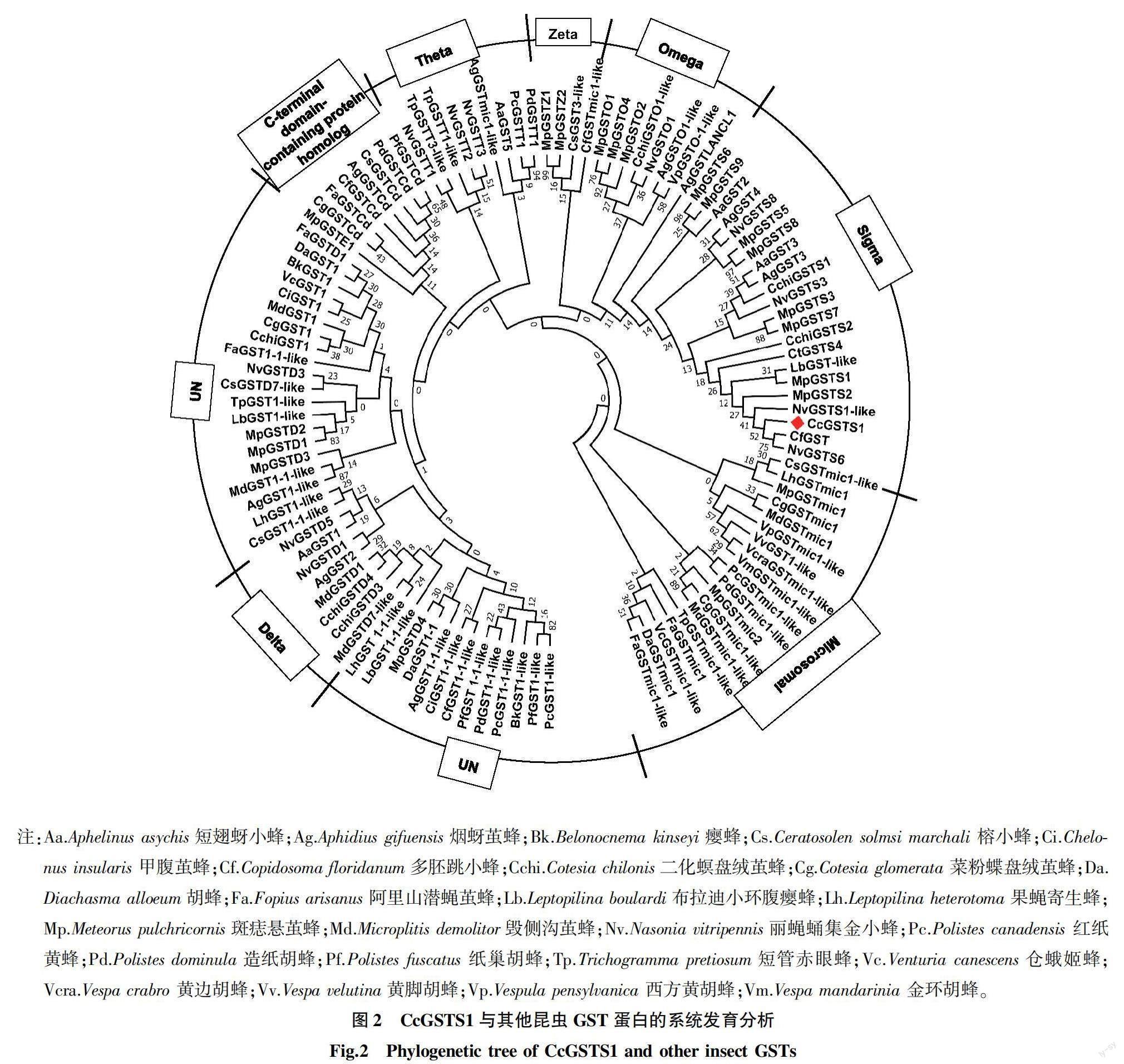
2.2 CcGSTS1与其他昆虫GST序列比对及系统发育
将CcGSTS1与23种近缘昆虫的110条GST异构体进行多重序列比对,结果表明,CcGSTS1具有较高的序列一致性。系统发育分析显示,CcGSTS1在Neighbor-joining树中聚为Sigma分支,bootstrap值较高,表明CcGSTS1属于胞质谷胱甘肽S-转移酶的Sigma亚家族(图2)。CcGSTS1与丽蝇蛹集金小蜂(Nasonia vitripennis)的NvGSTS6和多胚跳小蜂(Copidosoma floridanum)的CfGST同源性最高(分别为65%和66%),与斑痣悬茧蜂(Meteorus pulchricornis)的MpGST1和MpGST2,二化螟盘绒茧
蜂(Cotesia chilonis)的CchiGSTS2等烟蚜茧蜂(Aphidius gifuensis 的AgGST2和AgGST3,短翅蚜小蜂Aphelinus asychis的AaGST3等Sigma家族谷胱甘肽S-转移酶均具有较高相似性。
注:Aa.Aphelinus asychis短翅蚜小蜂;Ag.Aphidius gifuensis烟蚜茧蜂;Bk.Belonocnema kinseyi瘿蜂;Cs.Ceratosolen solmsi marchali 榕小蜂;Ci.Chelonus insularis 甲腹茧蜂;Cf.Copidosoma floridanum多胚跳小蜂;Cchi.Cotesia chilonis二化螟盘绒茧蜂;Cg.Cotesia glomerata 菜粉蝶盘绒茧蜂;Da.Diachasma alloeum胡蜂;Fa.Fopius arisanus 阿里山潜蝇茧蜂;Lb.Leptopilina boulardi布拉迪小环腹瘿蜂;Lh.Leptopilina heterotoma 果蝇寄生蜂;Mp.Meteorus pulchricornis斑痣悬茧蜂;Md.Microplitis demolitor毁侧沟茧蜂;Nv.Nasonia vitripennis丽蝇蛹集金小蜂;Pc.Polistes canadensis 红纸黄蜂;Pd.Polistes dominula 造纸胡蜂;Pf.Polistes fuscatus 纸巢胡蜂;Tp.Trichogramma pretiosum短管赤眼蜂;Vc.Venturia canescens仓蛾姬蜂;Vcra.Vespa crabro 黄边胡蜂;Vv.Vespa velutina黄脚胡蜂;Vp.Vespula pensylvanica 西方黄胡蜂;Vm.Vespa mandarinia 金环胡蜂。
2.3 CcGSTS1的原核表达、纯化
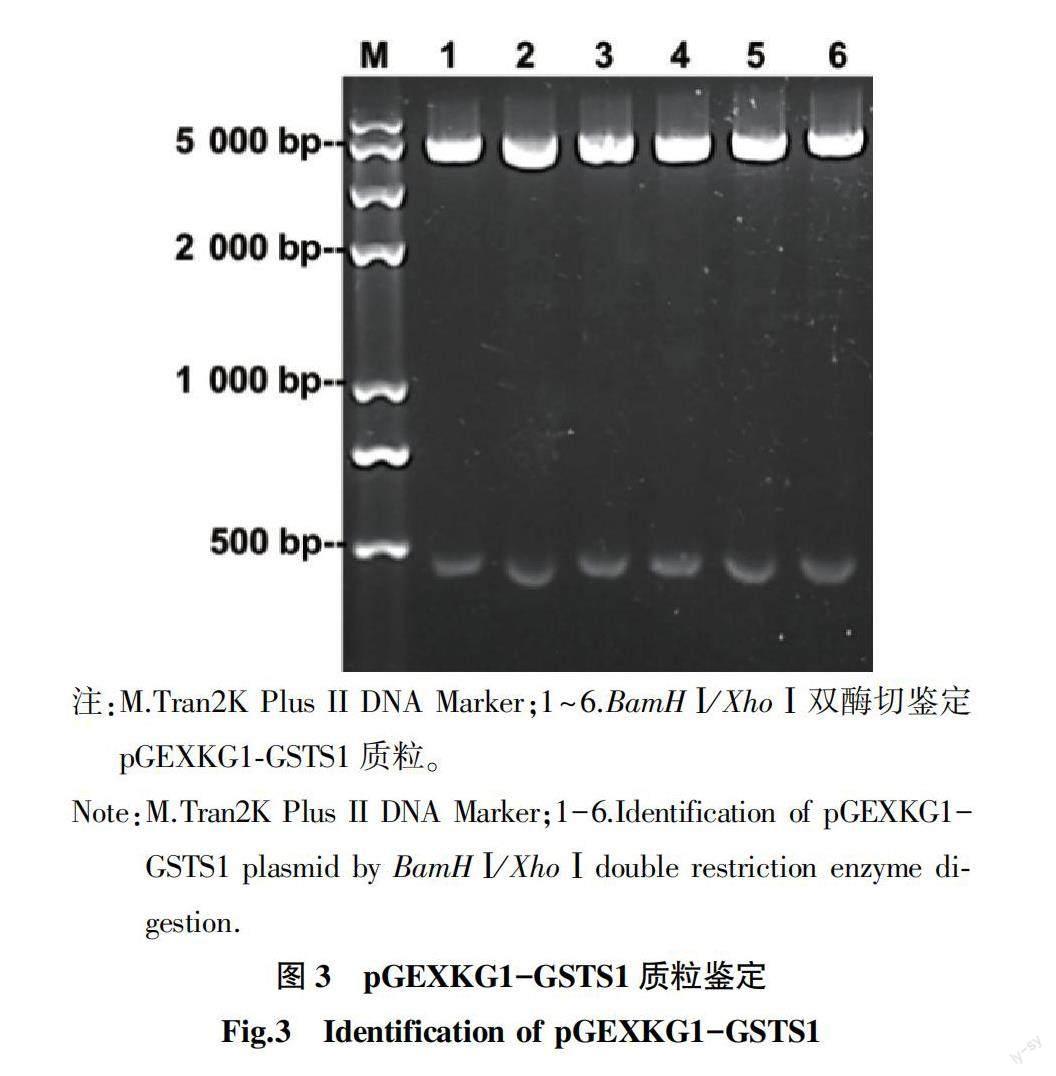
为进一步研究周氏啮小蜂CcGSTS1基因功能,抽提1日龄周氏啮小蜂总RNA,反转录为cDNA作模板,应用CcGSTS1基因特异性引物进行PCR扩增,采用限制性内切酶BamH Ⅰ/Xho Ⅰ双酶切,构建pGEXKG-CcGSTS1重组质粒。如图3所示,随机挑取6个单菌落,经质粒小量提取,双酶切验证,可切出471 bp外接片段,即上述质粒构建成功。挑选菌落1送苏州金唯智生物科技有限公司测序正确,可用于后续蛋白表达纯化。
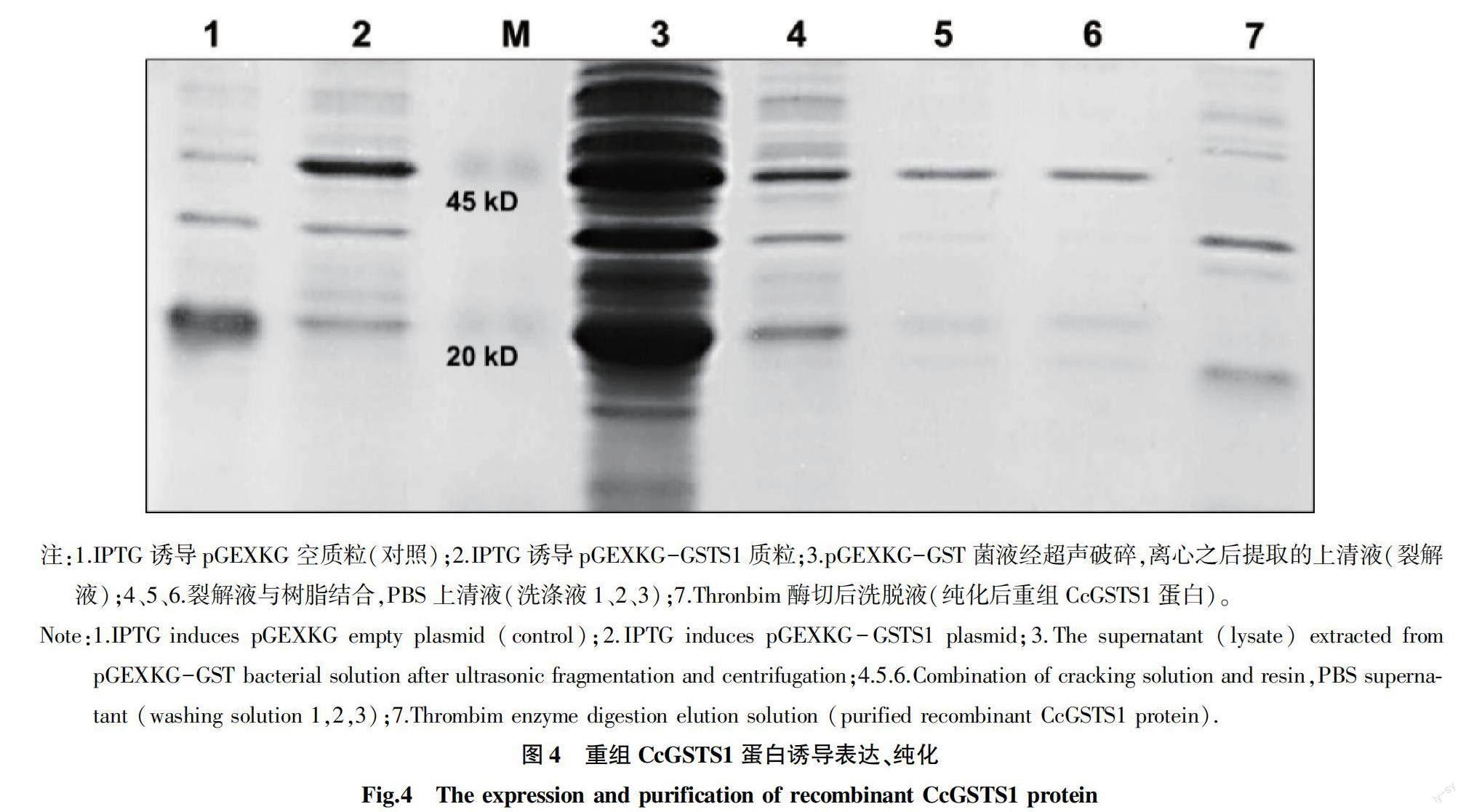
将重组表达质粒pGEXKG-GSTS1 转化至 E.coli Rosetta(DE3)感受态细胞,加入终浓度为0.4 mmol/L 的 IPTG 后,在37 ℃ 条件下诱导表达4 h。收集菌体,如图4泳道1和泳道2所示,pGEXKG空质粒转化菌经IPTG诱导后,在25 kD 处有特异条带(载体GST蛋白标签),而pGEXKG-GST转化菌在45 kD处有特异性条带,说明融合蛋白成功表达(载体GST标签与周氏啮小蜂GSTS1融合蛋白)。收集菌体经超声波破碎,高速离心15 min后,上清液显示,45 kD处有特异性条带,说明该融合蛋白是可溶性蛋白(图4泳道3)。收集的上清液与琼脂糖凝胶树脂4B结合,应用PBS 磷酸盐缓冲液进行洗涤去杂蛋白,如图4泳道4、5、6所示,诱导的融合蛋白過量,超出琼脂糖凝胶树脂4B的结合能力。进一步加入thrombin 凝血酶切除标签,利用PBS 磷酸盐缓冲液进行洗脱可获得不含标签的CcGSTS1蛋白(图4泳道7)。进一步将纯化的CCGSTS蛋白进行透析,并用于后续CcGSTS1活性分析试验。
2.4 CcGSTS1 的酶学特性
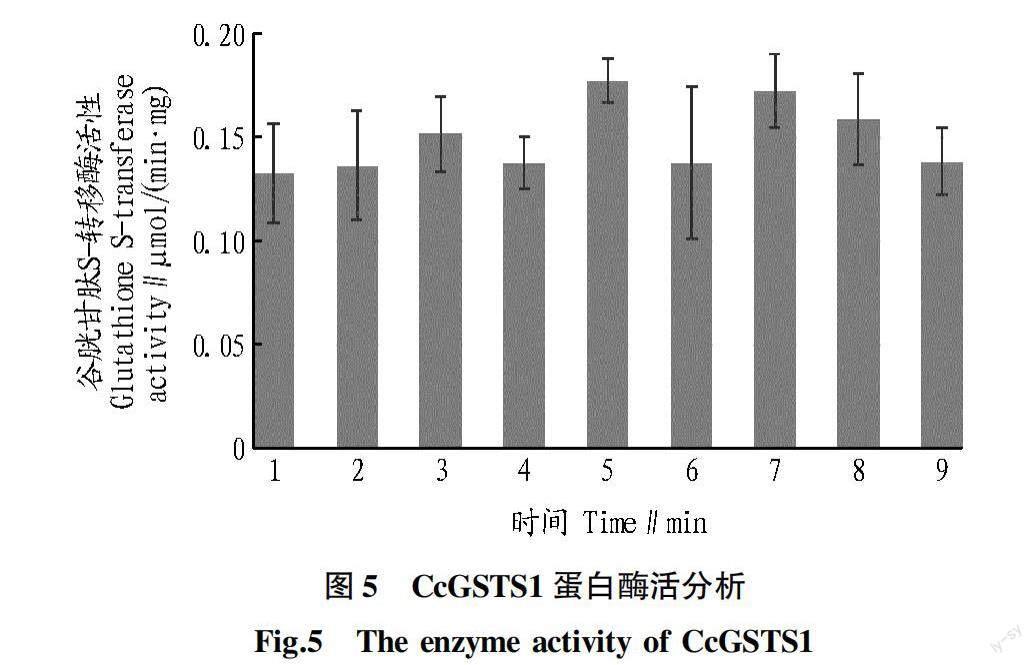
谷胱甘肽S-转移酶催化谷胱甘肽(GSH)与底物(CDNB)结合,其结合产物的光吸收峰为340 nm,酶标仪于 25 ℃条件下,每1 min 测定一次340 nm 处的吸光值,以分析CcGSTS1酶促活性变化。如图5所示, CcGSTS1蛋白活性较稳定,随时间推移,1 min反应产物量与前1 min差异不大。为进一步研究该蛋白的最适反应条件,设置一系列pH梯度,结果显示,酸性pH和碱性pH环境均不利于CcGSTS1蛋白活性,在pH 7.0时,其酶活性达峰值(图6)。说明该蛋白酶促反应活性最适pH为7.0,应用该蛋白进行体外气味分子降解试验时可采用该条件。
3 讨论
谷胱甘肽S-转移酶在昆虫环境适应性、解毒代谢及嗅觉感受系统中都起着重要作用,昆虫的胞质谷胱甘肽S-转移酶可分成6个亚家族Delta、Epsilon、Omega、Sigma、Theta和Zeta。笔者所在实验室早期转录组测序发现32个周氏啮小蜂GSTs基因转录本,其中5个具有全长CDS。笔者选择具有全长CDS的一个Sigma亚家族蛋白CcGSTS1进行序列及系统发育分析发现,其与Sigma家族的丽蝇蛹集金小蜂NvGSTS6、斑痣悬茧蜂MpGSTS1/MpGSTS2、二化螟盘绒茧蜂CchiGSTS2等相似性较高。
为研究CcGSTS1是否能够降解气味,或发挥解毒作用,构建pGEXKG-GSTS1表达质粒,在体外表达、纯化CcGSTS1蛋白,并以CDNB为底物对重组CcGSTS1酶活性进行检测,结果表明,重组CcGSTS1可催化GSH与CDNB结合,其结合产物在340 nm有明显光吸收。每隔1 min连续测量发现,9 min内CcGSTS1酶活性无明显衰减。可在酶反应体系中加入气味分子或毒性物质,检测该气味分子或毒性物质是否对CDNB产生竞争性抑制作用,从而明确CcGSTS1是否对该气味分子或毒性物质具有结合降解作用。该研究建立了CcGSTs体外功能研究体系,为进一步研究周氏啮小蜂谷胱甘肽S-转移酶功能奠定基础。
参考文献
[1]DERMAUW W,VAN LEEUWEN T.The ABC gene family in arthropods:Comparative genomics and role in insecticide transport and resistance[J].Insect biochemistry and molecular biology,2014,45:89-110.
[2]ARMSTRONG R N.Structure,catalytic mechanism,and evolution of the glutathione transferases[J].Chemical research in toxicology,1997,10(1):2-18.
[3]XU G,TENG Z W,GU G X,et al.Genomic and transcriptomic analyses of glutathione S-transferases in an endoparasitoid wasp,Pteromalus puparum[J].Archives of insect biochemistry and physiology,2020,103(2):1-16.
[4]HAYES J D,FLANAGAN J U,JOWSEY I R.Glutathione transferases[J].Annual review of pharmacology and toxicology,2005,45:51-88.
[5]ENAYATI A A,RANSON H,HEMINGWAY J.Insect glutathione transferases and insecticide resistance[J].Insect molecular biology,2005,14(1):3-8.
[6]BERENBAUM M R,JOHNSON R M.Xenobiotic detoxification pathways in honey bees[J].Current opinion in insect science,2015,10:51-58.
[7]LIU S,GONG Z J,RAO X J,et al.Identification of putative carboxylesterase and glutathione S-transferase genes from the Antennae of the Chilo suppressalis(Lepidoptera:Pyralidae)[J].Journal of insect science,2015,15(1):1-9.
[8]TAN X A,HU X M,ZHONG X W,et al.Antenna-specific glutathione S-transferase in male silkmoth Bombyx mori[J].International journal of molecular sciences,2014,15(5):7429-7443.
[9]HUANG X L,FAN D S,LIU L,et al.Identification and characterization of glutathione S-transferase genes in the antennae of codling moth (Lepidoptera:Tortricidae)[J].Annals of the entomological society of America,2017,110(4):409-416.
[10]XIA D S,ZHENG R W,HUANG J,et al.Identification and functional analysis of glutathione S-transferases from Sitophilus zeamais in olfactory organ[J].Insects,2022,13(3):1-13.
[11]ROGERS M E,JANI M K,VOGT R G.An olfactory-specific glutathione-S-transferase in the sphinx moth Manduca sexta[J].Journal of experimental biology,1999,202(Pt12):1625-1637.
[12]杨忠岐.美国白蛾的有效天敌——白蛾周氏啮小蜂[J].森林病虫通讯,1990,9(2):17.
[13]杨忠岐.我国重大林木害虫生物防治研究进展(一)[J].林业科技通讯,2018(4):40-43.
[14]鄭雅楠,祁金玉,孙守慧,等.白蛾周氏啮小蜂Chouioia cunea Yang的研究和生物防治应用进展[J].中国生物防治学报,2012,28(2):275-281.
[15]高军,顾宇书,邹立亚,等.美国白蛾周氏啮小蜂有效积温及发育起点温度试验[J].防护林科技,2008(2):22-24.
[16]杨忠岐,张永安.重大外来入侵害虫——美国白蛾生物防治技术研究[J].昆虫知识,2007,44(4):465-471,622.
[17]LI M,YANG Y X,YAO Y H,et al.Isolation and identification of attractants from the pupae of three lepidopteran species for the parasitoid Chouioia cunea Yang[J].Pest management science,2020,76(5):1920-1928.
[18]PAN L N,GUO M Q,JIN X,et al.Full-length transcriptome survey and expression analysis of parasitoid wasp Chouioia cunea upon exposure to 1-dodecene[J].Scientific reports,2019,9(1):1-11.
[19]SHI H X,PEI L H,GU S S,et al.Glutathione S-transferase (GST) genes in the red flour beetle,Tribolium castaneum,and comparative analysis with five additional insects[J].Genomics,2012,100(5):327-335.
