儿童幽门螺杆菌三联疗法根除疗效及影响因素分析
2024-01-13余仲苏周西西张慧华李中跃
耿 甜 余仲苏 周西西 刘 波 张慧华 李中跃
重庆医科大学附属儿童医院消化科 国家儿童健康与疾病临床医学研究中心 儿童发育疾病研究教育部重点实验室 儿童发育重大疾病国家国际科技合作基地 儿科学重庆市重点实验室(重庆 400014)
幽门螺杆菌(H.pylori)感染是导致儿童和成人慢性胃炎、消化性溃疡、胃癌等胃肠道疾病的主要因素[1]。此外,在儿童中还可能与生长发育迟缓、口臭和顽固性缺铁性贫血等胃肠外表现有一定关系[2]。感染H.pylori后不给予彻底的杀菌治疗,细菌将持续定植在胃黏膜中,长期慢性的感染将导致黏膜发生萎缩、肠化生等病变,从而增加远期罹患胃癌的风险[3]。标准三联疗法作为根除H.pylori的一线治疗方案,该方案包括1 种质子泵抑制剂(proton pump inhibitors,PPI)和2 种抗生素(阿莫西林、克拉霉素,对青霉素过敏者可用甲硝唑代替阿莫西林)。近年来国内外越来越多的研究显示标准三联疗法的根除率正在下降,已不能满足临床需求[4]。H.pylori根除率低下的原因包括治疗方案选择不当、患者依从性差、细胞色素CYP 2 C 19基因多态性、H.pylori毒力基因包括细胞毒素相关基因A(cagA)和空泡毒素A(vacA)基因、胃内高细菌负荷以及H.pylori对抗生素耐药性的产生等。
我国也推荐标准三联疗法为一线治疗方案[5],但2014 年的一项meta 分析显示我国标准三联疗法的根除率仅为74.5%[6],并且我国儿童感染H.pylori的原发耐药率很高,北京在2019 年报道的儿童感染H.pylori对克拉霉素和甲硝唑的耐药率分别为96.6%、57.5%[7],标准三联疗法不再适合经验性使用,但体外药敏试验结果与体内药物实际疗效可能存在差异。关于重庆地区儿童H.pylori标准三联疗法的疗效尚无确切数据,因此本研究拟对本院收治的H.pylori感染患儿标准三联疗法根除疗效及疗效的影响因素进行分析,从而指导临床治疗。
1 对象与方法
1.1 研究对象
回顾性收集2020 年3 月25 日至2020 年7 月31日在重庆医科大学附属儿童医院消化科门诊就诊的患儿资料。纳入标准:①年龄2~18岁;②有不同程度的腹痛、口臭、呕吐、纳差等消化道症状,或无明显症状但有H.pylori感染家族史且监护人要求行H.pylori检查;③13C-尿素呼气试验(DOB≥4.0±0.4判定为阳性)或胃黏膜快速尿素酶试验或组织切片染色三者中有一项阳性;④同意取胃黏膜活检标本进行H.pylori培养及药敏试验、基因检测。排除标准:①检查前4周内有抗生素、PPI、H2受体拮抗剂、铋剂服用史;②严重脑、肺、心、肝、肾、造血、精神等系统疾病及消化道畸形、消化道手术患儿。
儿童H.pylori感染诊断标准参考我国儿童H.pylori感染诊治共识及北美/欧洲儿科胃肠病、肝病和营养学会的指南[2,5],须符合下述四项之一:①细菌培养阳性;②胃黏膜快速尿素酶试验+组织切片染色均阳性;③组织快速尿素酶试验与病理学不一致,则进一步13C-尿素呼气试验或粪便H.pylori抗原阳性;④消化性溃疡出血时,黏膜组织快速尿素酶试验、组织染色任一阳性。
本研究已通过重庆医科大学附属儿童医院伦理委员会批准(No.2017-36-1),纳入患儿监护人均签署临床研究知情同意书。
1.2 方法
1.2.1H.pylori根除治疗方案及根除标准 诊断H.pylori感染患儿采用治疗方案为标准三联疗法:PPI+克拉霉素+阿莫西林,对青霉素过敏的选用PPI+克拉霉素+甲硝唑,总疗程14 d。药物用法:阿莫西林50 mg/(kg·d),分2次,单次最大剂量1 g;克拉霉素15~20 mg/(kg·d),分2 次,单次最大剂量0.5 g;甲硝唑20 mg/(kg·d),分2次,单次最大剂量0.5 g;奥美拉唑0.6~1.0 mg/(kg·d),分2次,餐前口服[5]。H.pylori感染根除成功:根除治疗结束并停药至少4周后进行13C-尿素呼气试验,结果为阴性者。
1.2.2H.pylori菌株分离及鉴定 胃镜下分别取胃窦及胃体处大小约0.2 cm×0.2 cm黏膜活检各1块,标本保存于5%甘油的脑心灌注肉汤培养基中,干冰-80 ℃储存并运送至杭州致远医学检验所实验室进行菌株培养与鉴定。将胃黏膜组织充分研磨后均匀涂布于含5%脱纤维绵羊血的哥伦比亚培养基上(Oxoid 公司),置于37 ℃微需氧条件下(5%O2,10%CO2和85% N2)培养3~5 d。挑选透明可疑菌落进行初步镜检,经革兰染色,尿素酶、过氧化氢酶及氧化酶检测进行菌株鉴定。革兰染色阴性且呈弯曲状的菌株以及三种酶活性试验中均呈阳性的菌株鉴定为H.pylori。
1.2.3 药敏试验 采用琼脂稀释法对培养阳性的H.pylori菌株进行抗生素耐药性检测。采用2倍稀释法进行抗生素梯度浓度稀释,将抗生素溶液加入琼脂中稀释成相应的临界点浓度后(临界点浓度前后各4个浓度),倾注平板。将培养的H.pylori配制成0.5麦氏浊度的菌液接种于各个抗生素平板上培养3~5 d。所选抗生素及其耐药判定标准为:克拉霉素≥1 μg/mL、阿莫西林≥2 μg/mL、甲硝唑≥8 μg/mL。质控菌株为:H.pyloriACTC 11637。在耐药界值平板上生长的H.pylori菌株判定为耐药。
1.2.4 基因检测 使用PureLinkTM组织提取试剂盒分别提取胃黏膜和H.pylori基因组DNA。设计CYP*17-C、CYP2C19*2和CYP2C19*3基因片段引物(表1),以胃黏膜基因组DNA为模板分别进行PCR扩增CYP*17-C、CYP2C19*2和CYP2C19*3基因片段,使用BIO-GENER PCR 扩增仪并进行PCR 扩增。反应总体系30 μL,具体为:预混合液15 μL,正反向引物(10 μmol/L)各1 μL,模板DNA 2 μL,强化缓冲液6 μL,双蒸水5 μL。反应程序为:98℃预变性3 min,进入98 ℃变性30 s,58 ℃退火10 s,72 ℃延伸10 s,循环30个周期后72 ℃延伸5 min。PCR 扩增产物在1%琼脂糖凝胶中电泳并进行Sanger测序。对每个样本的CYP*17-C,CYP2C19*2和CYP2C19*3变异位点进行分析并判断代谢类型。基因型681 AG-636 AG 或681 AA-636 GG 或681 GG-636 AA 判定为慢代谢,681 AG-636 GG 或681 GG-636 AG 判定为中代谢,681 GG-636 GG 判定为快代谢。同样设计vacA、cagA、23 S rRNA 基因片段引物(表1),以提取的H.pylori基因组DNA为模板进行PCR扩增。vacA、cagA基因扩增产物进行2%琼脂糖凝胶电泳并检测片段大小及分析扩增产物。23S rRNA基因扩增产物进行2%琼脂糖凝胶电泳及Sanger测序。23S rRNA基因最常见的变异为A 2142 G 和A 2143 G,若检测到以上变异则判定为克拉霉素耐药。

表1 CYP2C19、vacA及cagA基因引物序列
1.3 统计学分析
应用SPSS 26.0 软件进行数据分析。计数资料以例数或例数(百分比)表示,组间比较采用χ2检验或Fisher精确概率法检验。以P<0.05为差异有统计学意义。
2 结果
2.1 H.pylori检测情况
156例纳入患儿均进行了13C-尿素呼气试验、胃黏膜快速尿素酶试验、组织病理学及培养检查,最终符合H.pylori诊断标准的有138例,其中13C-尿素呼气试验、胃黏膜快速尿素酶试验、组织病理学和培养阳性的分别有125例(90.6%)、135例(97.8%)、126例(91.3%)和112例(81.2%)。
138例诊断H.pylori感染儿童中,17例临床结局失访,12例未依从标准三联方案而采用其他治疗方案,最终共109 例接受14 天的标准三联方案根除治疗,男53 例、女56 例,年龄范围为3.0~15.0 岁,平均年龄(9.6±3.0)岁。见图1。
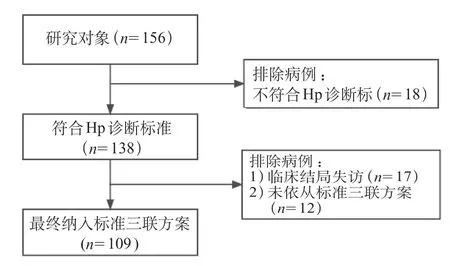
图1 纳入对象流程
109例患儿中,临床症状包括腹痛87例(79.8%)、纳差12例(11.0%)、呕吐8例(7.3%)、口臭7例(6.4%)、消化道出血7 例(6.4%)、嗳气1 例(0.9%)、呃逆1例(0.9%),无明显临床症状4例(3.7%)。内镜诊断为H.pylori相关性胃炎有94例(86.2%),十二指肠溃疡14例(12.8%),胃溃疡1例(0.9%)。
2.2 药敏试验及23S rRNA、CYP2C19、vacA、cagA基因检测结果
培养阳性的112株H.pylori对克拉霉素、甲硝唑的耐药率分别为47.3%(53/112)、88.4%(99/112),未观察到对阿莫西林耐药。102 株H.pylori进行了23 S rRNA 基因检测,其中49 株(48.0%)检测到A2143G变异,没有发现A2142G变异。102株H.pylori进行了CYP 2 C 19基因多态性及vacA、cagA毒力基因检测。CYP 2 C 19基因多态性的快、中、慢代谢型检出率分别为45.1%(46/102)、41.2%(42/102)和13.7%(14/102)。102株H.pylori均检测到cagA基因,其中cagA-D型检出率为98.0%(100/102),cagA-C型检出率为2.0%(2/102)。vacAs 1基因检出率为99.0%(101/102),未检测到vacAs2基因,vacAm1基因检出率为24.5%(25/102),vacAm 2基因检出率为75.5%(77/102)。
2.3 治疗及根除情况
109 例H.pylori感染儿童接受14 天的标准三联方案根除治疗并完成根除情况评估,最终64 例根除成功,45 例治疗失败,标准三联方案根除率为58.7%(64/109)。
14例患儿H.pylori培养阴性,其中8例根除成功,6例根除失败。另外95例患儿H.pylori培养阳性,根据培养的药敏结果,克拉霉素敏感株根除率81.6%(40/49)显著高于耐药株34.8%(16/46),差异有统计学意义(χ2=21.52,P<0.001)。95 例患儿中有8例未进行基因检测(其中5例成功根除),其余87例根据基因检测结果克拉霉素敏感株根除率为76.2%(32/42),耐药株根除率为42.2%(19/45),差异有统计学意义(χ2=10.33,P=0.001)。比较H.pylori根除疗效和克拉霉素基于培养及基因检测的体外药敏试验结果,发现符合率分别为73.7%(70/95)和66.7%(58/87)。见表2。
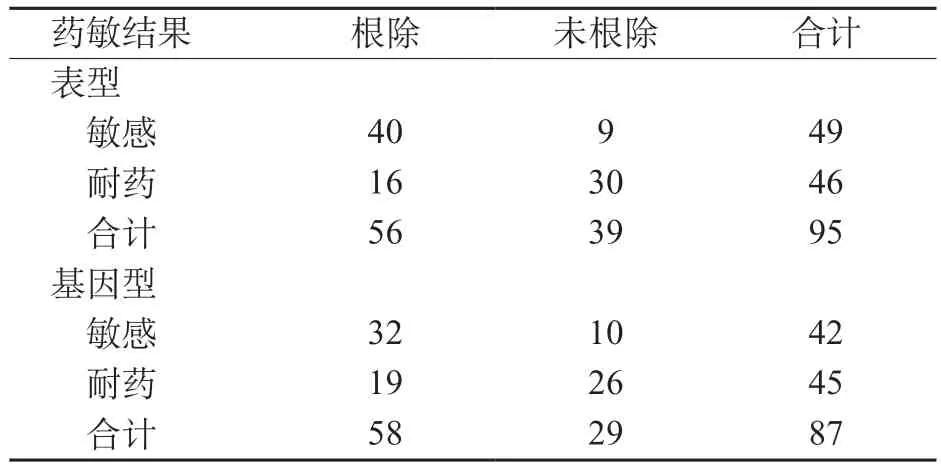
表2 标准三联方案H.pylori根除和克拉霉素体外药敏试验结果符合情况(n)
另外3例H.pylori培养阳性的患儿未依从三联方案,而分别采用了铋剂+PPI+克拉霉素+阿莫西林(1 例对克拉霉素及甲硝唑双重耐药)、铋剂+PPI+克拉霉素+甲硝唑(1例对克拉霉素及甲硝唑双重耐药,1例仅甲硝唑耐药)方案,均成功根除。
2.4 H.pylori三联根除疗法影响因素分析
109 例接受14 天标准三联方案治疗并完成根除情况评估的患儿中,有87 例进行了23 S rRNA、CYP2C19、vacA、cagA基因检测。单因素分析显示,患儿性别、年龄、内镜诊断、黏膜组织病理炎症程度、CYP2C19基因多态性、毒力基因vacA与cagA与标准三联方案根除率无关(P>0.05)。见表3。

表3 109例患儿不同组间H.pylori三联疗法根除率比较
3 讨论
本研究中重庆地区儿童标准三联疗法根除率为58.7%,同国内上海(74.1%)[8]、杭州(42.3%)[9]等及韩国(67.7%)[10]、日本(70.6%)[11]等地区报道的研究结果相似,由于儿童H.pylori标准三联疗法的根除率太低,不再适合临床经验性使用。欧洲马斯特里赫特Ⅴ/佛罗伦萨共识强调,当本地区克拉霉素的耐药率超过15.0~20.0%时,在不能行药敏试验的情况下,初始治疗应放弃含克拉霉素的治疗方案,推荐铋四联疗法为一线治疗方案[1]。以铋为基础的根除方案在儿科中研究数据较少。在比利时儿童中进行的研究发现,包含胶体亚柠檬酸铋、埃索美拉唑、阿莫西林、甲硝唑疗程共10 天的四联疗法的根除率为97.2%[12]。中国一项纳入288例儿童的前瞻性开放性横断面研究发现柠檬酸铋钾、奥美拉唑、阿莫西林和甲硝唑组合的四联方案的根除率(89.8%)优于三联、序贯、伴同疗法[13]。本研究中有3例患儿(2例克拉霉素及甲硝唑均耐药,1例仅甲硝唑耐药)使用包含铋剂的四联方案并均成功根除,铋剂治疗儿童(>6岁)H.pylori感染似乎是有效、安全且耐受性良好的,但本研究数据少,因而不能得出有力的结论,未来仍需更多的研究进一步探索。
全球大部分地区报道的H.pylori对阿莫西林耐药率保持在较低水平(<5.0%)[14],本研究亦未发现H.pylori对阿莫西林耐药,阿莫西林可继续用于重庆儿童感染H.pylori根除治疗。关于PPI与阿莫西林的二联疗法,最近一些研究及meta 分析表明PPI与阿莫西林联合使用时增加给药次数及给药剂量可以提高H.pylori根除率[15-16]。阿莫西林是一种时间依赖的抗生素,每日服用4 次的方案增加胃中阿莫西林的浓度,延长阿莫西林血药浓度高于最低抑菌浓度的时间,同时增加PPI的服药次数,可维持胃内高pH值状态(pH值>6),促进H.pylori增殖进而增强H.pylori对阿莫西林的敏感性,从而共同提高根除率[17-18]。由于阿莫西林耐药少见,当H.pylori对克拉霉素、甲硝唑耐药或不能进行药敏试验时,可考虑采用PPI与阿莫西林高频次、高剂量的二联疗法,但该方案在儿童中的使用方法和疗效有待进一步研究。
cagA和vacA作为H.pylori的最重要的两个毒力基因,研究发现它们与消化性溃疡、胃癌等更严重疾病的发生有关[19-20]。关于cagA与vacA状态和H.pylori根除情况之间的关系仍然存在争议,有研究发现与cagA阴性株相比,cagA阳性株更易根除成功[21]。vacAs1菌株比vacAs2菌株H.pylori根除率更高,而vacAm亚型则与H.pylori根除无明显关系[21]。在中国儿童中的研究发现cagA与vacA的基因型与标准三联疗法根除H.pylori的疗效无关[22]。本研究中亦发现vacA不同毒性的s1m1和s1m2菌株以及cagA-D的东亚型和cagA-C的西方型与H.pylori标准三联方案的根除疗效无关。
基于H.pylori耐药率逐渐升高、根除率逐渐降低的现状,最新的指南建议H.pylori高耐药地区应在根除治疗前行药敏试验以指导临床抗生素的使用,从而提高首次根除率,减少继发耐药菌株的产生[1-2]。国内外的研究及meta 分析也发现基于药敏试验指导的个体化治疗较经验性治疗能显著提高H.pylori根除率[23]。相关研究根据E-test 法药敏试验结果制定治疗方案,发现在对克拉霉素、甲硝唑均耐药的菌株中也能获得良好的根除率(>90.0%)[24]。本研究经验性使用包含克拉霉素的三联疗法根除率仅有58.9%,而根据培养药敏试验和基因检测结果分析,敏感株根除率不理想可能与样本量、体内与体外药敏试验差异等有关。克拉霉素敏感株的三联疗法根除率有所提高(81.6%与76.2%),也支持上述论点。
本研究中95例标准三联方案根除情况和基于培养的克拉霉素体外药敏试验结果的符合率为73.7%(70/95),这表明H.pylori在体内和体外对抗生素的敏感性可能存在一定的差异性。这可能与不同患儿对药物的代谢、体内胃酸分泌、胃内定植的细菌载量、H.pylori在体内耐药机制发生改变以及根除后再次感染等多种因素有关[10]。除了基于培养的方法检测抗菌药物的敏感性,近年来通过对H.pylori耐药机制的研究,已发现H.pylori一些特定位点的基因变异与耐药性的产生有关,例如克拉霉素耐药与23 S rRNA V 区编码的肽基转移酶区的点变异有关[25],有学者也提出了通过分子学方法来预测耐药性指导治疗,本研究中87 例经标准三联方案的根除疗效,和基于基因检测的克拉霉素体外药敏试验结果的符合率为66.7%,这可能与未检测与克拉霉素耐药相关的其他基因如rpl 22和inf等有关,因为本研究仅检测了最常见的变异A 2142 G和A2143G。
PPI的代谢受到CPY2C19基因多态性的影响。在中国人群中进行的meta 分析显示CPY 2 C 19基因多态性可能影响标准三联疗法根除H.pylori的疗效[26],但本研究没有发现CPY 2 C 19基因多态性影响标准三联方案根除疗效,这可能与纳入样本量较小、克拉霉素耐药性、质子泵抑制剂的服用方式等因素的影响有关。为避免CYP 2 C 19基因多态性对根除率的影响,可优先选择受CYP2C19基因型影响小的埃索美拉唑和雷贝拉唑[27]。另外新型钾离子竞争酸抑制剂亦不受CPY 2 C 19基因多态性的影响,它抑制H+-K+-ATP酶介导的胃酸分泌,起效快,抑酸时间长,比PPI 更有效[28]。在日本进行的研究发现伏诺拉生、阿莫西林和克拉霉素的三联方案的根除率(92.6%)显著高于传统三联疗法(75.9%)[29],并且meta分析显示伏诺拉生与阿莫西林的二联疗法在克拉霉素耐药株中也取得良好的根除率(82.0%)[30]。这些方案均可作为重庆H.pylori感染患儿治疗策略的参考,但关于伏诺拉生在根除H.pylori治疗中的剂量、疗程等方面目前尚无确切的结论。
综上,重庆地区H.pylori感染患儿对克拉霉素、甲硝唑有很高耐药率,而对克拉霉素耐药是导致标准三联疗法根除率下降的主要原因。标准三联疗法的实际根除率远低于临床要求,不再适合重庆地区儿童使用。基于药敏试验的个体化治疗方案可作为更好的选择以提高H.pylori的根除率。
