养阴凉血方对过敏性紫癜患儿血清诱导内皮细胞损伤的保护作用
2024-01-10史艳平赵珍珍赵爱霞
何 分,史艳平,李 霞,赵珍珍,邱 锐,赵爱霞
(1.陕西中医药大学,陕西 咸阳 712046;2.西安市儿童医院,陕西 西安 710003)
作为一种儿童血管炎最常见形式且易累及全身细小动脉和毛细血管的血管变态反应性疾病,过敏性紫癜(Henoch-schnlein purpura,HSP)目前发病率为十万中约有18.6人患病[1]。研究显示,过敏性紫癜在学龄期儿童中发病率越来越高,且男童发病率高于女童,发病时间多为秋冬交替之季[2],对儿童有严重的健康风险。HSP发病因素复杂,危险因素包括感染、遗传、疫苗接种、食物及药物等,但其确切病因和发病机制目前仍处于探索中[3]。有研究表明在HSP病程急性期,患儿的血清可刺激内皮细胞分泌合成多种炎性因子,导致血管受损,其在过敏性紫癜患儿发病机制中发挥关键性作用[4]。另有学者认为在遗传与环境因素的作用下,机体免疫紊乱也参与了HSP发病,尤其是免疫球蛋白A(Immunoglobulin A,IgA),IgA类免疫复合物沉积及异常糖基化等均提示其在HSP的发生发展中发挥不可替代的作用[5]。研究发现髓样IgA Fc受体(FcαRI/CD89)在HSP及紫癜性肾炎(Henoch-Schonlein purpura nephritis,HSPN)患儿肾活检表达中均明显升高,提示CD89参与HSP及HSPN的发病[6]。内皮细胞也称血管内皮细胞,是形成血管内壁的一层高度分化的单细胞层,具有吞噬和免疫作用,内皮细胞在各种致病因素影响下发生损伤是包括过HSP在内的多种血管炎发病的关键环节。有研究指出内皮细胞损伤与HSP发病密切相关[7]。相关实验也表明,内皮细胞损伤后分泌的细胞因子可通过激活补体系统、调节机体免疫功能、参与炎症反应等促进过敏性紫癜的发生发展[8]。故选择性保护血管内皮细胞、调控血管内皮细胞的炎症反应以及血管内皮细胞的靶向治疗也给予HSP的预防和治疗一种新的干预手段和思考方向。中医认为过敏性紫癜属“血证、斑疹、肌衄、紫癜风”之类[9]。有关紫癜风中医证型分布研究结果显示,血热妄行证为学龄期儿童患过敏性紫癜最主要的证型[10]。治以清热凉血、益气摄血、滋阴降火等。中医中药治疗过敏性紫癜的道路始终在不断发展及创新。西安市儿童医院史艳平主任医师基于多年临床经验,所自拟经验方养阴凉血方在过敏性紫癜治疗中取得较好疗效,但具体作用机制尚不清楚。基于此,本实验项目以人脐静脉内皮细胞(Human umbilical venous endothelial cells,HUVECs)为研究对象,利用过HSP患儿血清刺激HUVECs而诱导的过敏性紫癜模型,同时加入不同浓度的养阴凉血方进行保护,通过此种方式研究观察养阴凉血方对血管内皮细胞的保护作用并探讨其可能治疗机制。
1 资料与方法
1.1 一般资料 收集2022年6月至2022年12月收治于西安市儿童医院中西医结合科明确诊断为过敏性紫癜,且中医辨证属血热妄行证患儿30例,其中男16例,女14例,平均年龄(7.1±2.0)岁。正常对照组则搜集同时期就诊于西安市儿童医院门诊体检科、年龄相仿的健康儿童30例,男16例,女14例,平均年龄(7.0±2.3)岁。
西医诊断标准: 参照2005年欧洲风湿病协会修订的过敏性紫癜诊断标准[11]及《诸福棠实用儿科学》[12]中过敏性紫癜诊断标准。中医诊断标准:符合《过敏性紫癜中医诊疗指南》[13]中血热妄行证诊断标准:明确诊断为过敏性紫癜,皮肤瘀点密集,甚至成片,色泽鲜红。可伴有面赤、心烦、大便干燥、发热,部分患儿伴有腹痛及关节肿痛。病例纳入标准:符合诊断标准;年龄3~12岁的初诊者;病程1~7 d。排除标准:非首次发病或发病时间超过1周;对本次治疗药物过敏者;已接受相关药物治疗(如免疫抑制剂、糖皮质激素类等);合并心、肝、肾等系统严重疾病。
1.2 细胞、主要试剂、仪器和药物 HUVECs购自上海市东方医院GMP实验室(国家干细胞库)。抗体AKT(MC010);PI3K(sc-365290);P-PI3K(ab191606);人TNF-α、IL-8、IgA、CD89检测试剂盒(上海西唐);电泳槽(型号JY-SCZ2+);电泳仪(JY300HC);生物酶标仪(ELX800);高速冷冻离心机(湘长设备,D170302);荧光显微镜(CKX53);养阴凉血方的药物组成为水牛角、茜草各10 g,生地8 g,板蓝根、金银花各6 g,玄参、白芍、甘草各5 g,川芎、白花蛇舌草、丹皮各4 g,均为药物颗粒剂,该方中所需中药颗粒剂购自三九集团,取药物颗粒制剂用热水混合,完全融化后静待10 min,浓缩及过滤除菌后,得到浓度为0.5、1 g/ml的药液,置于-20 ℃冰箱保存备用。
1.3 实验方法
1.3.1 制备血清:符合纳入标准入组病例儿童于空腹采外周静脉非抗凝全血2 ml,置于常温条件下静放2 h,用高速离心机离心15 min后提取血清,分装于EP管,每管200 μl,并做好相关规范标识,置于-80 ℃超低温冰箱中备用。以上过程均需保证无菌操作。
1.3.2 HUVECs的培养:首先在1640培养基(含青霉素/链霉素,10%胎牛血清)中将细胞株复苏培养,再放入37 ℃,含5% CO2的恒温培养箱中培养传代。根据细胞生长状况,选取细胞进行以下实验研究。
1.3.3 细胞分组:①空白对照组:HUVECs;②HSP组:HUVECs+2 g/ml HSP血清;③养阴凉血方低浓度组:HUVECs+2 g/ml HSP患儿血清+养阴凉血方(浓度为0.5 g/ml);④养阴凉血方高浓度组:HUVECs+2 g/ml HSP患儿血清+养阴凉血方(浓度为1 g/ml);⑤正常对照组:HUVECs+2 g/ml健康儿童血清。
按每孔106个细胞将分化成熟的HUVECs接种于6孔培养板中,每孔体积2 ml,置于细胞培养箱(37 ℃,5%CO2)中培养,待细胞长至部分融合后,每孔用PBS缓冲液清洗2遍。除空白对照组及正常对照组外,余各组加入2 g/ml HSP血清造模,干预24 h后,按照分组要求加入养阴凉血方治疗24 h。
1.3.4 ELISA法检测HUVECs中TNF-α、IL-8、IgA、CD89含量:末次给药后,继续培养24 h后收集上清液。按照试剂盒说明书步骤进行操作,结束后立即测定结果,测定各孔的吸光值并绘制检测标准曲线,计算标本TNF-α、IL-8、IgA、CD89含量。
1.3.5 Western blot检测HUVECs中PI3K/AKT/NF-κB信号通路相关蛋白表达:收集细胞,用预冷磷酸盐缓冲液洗涤细胞,添加裂解液进行低温裂解,提取总蛋白,BAC定量, SDS-PAGE电泳分离蛋白,转膜封闭。一抗(加入PI3K抗体)4 ℃下孵育过夜,次日与加入辣根过氧化物酶标记的二抗 (1∶2000) 常温孵育1 h。在膜表面均匀滴加化学发光液,避光反应1~2 min。化学发光法检测目的条带,压X线片曝光。用Image J计算条带灰度值,蛋白质的相对含量以目的蛋白与β-actin条带平均灰度值的比值表示,进行统计分析。

2 结 果
2.1 各组HUVECs细胞形态学变化 见图1。空白对照组HUVECs显微镜下可见细胞生长形态良好,贴壁生长,呈短梭形,边界清楚;加入正常患儿及HSP患儿血清处理之后,细胞会出现数目减少、形态皱缩;相比于正常对照组,HSP组细胞总体趋势较差;养阴凉血方干预后,细胞数目及形态总体变化趋势较HSP组改善,且养阴凉血方高浓度组更明显。

图1 各组HUVECs细胞形态学变化(×100)
2.2 各组TNF-α及IL-8水平比较 见表1。与正常对照组和空白对照组相比,HSP组HUVECs中TNF-α、IL-8含量明显升高(P<0.05);与HSP组比较,养阴凉血方低、高浓度组HUVECs中TNF-α、IL-8含量随着中药浓度增大明显降低(P<0.05)。

表1 各组TNF-α、IL-8水平比较(pg/ml)
2.3 各组IgA及CD89水平比较 见表2。与正常对照组和空白对照组相比,HSP组HUVECs中IgA、CD89含量明显升高(P<0.05);与HSP组比较,养阴凉血方低、高浓度组HUVECs中IgA、CD89含量随着中药浓度增大逐渐下降(P<0.05)。

表2 各组IgA、CD89水平比较(pg/ml)
2.4 各组HUVECs中PI3K、p-PI3K蛋白表达比较 见图2。HSP组和养阴凉血方低、高浓度组的PI3K蛋白水平与空白对照组和正常对照组比较,差异无统计学意义(P>0.05),而磷酸化的PI3K(p-PI3K)水平则显著增高(P<0.05);与HSP组比较,经不同浓度养阴凉血方干预后p-PI3K蛋白表达水平明显降低,差异具有统计学意义(P<0.05)。
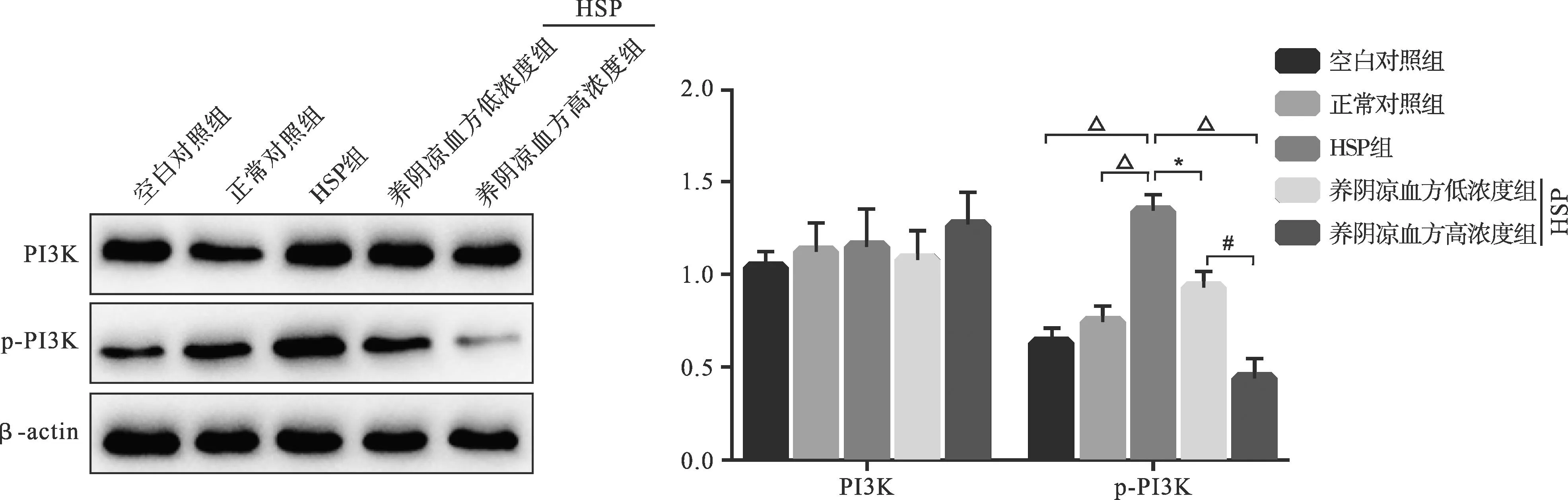
注:与空白对照组比较,*P<0.05;与HSP组比较,#P<0.05;与正常对照组比较,△P<0.05
3 讨 论
过敏性紫癜现多称为IgA血管炎(Immunoglobulin A vasculitis,IgAV),这种小血管炎的特点是可触及的紫癜、腹痛、关节炎或关节痛和肾脏受累[14]。过敏性紫癜属于自限性病程疾病,大多数患儿预后良好,远期预后取决于是否并发肾脏损伤,肾脏病变常较迁延,可严重影响患儿生活质量,预后相对较差[15]。作为一种发病原因和发病机制尚不十分清楚的自身免疫性疾病,过敏性紫癜至今仍无理想的治疗方法,且目前国内外缺乏完善、规范的诊疗共识。西医学治疗缺乏特异性药物,临床上目前常主要是控制感染,去除病因,以抗过敏药、糖皮质激素、免疫抑制剂等为主,目的大多是有效阻断炎症进程,快速缓解病情,减少肾脏损害。现代医学虽然能病理性抑制疾病,短期疗效虽好,但长期治疗稳定性欠佳,不良反应多,且停药后容易复发,同时给患儿及家长带来较大的心理、经济负担。中医学认为小儿为“纯阳之体”,外邪入侵易趋化热,血受寒则凝,受热则行,络伤血溢则成病,血溢肌肤,则外见紫癜。中医药治疗本病根据疾病所处阶段整体审查、全面判断并制订合理的诊疗方案,疗效确切,且不良反应少,增强机体免疫力,减少肾脏损害及复发[16]。中医学对其独特的认识和治疗优势,未来治疗发展方面,随着其理论和治疗手段不断发展完善,与西医协同增效,力求为每一位紫癜患儿提供规范化、个体化的诊疗,提高患儿生活质量。
综合过敏性紫癜病因病机在古今文献记载及临床观察研究发现,紫癜风的病因病机主要与“风、热、毒、湿、瘀、虚”等因素相关,而导致过敏性紫癜病情反复、迁延难愈的重要病因则为血热和血瘀,并且血热及血瘀贯穿该病病程始终,故应针对相关病因及症状进行对症治疗。本实验中所选取的养阴凉血方对于儿童过敏性紫癜的临床症状有较好的改善作用,提高临床疗效,缩短疾病病程,减少肾脏损害及复发。该方以养阴清热、凉血解毒为治疗原则,方中水牛角、茜草共为君药,发挥清热凉血散瘀等作用。现代药理研究表明[17],水牛角水解物能缩短出血时间、降低毛细血管通透性、升高血小板而呈现明显的止血作用,对血管具有良性调节保护。而茜草味苦性寒,善走血分,既能凉血止血,又能化瘀止血,有助于皮肤紫癜消退等方面的治疗。臣以甘寒质润的生地黄与玄参,两者均能清热凉血,养阴生津。常相须为用。同时板蓝根和金银花清热解毒也作为臣药则起到辅助作用,随着药理学研究深入,金银花在抗菌、抗病毒、抗炎、抗氧化活性、抗凝血、保肝护肝等方面都有很好的效果[18]。佐以“血中气药”川芎,既能活血祛瘀,又能行气,善通达气血。佐以白芍补血养血,补益虚劳。佐以临床上清热解毒的抗炎良药之白花蛇舌草,最后佐以牡丹皮清热凉血,活血化瘀。使以甘草调和诸药,兼顾护脾胃。全方药简力专,切中紫癜风病的病因病机,集凉血、活血、养血三法之组合,诸药相配,标本兼治,疗效显著。
IL-8作为一种炎症趋化因子,其对机体产生的免疫作用具有双向性。在多种炎症疾病的发生发展过程中作为不容忽视的重要介质而发挥抗感染、抗肿瘤以及免疫调节等重要功能。IL-8在内皮细胞、中性粒细胞、单核细胞等多种细胞中均可表达,存在促进炎性反应等作用。有研究显示[19],在过敏性紫癜患儿病程的急性期,白细胞会升高,出现多核白细胞浸润血管的周围,激活内皮细胞产生较多的IL-8, 同样的,IL-8不断增加也促使白细胞聚集于血管周围,释放出较多蛋白酶,导致血管出现炎性损伤。有研究发现[20]急性期过敏性紫癜患儿血清中IL-8表达异常升高,并多由内皮细胞损伤分泌产生。肿瘤坏死因子-α (Tumor necrosis factor-α,TNF-α)一方面可诱导其他炎症因子合成及释放,导致局部组织炎症的发生发展,另一方面也可诱导血管内皮细胞过度表达黏附分子,损伤血管内皮[21]。有研究发现[22]TNF-α可激活HUVECs 内信号通路,诱导HUVECs的凋亡,显著增加炎症因子表达,诱导炎症反应,达到加重内皮细胞损伤的目的。另有实验表明,TNF-α及其他相关炎性因子在患儿血清中的变化不仅能够反映病情严重程度,也能起到评估预后的作用[23]。本实验发现,与HSP组比较,低、高浓度中药组HUVECs中TNF-α、IL-8含量明显降低,且随着中药浓度增大含量逐渐下降。由此推测,养阴凉血方在人体内发挥减缓血管炎性反应的作用可能与抑制血管内皮细胞分泌TNF-α、IL-8等炎性因子有关。
IgA属于高度糖基化的免疫球蛋白,在过敏性紫癜发病过程中发挥着关键作用。研究发现HSP患儿急性期血清IgA水平明显升高[24];肾脏组织活检可见IgA沉积[25];HSP模型组小鼠IgA异常糖基化程度显著高于正常对照组[26],均提示IgA与过敏性紫癜存在密切的联系。另有报道称IgA的表达在HSP评价中意义重大,可以较好地评估肾脏功能受损害及预后情况[27]。目前已发现的IgA受体主要有5类,作为一种髓系来源的细胞,并且广泛表达于中性粒细胞中,FcαRI(CD89)是真正意义的IgA Fc受体,能与所有形式的IgA结合,属于免疫球蛋白受体超家族成员,在机体免疫防御和维持系统免疫平衡方面扮演着重要的角色[28]。目前,随着对IgA及其Fc受体的结构、功能等深入研究,其重要性也逐渐引起人们认识,孕育着人们对炎症性疾病治疗的新思路。通过研究HSP患儿皮损组织,发现CD89呈强阳性表达,提示CD89参与急性期HSP发病[6],并可能作为急性期HSP的重要分子标记[29]。本实验发现, HSP组HUVECs中IgA、CD89表达呈升高趋势,也提示IgA、CD89在HSP的发病过程中具有一定的作用,且低、高浓度中药组HUVECs中IgA、CD89含量随着中药浓度增大逐渐下降。由此推测,养阴凉血方可能通过降低HUVECs中IgA、CD89表达,抑制人脐静脉内皮细胞增殖发挥细胞保护作用,帮助机体恢复免疫平衡。
磷脂酰肌醇3激酶(PI3K)/蛋白质丝氨酸苏氨酸激酶(AKT)/核转录因子κB(NF-κB)是一种能够对下游因子进行调控,在细胞凋亡、增殖、炎性反应等生物学过程的调节中发挥重要作用的细胞内信号通路[30]。随着分子生物学研究的深入,PI3K/AKT/NF-κB信号通路因广泛参与细胞内信号转导而成为研究热点。PI3K作为一类通过磷酸化或去磷酸化在体内多个方面发挥重要作用且与细胞内信号传导密切相关的第二信使分子[31],正常情况下以非磷酸化形式在体内存在,当被各种促炎物质活化后可发生磷酸化(p-PI3K),在免疫细胞受体激活信号传导中发挥重要作用。研究显示,通过降低PI3K/AKT/NF-κB信号通路上所调控的血管内皮细胞相关促炎因子的表达,可减轻HUVECs的炎症刺激和活化作用,提高细胞活力,改善细胞形态[32]。本实验发现,通过过敏性紫癜患儿血清诱导使HUVECs内PI3K发生磷酸化,经过养阴凉血方干预后其磷酸化水平降低。由此推测,养阴凉血方可通过某些靶基因来激活PI3K/AKT/NF-κB信号通路以此来维持内皮细胞存活。
综上所述,养阴凉血方治疗过敏性紫癜效果明确,降低机体TNF-α、IL-8、IgA、FcαRI(CD89)水平,其作用强弱与养阴凉血方剂量大小呈正相关。可能的作用机制为通过抑制血管内皮细胞中PI3K蛋白的表达,进而抑制PI3K/AKT/NF-κB信号通路上下游相关靶基因表达,减少相关免疫因子如TNF-α、IL-8、IgA、FcαRI(CD89)的分泌,维持内皮细胞存活,从而达到免疫调节,减轻炎性反应的目的。另外,本研究相关结果也提示FcαRI(CD89)与HSP具有相关性,可能为疾病的诊治提供新依据,未来有望成为重要的治疗靶点,因为病例数量少,其具体作用机制尚不清楚,仍需要进一步深入研究。本实验所选PI3K/AKT/NF-κB信号通路在许多疾病的演变过程中扮演着关键角色,目前研究该通路的多个关键蛋白靶点逐渐成为关注重点。PI3K有一个直接的下游靶点蛋白激酶B(AKT),同时AKT也可激活IκB,使IκB从NF-κB上脱落并被泛素化,使得NF-κB由抑制状态被激活,而活化的NF-κB进入细胞核,激活靶基因释放炎症介质,诱发炎症反应[33]。PI3K/AKT/NF-κB信号通路上关键蛋白核因子(NF-κB)与炎症密切相关,因此,探索该相关信号通路旨在为过敏性紫癜的未来研究提供有价值的信息和思考[34]。由于本实验时间及科研经费有限,纳入样本量略少,未能进一步探讨其他客观指标及检测其信号通路下游相关靶基因蛋白表达水平。待今后进一步完善其信号通路下游相关靶基因蛋白表达水平检测及延长实验时间以进一步探讨养阴凉血方治疗过敏性紫癜机制。
