通腑理肺汤对脓毒症肠屏障损伤大鼠肠黏膜组织闭锁小带蛋白-1、闭合蛋白 mRNA及蛋白表达的影响
2024-01-10柳蔓,吕波,李兰,陈立
柳 蔓,吕 波,李 兰,陈 立
(1.贵州中医药大学第二附属医院儿科,贵州 贵阳 550001;2.贵州中医药大学第一附属医院重症医学科,贵州 贵阳 550001;3.广东省中医院急诊科,广东 广州 510120)
脓毒症主要由各种病原微生物等侵入机体后引发的感染反应失调,最终导致的一系列器官功能衰竭的一种综合征,其致死率呈逐年上升趋势。随着病情进展,会造成脓毒症休克,引起多器官功能综合征(Multiple organ dysfunction syndrome,MODS)[1]而危及生命。肠道屏障指肠道上皮具有分隔肠腔内物质,防止致病性抗原,如细菌和内毒素向肠腔外组织、器官和血循环移位的结构和功能的总和。脓毒症肠屏障损伤的病理基础在于,脓毒症可引起肠屏障功能紊乱甚至肠衰竭,肠屏障功能损害还可促使肠道内菌群移位[2-3],使脓毒症反应再次加重,因此,脓毒症肠屏障损伤的互为影响,对于如何保护肠道功能、减少菌群移位引起的肠损伤,成为当今脓毒症肠屏障损伤的重要内容。研究显示,肠道黏膜的主要细胞质跨膜蛋白和调节蛋白闭合蛋白(Occludin)、闭锁小带蛋白-1(ZO-1)表达的高低与肠黏膜通透性成反比关系,当Occludin、ZO-1蛋白表达降低时,肠道黏膜通透性明显增强,进而造成肠屏障的破坏。中医药干预脓毒症肠黏膜屏障损伤近几年受到关注,但治疗多偏向在单纯应用通腑法改善肠屏障功能,效果不确切[4]。现代研究已经证实,脓毒症肠屏障损伤同时伴有肺功能损伤[5],基于“肺与大肠相表里”理论为指导,应用“肺肠合治”治疗原则,创立的通腑理肺汤(TFL),临床上广泛用于脓毒症胃肠功能衰竭危重患者的救治,收到了确切的临床效果[6],但对脓毒症肠黏膜屏障干预的具体机制不清。本研究通过采用育肠结扎穿孔(CLP)法建立实验动物模型的基础上,应用TFL干预,检测大鼠肠黏膜组织紧密连接蛋白ZO-1、Occludin mRNA基因及蛋白表达,同时在光镜及透射电镜下行肠黏膜组织病理观察,进一步探讨TFL在脓毒症发生时,对肠黏膜屏障造成损伤的机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:SD大鼠购自于SLAC ANIMAL公司[动物生产许可证号:SCXK(沪)2017-0015],由贵州中医药大学实验动物中心提供。按随机数字表法分为假手术组、模型组、TFL低剂量组、TFL高剂量组,每组各10只。
1.1.2 实验试剂:Occludin抗体(货号:ab216327,美国Abcam公司);ZO-1抗体(货号:#2847,美国CST公司);SYBR GreenqPCR试剂盒(货号:RR820A,日本Takara Biotechnology公司)、逆转录试剂盒(货号:A3500,日本Takara Biotechnology公司);BCA蛋白定量试剂(货号:pc0020,北京索莱宝科技);蛋白酶抑制剂(货号:60237,江苏康为世纪);Western Blotting Luminol Reagent(货号:sc-2048,Santa Cruz Biotechnolog公司)。
1.1.3 实验仪器:实时荧光定量PCR仪(型号:Light CyclerH 480,罗氏公司);VE186转膜仪(型号:VE186,天能公司);CMax Plus酶标仪(型号:CMax Plus,MD);病理切片机(型号:RM2016,上海Leika生物系统);脱水机(型号:JJ-12J,武汉俊杰);包埋机(型号:JB-P5,武汉俊杰电子有限公司);透射电子显微镜(型号:JEM-1230,日本HITACH公司)。
1.2 实验方法 应用CLP[7]法制作脓毒症肠屏障损伤大鼠模型;假手术组只暴露盲肠,不做穿孔处理。TFL低剂量组造模成功后给予3.6 g/kg体重TFL灌胃;TFL高剂量组造模成功后,按7.2 g/kg体重TFL灌胃干预;模型组、假手术组相同条件下,均按照蒸馏水10 ml/kg体重灌胃干预,以上每组均每天干预1次,实验周期为7 d。本实验中动物处置方法符合动物伦理学标准。
1.3 实验指标检测
1.3.1 肠黏膜组织ZO-1、Occludin mRNA的测定:采用RT-qPCR法检测肠黏膜组织 ZO-1、Occludin mRNA:根据说明书,使用RNA提取试剂盒从SD大鼠肠黏膜组织中收集总RNA。用NanoDrop分光光度计对提取的RNA进行定量。使用特定的引物在50 ℃下逆转录45 min。SYBR Premix Ex Taq与Applied Bio-Rad CFX96序列检测系用于PCR程序。根据以下条件进行PCR:95 ℃ 5 min,然后在95 ℃ 10 s、60 ℃ 15 s和72 ℃ 30 s进行40个循环,最后在72 ℃进行延伸步骤5 min。ZO-1、Occludin的表达水平通过阈值循环Ct确定,相对表达水平通过2-Cq方法计算。RT-qPCR所用引物序列信息见表1。

表1 引物序列
1.3.2 肠黏膜组织ZO-1、Occludin 蛋白的测定:通过蛋白质印迹法(Western blot)检测肠黏膜组织 ZO-1和Occludin蛋白的水平。应用蛋白提取试剂盒从肠组织中分离总蛋白,BCA试剂盒进行定量。在12%的SDS-Polycramide凝胶上分离出约40 μg蛋白质,将凝胶转移到PVDF膜上,5%TBST脱脂奶粉封闭薄膜60 min,参考试剂盒说明书,按照适当比例封闭液稀释一抗,再次将膜转移至一抗中,4 ℃摇床缓慢摇动孵育过夜。回收一抗,再次加入TBST洗涤液,洗涤5~10 min,共3次。稀释抗兔IgG辣根过氧化酶偶联抗体二抗,常温下,摇动孵育120 min,再次回收二抗,加入TBST洗涤液,洗涤10 min,共3次。最后将X线胶片暗示中感光、显影、定影,将印迹与ECL试剂一起孵育并暴露于Tanon5200-multi以检测ZO-1和Occludin蛋白质表达。
1.3.3 肠黏膜组织光镜下病理观察:7 d后,用苯巴比妥钠200 mg/kg腹腔注射将SD大鼠安乐死后观察。收集每只动物的肠黏膜组织并用无菌水冲洗。用70%、80%、90%的乙醇溶液依次将组织脱水,并掺入等量的乙醇、二甲苯。在室温下孵育15 min后,将组织与等量的二甲苯在室温下混合15 min。重复该步骤直至黏膜组织看起来透明。然后用石蜡包埋黏膜组织,切片(4 μm),在光学显微镜下用HE在室温下染色30 min,对肠黏膜组织病理变化进行拍照、观察。
1.3.4 肠黏膜组织透射电镜下超微结构观察:7 d后对SD大鼠用上述相同方法处死,将肠黏膜组织收集起来,用2.5%的戊二醛固定2 h,用0.1 mol/L的磷酸溶液清洗3次。然后用1%的酸液将组织固定2~3 h,再用0.1 mol/L的磷酸液清洗3遍。依次用乙醇(50%、70%、90%、90%)和90%丙酮(V∶V=1∶1)、90%丙酮冲洗组织15~20 min。随后,将肠黏膜组织与100%丙酮在室温下孵育3次,每次15~20 min。用丙酮(100%)和包埋液与组织一起孵育3~4 h。最后,将肠黏膜组织和包埋液在37 ℃的烘箱内依次孵化过夜,在45 ℃的烘箱内孵化12 h,在60 ℃的烘箱内孵化48 h。将肠黏膜组织切成冠状切片(30 μm),载玻片用3%醋酸铀和3%柠檬酸铅染色15 min。在透射电子显微镜下观察和拍摄肠黏膜组织的超微结构变化。

2 结 果
2.1 肠组织中ZO-1、Occludin mRNA表达比较 模型组大鼠肠黏膜组织中ZO-1、Occludin mRNA基因表达对比假手术组均显著降低(P<0.05)。TFL各剂量组大鼠肠黏膜组织中ZO-1、Occludin mRNA基因表达对比模型组均显著升高(P<0.05)。见表2。

表2 肠组织中ZO-1、Occludin mRNA表达水平
2.2 肠组织中ZO-1、Occludin 蛋白水平比较 模型组大鼠肠黏膜组织中ZO-1、Occludin蛋白表达对比假手术组均显著降低(P<0.05,P<0.01)。TFL各剂量组大鼠肠黏膜组织中ZO-1、Occludin蛋白表达对比模型组均显著升高(P<0.05,P<0.01) (图1)。

图1 肠组织中ZO-1、Occludin蛋白表达水平
2.3 肠黏膜组织光学显微镜下观察 见图2。假手术组:肠组织结构及黏膜绒毛无萎缩、无变形、无破坏,排列正常,未见淋巴及中性粒细胞聚集,黏膜组织见血管无损伤;模型组:肠组织结构及黏膜绒毛严重受损,绒毛排列不规则,明显变形,肠黏膜上皮明显肿胀,同时可见固有层明显分离,伴基底层破裂坏死,黏膜组织间可见大量淋巴细胞、中性粒细胞等浸润;TFL低剂量组及高剂量组:肠黏膜上皮组织及绒毛中度受损,黏膜上皮轻度水肿,轻微出血,固有层无分离,轻微肿胀,绒毛结构基本完整,无明显出血坏死,可见少许的淋巴细胞及中性粒细胞聚集。

图2 各组肠黏膜组织病理形态(HE染色,×400)
2.4 肠黏膜组织透射电镜超微结构观察 见图3。假手术组:微绒毛无变形,桥粒完整,绒毛细胞无水肿,线粒体清晰;模型组:微绒毛减少变形,桥粒不完整绒毛细胞水肿更明显,线粒体水肿和空泡改变,肠上皮细胞间隙明显变宽,肠细胞间连接复合体变短变宽;TFL低剂量组及高剂量组:微绒毛密集且规则,肠细胞间呈锯齿状和互锁模式,线粒体清晰。
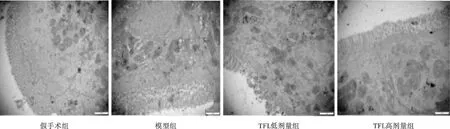
图3 各组肠黏膜组织透射电镜超微结构(醋酸铀和柠檬酸铅染色,×16000)
3 讨 论
肠黏膜屏障是指分隔肠腔内物质,防止致病性抗原,如细菌和内毒素向肠腔外组织、重要脏器和血循环移位的结构和功能的总和[8],具有抵御外来有害物质对机体的侵袭作用[9]。肠道黏膜屏障可分为四个部分:机械、化学、免疫和生物屏障[10-11],其中发挥最关键作用的是肠道上皮细胞构成的机械屏障,肠道上皮细胞之间主要通过Occludin和ZO-1将蛋白质紧密地连接在一起,形成一个完整的生物屏障。Occludin是紧密连接结构中的一种重要结构跨膜蛋白,对于维持细胞间紧密联系以及肠道通透性发挥重要作用。ZO-1蛋白主要分布在细胞质内膜表面,属于胞质蛋白,与骨架结构以及细胞间连接结构的其他蛋白,主要是介导紧密连接的开合作用,起着细胞间紧密连接的枢纽作用。因此,Occludin和ZO-1紧密连接蛋白在肠屏障功能的调节方面有重要的作用。
脓毒症是机体对炎症反应导致的器官功能损伤为主要表现的一种临床综合征,以脏腑功能紊乱和脏器损害为主要表现,病死率逐年升高[12-13]。随着病情进展,可出现肺、肝肾、循环、胃肠道等多个脏器引起MODS[14]。在脓毒症的发生机制中,肠道作为人体最大的细菌和内毒素的贮藏部位,是脓毒症最早侵犯且影响最严重的器官之一,起着重要的作用[15]。研究证实,脓毒症肠道的通透性的增加和菌群移位与肠黏膜组织中ZO-1、Occludin蛋白降低密切相关[16-17]。在多种炎症和病理状态环境中,肠道黏膜紧密连接蛋白在受到炎症介质[18]的刺激下,会导致其黏膜完整性受到损坏,进而出现通透性增强,肠黏膜屏障功能受损[19-20],导致菌群移位,血浆内毒素增加等,最终表现为肠道黏膜组织学及超微结构异常。肠黏膜屏障的破坏,一方面可使经细胞途径的肠腔内抗原和细菌通过增加;另一方面使流经门脉系统和肠系膜淋巴系统的大量细菌、内毒素、抗体等炎性介质增加,最终引起活化炎症级联反应,激活获得性免疫系统,引起免疫反应和组织损伤[21],加重肠屏障功能障碍。因此,肠黏膜屏障功能对脓毒症的发展及预后起着关键作用[22]。本研究显示通过CLP建立的脓毒症肠屏障损伤动物模型,在脓毒症发生时,肠黏膜组织中Occludin、ZO-1 mRNA基因水平及蛋白表达均显著下调,提示肠黏膜紧密连接在炎性刺激下紧密连接蛋白被破坏,导致肠壁通透性增高,黏膜屏障受损,这与过去的实验研究结果相符合[23]。
通腑理肺汤是基于“肺与大肠相表里”理论基础,在国医大师刘尚义学术思想指导下创立,全方由大黄、芒硝、连翘、黄芩、杏仁、厚朴、白及和三七组成,具有通腑泄浊、清热宣肺、化瘀解毒的功效。针对脓毒症肠屏障损伤“邪毒壅盛、热结肠腑”的病理特点,采用“肺肠合治”[24]的治法,在前期及既往的临床试验中显示对脓毒症胃肠功能障碍患者有良好的保护作用[6,25],但是通腑理肺汤对于肠屏障功能的改善作用尚不清楚。故本实验建立脓毒症肠黏膜损伤大鼠模型,从基因、蛋白水平以及肠道黏膜病理组织学、超微结构方面,对通腑理肺汤干预脓毒症肠黏膜屏障进行实验研究。实验研究发现,脓毒症发生时Occludin、ZO-1 mRNA基因水平及蛋白表达量均降低,模型组尤为明显,提示紧密连接蛋白受损,肠黏膜屏障破坏。给予通腑理肺汤治疗后,治疗组大鼠肠组织中ZO-1、Occludin mRNA基因水平及蛋白表达水平显著上升,提示该组方对于ZO-1、Occludin两种蛋白的修复具有很好的效果;同时肠黏膜光镜下病理组织学显示,治疗组肠黏膜上皮细胞水肿、肠黏膜绒毛受损、淋巴细胞及中性粒细胞浸润明显减轻;电镜下超微结构显示肠细胞间呈锯齿状和互锁模式,线粒体清晰,紧密连接轻微受损。因此,本实验研究发现,通腑理肺汤能够减轻脓毒症造成的肠屏障病理损害,改善肠屏障功能,可能是通过调节紧密连接蛋白的表达,改善肠组织紧密连接作用实现。
