保乳术联合术后放疗对乳腺导管内癌患者疗效及VEGF-C、TGF-β1水平的影响①
2024-01-09段锋
段 锋
(河南科技大学第一附属医院放疗科,河南 洛阳 471000)
乳腺癌是女性常见恶性肿瘤之一,其中70%左右的乳腺癌为乳腺导管内癌,该类肿瘤源于乳腺导管上皮细胞,主要因中小导管病变所致[1]。乳腺导管内癌发生后,若出现转移或进展的情况,会导致患者病情急剧恶化,威胁患者生命安全。近年来该疾病发生率逐年上升,且呈现出年轻化趋势[2]。手术切除、放疗、化疗都是临床治疗该疾病的常用方法,保乳术能够保持乳房生理结构完整,相对较容易被患者所接受[3]。有研究[4]报道,患者在实施保乳术治疗后实施放疗,能够在一定程度上降低患者的局部复发风险。目前临床对于保乳术后放疗治疗的效果及安全性尚无定论,基于此,本研究选取了80例2020年1月至2022年1月期间在本院接受保乳术治疗的乳腺导管内癌患者,对其实施术后辅助放疗的效果分析如下。
1 资料与方法
1.1 一般资料
纳入乳腺导管内癌患者80例,均于2020年1月至2022年1月期间在本院实施保乳术治疗。(1)纳入标准:①经影像学检查确诊,符合乳腺癌诊断标准[5];②符合手术指征,自愿采取保乳术治疗;③预计生存时间在1年以上;④不存在脏器损伤或远处转移的情况。(2)排除标准:①术前已发生远处转移;②入组前已接受过放化疗或激素治疗者;③不能耐受放疗药物者;④合并严重器质性病变者。随机数字表法分为两组,各40例。研究组年龄45~71岁,平均(60.33±5.46)岁。病程2~10个月,平均(5.46±2.37)个月。肿瘤直径2.1~5.8cm,平均(4.25±0.56)cm。病理分期:I期17例,II期23例。对照组年龄43~70岁,平均(59.85±5.52)岁。病程1~11个月,平均(5.51±2.43)个月。肿瘤直径2.0~6.0cm,平均(4.09±0.76)岁。其中I期、II期分别为18例和22例。两组一般资料比较(P>0.05),具有可比性。
1.2 方法
入院后,两组均实施影像学检查,并根据检查结果制定相应的手术方案。对照组予以保乳术治疗,做好术前的各项准备工作后,对患者实施全身麻醉,结合病理诊断,确定患者的肿瘤边缘所在位置,然后对其进行腋窝淋巴结清扫。手术切口取决于患者肿瘤所在位置,若位于中上象限,可平行于乳晕行手术切口;对于处于中下象限的肿瘤,可采用放射状的切口。选择在肿瘤边缘外约2cm的位置,将肿瘤切除干净,必要时可进行乳腺叶切除,以确保无病灶残留。操作完成后,予以常规切口缝合、加压包扎和抗感染等处理。
研究组在上述基础上,予以放疗治疗。于术后2~6周进行放射治疗,患者取仰卧位,放疗时平卧在乳房托架上,将头部偏向一侧,对患侧乳房进行照射,在其内外两侧分别放入铅线,并打开数字模拟定位机进行定位,以免损伤患者肺部。照射剂量为50~60 Gy,每周5次,连续治疗4周。
1.3 观察指标
①乳房美学效果:治疗后患者双乳外观正常,大小及质地差异微小,两乳头水平差距在2cm以内为优;患者治疗后双侧乳房轻度不对称,患侧与健侧乳房外形稍不同,两乳头水平距离在2~3cm为良;患侧乳房严重回缩,变形明显,两乳头水平距离在3cm以上为差。统计两组总优良率=(优+良)例数/总例数×100%。②采集两组治疗前后空腹静脉血,采用酶联免疫吸附法对其内皮生长因子C(VEGF-C)及β2-微球蛋白(β2-MG)水平进行测定,所有试剂盒均购自北京索莱宝科技有限公司。③血清肿瘤标志物:收集患者治疗前后空腹静脉血,测定并比较其癌胚抗原(CEA)、糖类抗原15-3(CA15-3)、糖类抗原125(CA125)水平。④并发症及预后情况:统计两组术后并发症发生率,随访1年,统计其局部肿瘤复发和转移情况。⑤生存质量:使用乳腺癌生命质量评估表(FACT-B)评估,包括生理状况、社会状况、情感状况、功能状况4维度,共36条目,各条目评分0~4分,总分144分,分值越高越好。
1.4 统计学方法
2 结果
2.1 两组治疗后乳房美学效果比较
美学效果比较,两组间总优良率无统计学意义(P>0.05),见表1。

表1 两组治疗后美学效果对比[n=40,n(%)]
2.2 两组VEGF-C及TGF-β1水平比较
治疗后,两组患者的VEGF-C及TGF-β1水平均较明显下降,且相较于对照组,研究组各指标水平均更低(P<0.05),见表2。
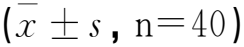
表2 两组VEGF-C及TGF-β1水平比较
2.3 两组治疗前后血清肿瘤标志物水平比较
两组治疗前CA153、CA125及CEA水平比较(P>0.05);治疗后,研究组各指标水平较对照组低(P<0.05),见表3。

表3 两组治疗前后血清肿瘤标志物水平比较
2.4 两组并发症及预后比较
在并发症方面,两组间发生率无统计学差异(P>0.05)。与对照组比较,研究组局部复发率以及转移率均更低(P<0.05),见表4。

表4 两组术后并发症及预后情况比较[n=40,n(%)]
2.5 两组生存质量比较
与对照组比较,研究组治疗后生理、社会、情感、功能状况维度评分均明显更高(P<0.05),见表5。

表5 两组术后生存质量比较分)
3 讨论
乳腺导管内癌属于临床常见恶性肿瘤,可严重影响患者健康。随着现代检查手段的不断进步,乳腺导管内癌检出率也明显提升。对于乳腺导管内癌的发病机制目前仍存在较大争议,当前普遍认为,遗传因素、基因突变、免疫功能下降都是引发该疾病的重要危险因素[6]。据有关资料显示,长时间过度饮酒、乳腺癌家族史、胸部高剂量放射线照射、乳腺腺体致密都有可能导致乳腺癌发生与发展[7]。对于该疾病当前以手术治疗为主,通过手术将病灶彻底清除,能够有效减少疾病复发。全乳切除和保乳术是两种比较常用的手术类型,但临床实践表明,保乳术能够获得较全乳切除相当的疗效,且能够保留乳腺,更容易被患者所接受,故而在临床的应用日益广泛[8]。
保乳手术是一种临床常用的乳腺癌治疗方法,与传统术式相比,其最大的优势就是能够在有效切除病灶的同时,保留乳房的完整性,可更好地满足患者需求。保乳术后予以放射治疗,能够有效杀灭患者残存的肿瘤细胞,减少局部复发,降低患者的远处转移风险,能够在一定程度上延长患者生存时间。为巩固患者疗效,术后辅助放疗在临床较为常用。有学者认为,患者实施保乳术为了获得较好的美学效果,对手术残腔采用的是填充处理,但是在接受放疗后,容易造成术区皮肤塌陷[9]。本研究发现,两组美学优良率方面无显著差异(P>0.05)。说明辅助放疗并不会给患者乳房美学效果造成较大影响,分析其原因可能为:保乳手术可切除全部肿瘤与清除腋下淋巴,保留完整乳房,保障了乳房的美观性,可极大地减轻患者心理负担。残腔采用周围腺体组织进行填充,能够让乳房维持良好美学效果。据有关资料显示,乳腺癌即便处在发病早期,也可能存在远处隐匿性转移的风险,所以在实施手术治疗后还需通过放疗或化疗来控制原发性病灶,以免其发生转移[10]。辅助放疗可消除全身微转移灶,提高患者生存率和保乳术治疗成功率。CEA、CA15-3和CA125属于临床常用肿瘤标志物,VEGF-C可促进淋巴管上皮的增生,促进淋巴管的生成。TGF-β1可通过自分泌和旁分泌机制,调节细胞的增殖与分化功能,其表达水平均越低越好。本研究结果中,经治疗后研究组VEGF-C、TGF-β1、CA15-3、CA125及CEA水平均低于对照组(P<0.05),表明在保乳术基础上,实施放疗治疗可促进患者的肿瘤细胞因子水平下降。两组术后并发症差异不明显,但研究组术后局部复发率、转移率均低于对照组,生存质量评分高于对照组(P<0.05),说明术后放疗的实施并不会增加患者并发症,且患者预后良好,能够有效避免疾病局部复发或远处转移。本研究所选样本量有限,随访时间短,未来还有待进一步增加样本量,延长随访时间,展开更深入的研究探讨。
综上所述,在乳腺导管内癌患者中实施保乳术与术后放疗治疗,能够获得较单纯保乳术治疗更佳的疗效,可显著降低患者的肿瘤标志物水平,可有效改善患者预后,提高患者生存质量。
