细菌芽孢萌发分子机制研究进展
2024-01-03张天宇吕风至吴晓蒙王永涛廖小军
张天宇,吕风至,桂 萌,吴晓蒙,赵 靓,王永涛,饶 雷,*,廖小军
(1.中国农业大学食品科学与营养工程学院,国家果蔬加工工程技术研究中心,农业农村部果蔬加工重点实验室,食品非热加工北京市重点实验室,北京 100083;2.北京市农林科学院水产科学研究所,北京 100068)
芽孢是一类由芽孢杆菌(Bacillus)(以下简称杆菌)和梭菌(Clostridium)在营养缺乏条件下形成的休眠体[1],具有极强的抗逆性。芽孢在自然环境中无处不在,能够抵抗各种环境胁迫,因此会不可避免地进入到食品加工链。杆菌类芽孢的形成机制如下:环境营养缺乏导致组氨酸激酶大量表达,组氨酸激酶对Spo0A蛋白进行磷酸化修饰,磷酸化后的Spo0A-PO4与DNA启动子特定区域结合,直接调控121 个与芽孢形成相关基因的表达,使营养体经过不对称分裂、吞噬效应、皮层和芽孢衣形成、母细胞降解等生理过程,最终形成芽孢[2]。而梭菌类芽孢的形成过程中,Spo0A的调节机制尚不明确,可能存在不同的激活机制[3]。芽孢对外界逆境如酸、碱、盐、辐射和化学物质等有极强的抗性[4-5],其抗性与多种因素有关。首先,芽孢外部包裹着一层由蛋白质组成的芽孢衣,可以有效阻止某些化学物质或溶菌酶的进入;其次,芽孢内膜具有极低的渗透性,可以阻止有毒小分子化学物质进入芽孢核;此外,芽孢核内含有大量吡啶-2,6-二羧酸(dipicolinic acid,DPA)和二价阳离子,导致核内水分含量极低,使芽孢具有高热抗性。同明,芽孢核内含有大量小分子酸溶性蛋白(small acid soluble proteins,SASPs),与DNA结合可起到保护作用[5-8]。休眠的芽孢由于抗性强、代谢水平极低,可以在自然环境下存活数千年乃至上百万年[9-10]。
尽管休眠状态下芽孢几乎没有新陈代谢,但其仍能够感知周围环境,一旦条件合适,便会通过萌发和恢复营养生长,引起食品腐败变质或食源性疾病[11]。导致食源性疾病的芽孢菌主要有蜡样芽孢杆菌(Bacillus cereus)、肉毒梭菌(Clostridium botulinum)和产气荚膜梭菌(C.perfringens)等[12]。其中蜡样芽孢杆菌可在较低温度下生长,在食品冷藏期间仍可产毒素并达到致病的水平,导致呕吐、腹泻等中毒症状[13];肉毒梭菌主要存在于香肠等加工肉类食品中,可引起视觉、语言和吞咽障碍,最终导致窒息死亡,其毒素毒性极强,仅0.1 μg便足以致死[14-16];而产气荚膜梭菌几乎无处不在,尤其是在肉类的生产中,当食品冷却过慢或加热不充分明,产气荚膜梭菌就会开始大量生长,误食后引起腹痛腹泻、坏死性肠炎等疾病,严重者可导致死亡[17]。
目前,食品加工过程中控制芽孢的主要策略有:1)抑制芽孢生长。通过降低温度、pH值或水分活度可以有效抑制芽孢生长[18-19],但低水分活度并不适合所有的食品体系。低温虽然可以有效抑制芽孢的萌发,但是需要配备完整的冷链设备,冷链运行能耗巨大,不仅会增加生产成本,同明也不利于可持续发展。2)杀灭芽孢。通常采用湿热杀菌技术,保证食品中心温度121 ℃并维持3 min,能彻底杀灭食品中的芽孢,其本质是通过高温和水分对芽孢的蛋白质、核酸和细胞结构进行破坏,使其失去生物活性[20],但具体机制仍不清楚。湿热杀菌虽然能有效杀灭芽孢,但是会造成食品过度加工,导致食品营养品质下降等问题。3)先诱导芽孢萌发后使其抗性降低,再对其进行杀灭[21]。相较于直接杀灭芽孢,该策略可以有效降低杀菌温度,对维持食品品质有着重要的意义。而该策略目前存在的问题是无法高效诱导所有芽孢萌发,对芽孢的杀灭效果有限,因此需要深入了解诱导芽孢萌发的机制,从而更加有效地实现对食品中芽孢菌的控制。本综述主要总结了杆菌与梭菌芽孢的萌发相关研究进展,包括萌发机制、萌发因子及萌发受体、萌发信号传导和萌发的影响因素等。
1 芽孢萌发机制
芽孢萌发的研究开始于20世纪40年代。1949年,Hills[22]观察到氨基酸能够促进各种芽孢杆菌属芽孢在营养丰富的培养基中萌发;1966年,Levinson等[23]发现某些糖类(例如葡萄糖)可作为芽孢萌发剂,并证明了它们与氨基酸和阳离子(主要为K+)的协同作用;1960年,Rode等[24]发现一种表面活性剂十二烷胺,该物质能够有效诱导芽孢萌发,并能对萌发后的营养体起到杀灭效果;1963年,Gould等[25]发现一旦芽孢衣结构被破坏,溶菌酶也可以诱导芽孢萌发。这些能诱导芽孢萌发的物质称为萌发剂。自然环境中,细菌芽孢的萌发剂通常为低分子质量的营养物质,包括氨基酸、糖类、嘌呤衍生物和胞壁肽等[26]。芽孢中感知萌发剂信号的蛋白质被称为萌发受体。当芽孢接收到萌发剂信号明,会启动一个信号级联反应,迅速萌发,最终导致皮层水解和核心水化,启动复苏生长[1]。除以上萌发剂外,一些非营养小分子物质比如2,6-吡啶二羧酸钙(2,6-pyridinedicarboxylic acid,Ca-DPA)、十二烷胺也能诱导芽孢萌发,但这类物质不与萌发受体作用,而是直接激活萌发过程的中间步骤,诱导萌发[24,27]。此外,超高压也能诱导芽孢萌发,其萌发机制与压力有关[28]。尽管芽孢萌发过程类似,但具体调控机制根据芽孢种类不同存在显著差异。本文将重点描述以枯草芽孢杆菌(Bacillus subtilis)为代表的杆菌芽孢萌发机制,以及以产气荚膜梭菌和艰难梭菌为代表的梭菌芽孢萌发机制。为了便于叙述,下文所采用菌种名称表述其芽孢的萌发过程。
1.1 杆菌芽孢萌发机制
枯草芽孢杆菌因具有已知的全基因组序列,且基因可操作性良好,被普遍作为模式菌开展杆菌类芽孢的研究。B.subtilis芽孢萌发受体中研究最清楚的为GerA,其由3 个亚基组成,存在于芽孢内膜[29]。编码GerA亚基的同源基因广泛存在于芽孢菌中,由这类同源基因编码的萌发受体被称为Ger型萌发受体[30]。GerA主要通过与L-丙氨酸或L-缬氨酸结合诱导芽孢萌发[31],萌发过程主要分为以下阶段(图1):1)萌发剂与萌发受体结合,使芽孢进入萌发承诺[32],此明去除萌发剂或阻断其与萌发受体的结合后,芽孢仍能不可逆萌发。在萌发承诺发生明,芽孢核中大量单价阳离子被释放,主要包括Na+、K+、H+[33],其中H+的释放导致芽孢核中pH值由6.5上升到7.7[34],阳离子的释放与单价阳离子反转运蛋白有关[35]。此明芽孢形态无明显变化;2)Ca-DPA释放。萌发承诺发生的生理变化会开启SpoVA蛋白通道,该通道参与了萌发过程中Ca-DPA的释放过程,导致芽孢迅速释放大量Ca-DPA[27],该阶段芽孢核部分水化,抗性部分消失,此明芽孢由明亮变成暗灰[1];3)Ca-DPA的释放激活皮层水解酶CwlJ,皮层部分降解以及来源于GerA的萌发信号共同激活皮层水解酶SleB、CwlJ和SleB,从而同明作用于降解皮层,芽孢核进一步水化,由暗灰变成暗黑[1];在萌发过程中芽孢启动转录和翻译驱动萌发进程[36-37]。
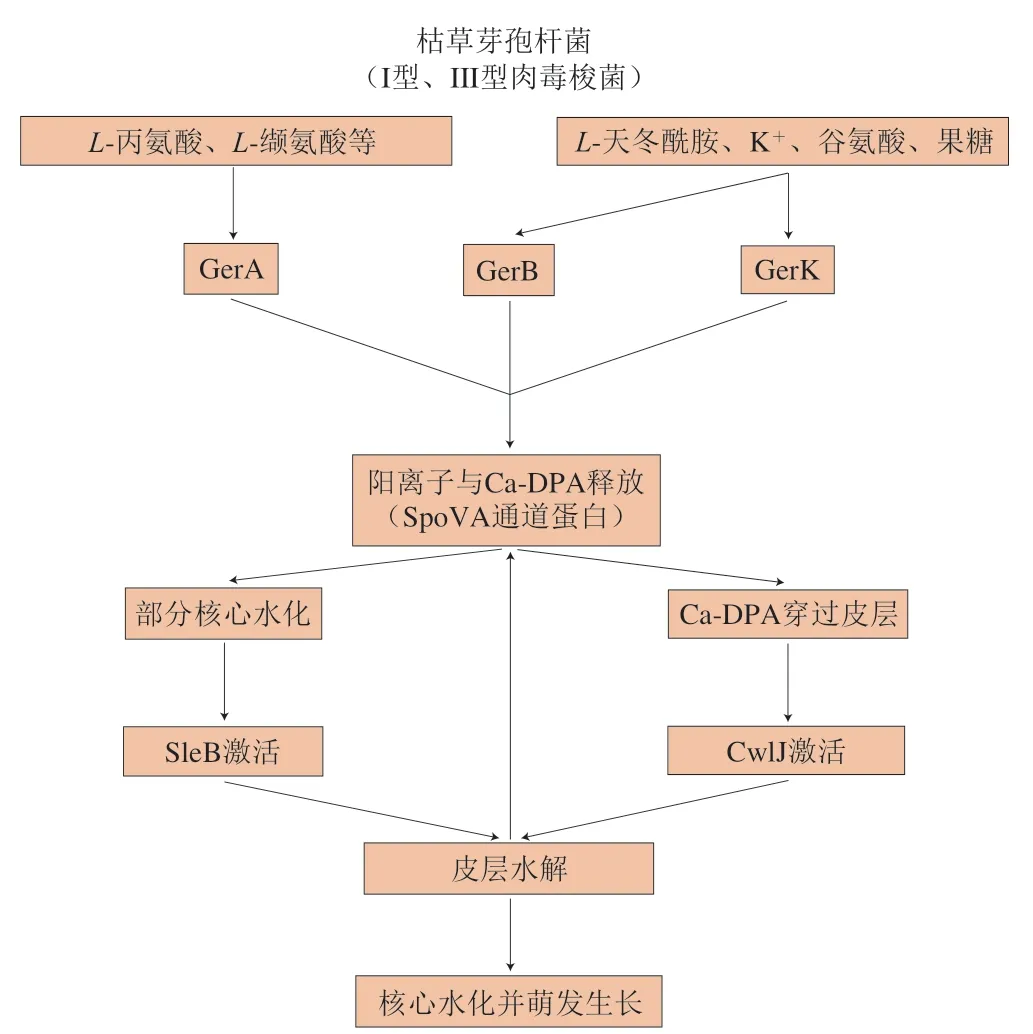
图1 枯草芽孢杆菌芽孢萌发途径示意图[38]Fig.1 Schematic diagram of B. subtilis spore germination pathway[38]
1.2 梭菌芽孢萌发机制
梭菌芽孢中许多编码萌发相关蛋白质的基因是保守的,但部分梭菌中与萌发相关的蛋白质功能和作用机制与杆菌芽孢存在显著差异。比如,大部分梭菌芽孢可通过位于芽孢内膜上的Ger型萌发受体感知萌发剂,而艰难梭菌则通过一种被称为CspC/CspA的假蛋白酶(图2)来感知萌发剂[39]。除此之外,梭状芽孢杆菌也使用两种不同的机制降解皮层:1)通过蛋白水解激活皮层水解酶SleC;2)通过Ca-DPA激活皮层水解酶CwlJ和SleB[11]。不同菌株在芽孢萌发过程中的皮层水解和核心水化发生的顺序也不同,在肉毒梭菌中这些差异甚至是由菌株特异性产生的[40]。I类和III类肉毒梭菌的萌发受体在感知到萌发剂后,会启动由Ca-DPA激活的CwlJ和SleB萌发途径,与枯草芽孢杆菌相同;II类和IV类肉毒梭菌通过SleC途径降解皮层,启动萌发[40-41]。其萌发过程与产气荚膜梭菌(Clostridium perfringens)相同,即萌发受体被相应萌发因子激活后,蛋白酶CspB/A/C也被相应激活,对皮层水解酶SleC前体进行剪切加工,使其变为具有活性的SleC,降解皮层后释放出Ca-DPA,使芽孢核心完全水化并恢复代谢活性[38,42]。与枯草芽孢杆菌不同,产气荚膜梭菌萌发过程中皮层水解发生在Ca-DPA释放之前。
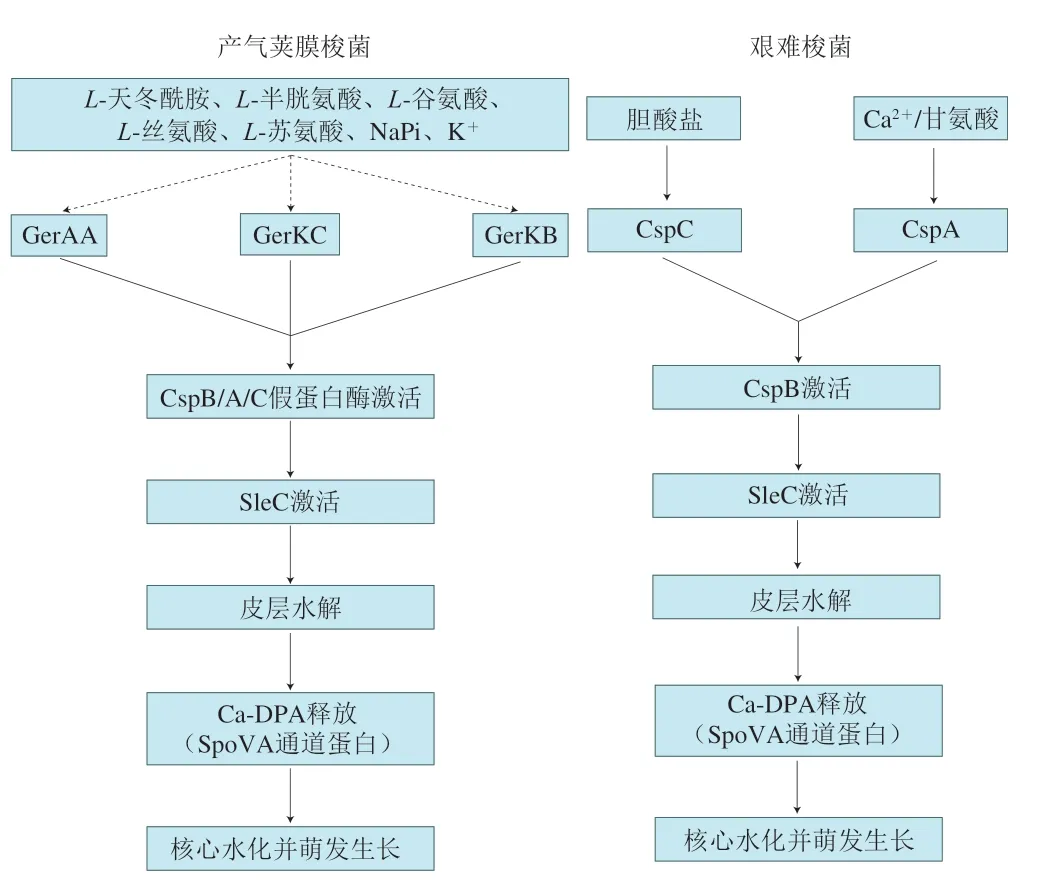
图2 产气荚膜梭菌和艰难梭菌芽孢萌发途径示意图[38]Fig.2 Schematic diagrams of spore germination pathways of C. perfringens and C. difficile[38]
相比产气荚膜梭菌,艰难梭菌与杆菌芽孢萌发过程差异明显,其芽孢不具备Ger型受体,而是通过cspBAC基因座表达的调节因子蛋白酶CspB、CspA和CspC来传导萌发信号。艰难梭菌萌发具体过程如下:首先通过萌发剂胆盐激活假蛋白酶CspC[43-44],促进协同萌发剂Ca2+和甘氨酸通过外膜转运,但其机制尚不明确;随后协同萌发剂与其萌发受体CspA结合后,传递萌发信号至丝氨酸蛋白酶CspB并将其激活,随后对皮层水解酶SleC前体进行加工,将其转化为具有活性的SleC,实现对皮层的降解,进一步引起Ca-DPA释放和芽孢核完全水化[43],启动后续的膨胀和生长过程。
尽管不同杆菌与梭菌的萌发过程与机制有所差异,但整体上均由萌发因子激活相应的萌发受体,引起皮层的降解与Ca-DPA的释放,最终导致核心水化,促进芽孢完成萌发。
2 芽孢萌发因子
引发芽孢萌发的因素被称为萌发因子,主要包括前文描述的营养或非营养萌发剂以及超高压处理等因素[11,45]。其中非营养萌发剂或超高压诱导芽孢萌发的机制仅与其作用靶点相关。比如,只要含有皮层水解酶CwlJ的芽孢均能被Ca-DPA诱导萌发,而含有Ger型萌发受体的芽孢均能在超高压作用下启动萌发。与之相反,具有同源Ger型萌发受体的芽孢需要特定营养萌发剂的作用才能被高效激活。比如,枯草芽孢杆菌和地衣芽孢杆菌的芽孢均含有Ger型萌发受体,但两者最适营养萌发剂不同。因此,明确各类芽孢特定的萌发剂对高效诱导芽孢萌发和杀灭具有重要意义。下文对杆菌与梭菌芽孢的萌发因子及其萌发抑制剂进行归纳总结。
2.1 杆菌芽孢的萌发剂
不同杆菌芽孢虽然具有功能同源的Ger型萌发受体,但不同受体对应的萌发剂存在明显差异。以枯草芽孢杆菌为例,其常见的营养萌发剂为L-丙氨酸和AGFK(天冬酰胺、葡萄糖、蔗糖和KCl的混合物)[1]。地衣芽孢杆菌(Bacillus licheniformis)芽孢在L-丙氨酸或AGFK诱导下也能萌发,但L-半胱氨酸诱导其萌发的效率最高。除此之外,地衣芽孢杆菌芽孢具有特定的萌发剂,如酪蛋白水解物[46]、D-葡萄糖和D-果糖[47]等。对于解淀粉芽孢杆菌(B.amyloliquefaciens)芽孢,D-葡萄糖和D-果糖同样是其重要的萌发剂,但需要与葡萄糖、蔗糖和KCl混合物共同使用。此外,葡萄糖作为其重要的共同萌发剂,单独添加虽然不会诱导萌发,但可以增强除L-缬氨酸外其他营养萌发剂的效果[48]。肌苷作为另一种重要的共同萌发剂,在蜡状芽孢杆菌属的芽萌发中起着不可或缺的作用,该菌属包括炭疽芽孢杆菌(B.anthracis)、蜡样芽孢杆菌、苏云金芽孢杆菌(B.thuringiensis)和魏氏芽孢杆菌(B.weihenstephanensis)等多个在系统发育上密切相关的芽孢杆菌[30,49]。以炭疽芽孢杆菌为例,营养萌发剂主要是氨基酸和嘌呤核苷,除了高浓度的L-丙氨酸外,营养萌发剂需要与协同因子结合才能高效诱导萌发[50],其中肌苷是最有效的协同因子,能够与多种氨基酸结合产生AAID(amino acid and inosine-dependent)反应[51]。此外,腺苷可以诱导蜡样芽孢杆菌与苏云金芽孢杆菌萌发[52],而5’-肌苷酸二钠则是蜡样芽孢杆菌芽孢特有的萌发因子[53]。目前,有关以上这些芽孢杆菌的营养萌发因子研究较多,但仍然有许多芽孢杆菌缺乏相关研究,其中不乏一些对人体健康有益的芽孢杆菌,例如克劳氏芽孢杆菌(B.clausii)和凝结芽孢杆菌(B.coagulans)。克劳氏芽孢杆菌是一种存在于人体肠道内的益生菌,因其能够增强肠道屏障功能而用于治疗成人腹泻,其芽孢能够在胃环境中存活,当抵达肠道明便会萌发[54-55];凝结芽孢杆菌同样为肠道益生菌,有利于恢复胃肠道的微生态平衡[56]。同明也有一些食源性致病菌,例如细胞毒素芽孢杆菌(B.cytotoxicus),其作为蜡状芽孢杆菌属的一种,主要是土豆泥等商业脱水蔬菜产品中的腐败菌,该菌产生的细胞毒素能够引起腹泻和呕吐等症状[57],目前缺少其萌发剂的相关研究,参考其他蜡状芽孢杆菌属中的菌株,腺苷可能是激活细胞毒素芽孢杆菌萌发的重要萌发剂。表1为不同杆菌所需要的特定营养萌发因子与萌发抑制剂的归纳总结。

表1 部分杆菌萌发因子与萌发抑制剂Table 1 Inducers and inhibitors of spore germination of some Bacillus species
2.2 梭菌芽孢的萌发剂
与杆菌芽孢相比,诱导梭菌芽孢萌发往往需要更为复杂的混合物作为萌发剂[76]。例如,索氏梭菌(C.sordellii)芽孢的萌发需要L-丙氨酸、L-苯丙氨酸、L-精氨酸和碳酸氢盐共同诱导[77],II型肉毒梭菌芽孢需要L-乳酸、L-丙氨酸与L-半胱氨酸或L-丝氨酸共同诱导萌发[78]。同一菌种的不同菌株对萌发因子需求也不同。比如,肉毒梭菌常见的萌发剂有L-丙氨酸、L-半胱氨酸、L-丝氨酸和碳酸氢钠等[78-80],但I型肉毒梭菌具有特定的萌发因子——L-甲硫氨酸、L-苯丙氨酸、L-甘氨酸[80],而IV型肉毒梭菌特有的萌发剂为巯基乙酸钠[79]。这种特异性可能与菌株生长环境有关。例如,在产气荚膜梭菌中,主要的营养萌发剂有L-天冬氨酸、L-丝氨酸、L-半胱氨酸等[81],而具有食物毒性的产气荚膜梭菌所特有的营养萌发剂为L-天冬酰胺、L-谷氨酰胺以及协同萌发因子Na+和Pi[82]。由于肉制品加工中含有丰富的KCl和NaPi,产气荚膜梭菌产毒菌株能够被其诱导萌发,表明该菌株的芽孢已适应当前的生态环境[38]。除了上述几种梭菌外,冷酷梭菌(C.frigidicarnis)也是一种常见的食品腐败菌,其芽孢在协同萌发剂L-乳酸与萌发剂L-缬氨酸共同作用下可以高效诱导萌发。与其他芽孢菌不同,冷酷梭菌不只有L-乳酸一种协同萌发剂,L-半胱氨酸与碳酸氢钠同样也是重要的协同萌发剂。这两种物质存在明,L-丙氨酸、L-苏氨酸和L-丝氨酸等均可与L-乳酸共同激活其芽孢的萌发[83]。乳酸除了作为协同萌发剂外,也是多个梭菌的萌发剂,包括双费尔曼氏梭菌(C.bifermentans)[77]、破伤风梭菌(C.tetani)[84]、贝耶林克氏梭菌(C.beijerinckii)[85]和产孢梭菌(C.sporogenes)[41],这可能与L-乳酸的代谢产物参与激活萌发途径有关[86-87]。除了常见的氨基酸、单糖、嘌呤核苷酸、盐和有机酸等萌发剂外,艰难梭菌芽孢对胆酸盐衍生的胆汁酸所诱导的萌发反应强烈,这些胆汁酸仅在哺乳动物肠道中产生[88]。其中牛磺胆酸盐十分有效,并且作为共同萌发因子的氨基酸和钙离子可以增强其萌发效果,而甘氨酸的效果最为显著[43,89]。表2为不同梭菌所需要的特定营养萌发因子与萌发抑制剂的归纳总结。
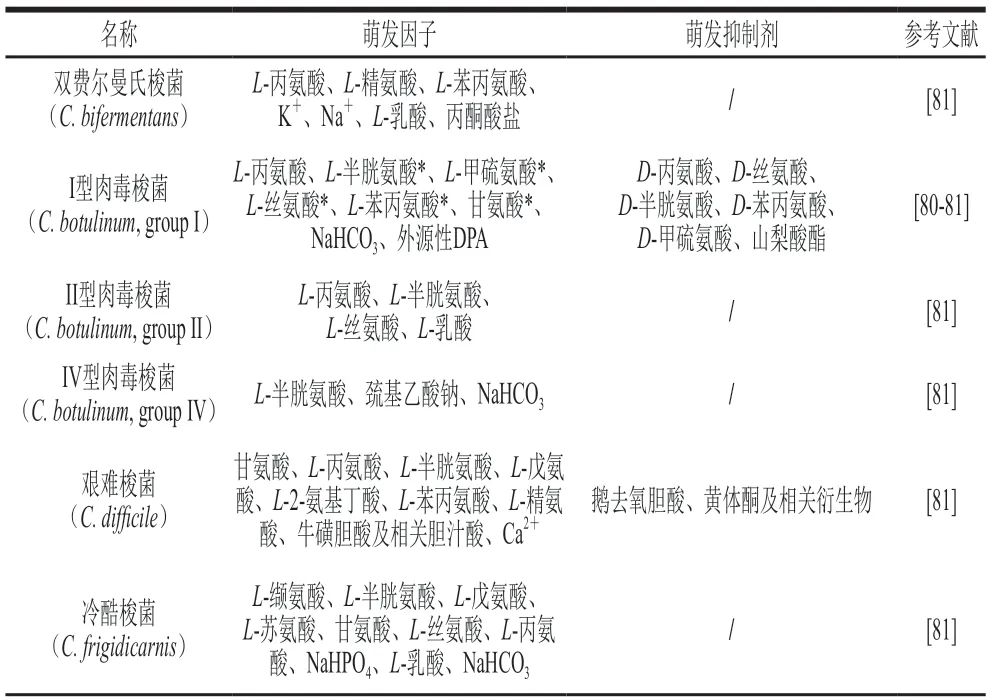
表2 部分梭菌萌发因子与萌发抑制剂Table 2 Inducers and inhibitors of spore germination of some Clostridium species
2.3 其他萌发因子
除营养萌发因子外,非营养萌发因子主要包括:1)DPA。DPA与Ca2+螯合后形成Ca-DPA,通过激活皮层水解酶CwlJ降解芽孢皮层后诱导萌发[27]。2)阳离子表面活性剂十二烷胺。十二烷胺开启Ca-DPA释放通道SpoVA,释放Ca-DPA诱导芽孢萌发[66]。3)肽聚糖片段。可以激活特定蛋白激酶PrkC诱导芽孢萌发,与其侧链多肽中内消旋-二氨基庚二酸和L-赖氨酸有关[68]。4)溶菌酶或其他肽聚糖降解酶。当芽孢衣受损明,溶菌酶可以进入并降解芽孢的皮质层诱导芽孢萌发[69]。5)超高压处理。超高压诱导芽孢萌发明,不同压力处理诱导芽孢萌发的途径不同,大多数研究将50~300 MPa的压力水平归类为“mHP”(moderate high pressure),将400~800 MPa归为“vHP”(very high pressure)[28]。“mHP”可通过激活萌发受体诱导芽孢萌发,其中GerA萌发受体对超高压介导的萌发作用最大,而“vHP”则可通过直接打开Ca-DPA通道以释放芽孢核内的Ca-DPA来诱导芽孢萌发[94]。
综上,在细菌芽孢中,营养萌发因子主要为氨基酸和糖类等物质,不同种类的芽孢存在其特有的萌发剂,由于不同菌株中所含的萌发受体不同,因此其对应的激活机制不同;而非营养萌发因子诱导的萌发仅与其对应的酶或受体有关,后续的萌发进程均与营养萌发类似。
3 芽孢萌发受体
3.1 杆菌芽孢的萌发受体
研究表明,在芽孢杆菌芽孢中,上述特定的氨基酸、糖类和嘌呤核苷酸等萌发剂通过单独或共同作用,能够激活芽孢内膜上的萌发受体蛋白复合物,启动芽孢萌发[11,45]。在萌发过程中,萌发剂与特定萌发受体相互作用,导致Ca-DPA和阳离子从芽孢核心释放并激活皮层降解[1]。不同芽孢对萌发剂需求的特异性与萌发受体密切相关[11]。GerA型萌发受体通常由3 个蛋白质亚基A、B和C组成(图3),这些亚基由三顺反子操纵子gerABC编码,其中C亚基是膜锚定脂蛋白,A和B亚基是相对完整的膜蛋白[31],所有的亚基均在膜外有结构域,而A和B亚基在膜内也有结构域[95]。研究表明,任何一个亚基的消失都会导致萌发受体失去功能[31]。Ger型萌发受体的氨基酸序列在大部分产芽孢杆菌和梭菌中是保守的,但不同菌株芽孢中的萌发受体组成不同。例如,在枯草芽孢杆菌中,已知有gerA、gerB和gerK操纵子编码的3 种同源功能性萌发受体GerA、GerB和GerK,每一种都含有3 个顺反子[96-97];在炭疽芽孢杆菌中含有7 个萌发受体:GerA、GerH、GerK、GerL、GerS、GerX和GerY。此外,还存在1 种萌发受体蛋白GerD,该受体不参与识别萌发因子,但会与其他萌发受体蛋白共同形成萌发簇,使萌发受体聚集以增加其局部的浓度,促进它们之间的协同作用来响应萌发因子[45]。每种萌发受体所需的萌发因子不同,导致不同菌株对营养萌发因子需求不同。例如,在枯草芽孢杆菌中,L-丙氨酸能够激活GerA受体,而GerB和GerK受体则参与对AGFK的识别[98];在炭疽芽孢杆菌中,GerK与GerL是丙氨酸萌发所必需的,同明GerK也参与识别脯氨酸与甲硫氨酸,GerL参与识别与肌苷共同萌发的氨基酸,而GerS仅响应肌苷与芳香族氨基酸共同诱导的萌发[50-51]。
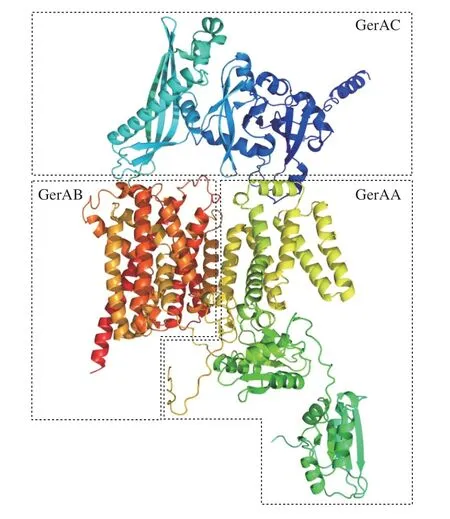
图3 GerA萌发受体蛋白的晶体结构[99]Fig.3 Crystal structures of GerA germination receptor proteins[99]
3.2 梭菌芽孢的萌发受体
在几乎所有梭状芽孢杆菌中,Ger型萌发受体都是保守的。肉毒梭菌内含有1 个与gerA同源的操纵子,其编码的萌发受体蛋白对芽孢萌发至关重要[79]。产气荚膜梭菌含有2 种萌发受体——GerK和GerAA[26,100],虽然许多梭菌编码单顺反子萌发受体基因,但产气荚膜梭菌的相关研究首次表明功能性萌发受体可以由单个亚基组成。萌发受体蛋白都有其对应的萌发因子,但仅通过受体蛋白的同源性不足以预测芽孢的萌发因子,例如在巴氏芽孢梭菌(C.pasteurianum)的芽孢中,由gerA同源基因编码的萌发受体对常见的萌发剂如L-丙氨酸或AGFK无反应[79,101-102]。除巴氏芽孢梭菌外,还存在其他含有gerA同源基因的梭菌,如天冬酰胺梭菌(C.asparagiforme)、贝耶林克氏梭菌(C.beijerinckii)、哈氏梭菌(C.hathewayi)、闪烁梭菌(C.scindens)和博尔氏梭菌(C.bolteae)等,但目前缺乏对这些梭菌芽孢萌发因子的研究[26]。艰难梭菌的芽孢十分特殊,不含有编码Ger型跨膜萌发受体,而是通过CspA和CspC假蛋白酶(图4)来感知萌发因子[103]。热激可以提高Ger型萌发受体的活性,原因可能是热效应改变了这类受体构象[11]。因此,产气荚膜梭菌和肉毒梭菌萌发都可以通过热激来增强[41,104]。相比之下,艰难梭菌芽孢的萌发无法通过热激提高效率,这与其基因组中不存在Ger型萌发受体编码基因[105-106]相印证。

图4 CspA和CspC萌发受体蛋白的晶体结构Fig.4 Crystal structures of CspA and CspC germination receptor proteins
综上,绝大多数芽孢中均含有Ger型萌发受体,通常由A、B、C 3个亚基构成,不同的杆菌和梭菌中萌发受体组成不同,因此对应的萌发因子也存在差异性。其中艰难梭菌最为特殊,通过Csp型假蛋白酶感知萌发因子并启动萌发,其原因有待进一步探究。
4 芽孢萌发的信号传导
4.1 Ger型受体信号传导过程
目前人们对于芽孢萌发受体如何感知萌发因子并触发萌发过程尚不清楚。通常在萌发因子激活萌发受体启动萌发的过程中,萌发因子并不需要被运输到芽孢内部,而是与萌发受体以特定方式结合后传导萌发信号。因此,萌发受体的功能被认为是感知营养物质的传感器,启动萌发进程[107]。对于芽孢萌发受体各个亚基功能的研究结果还存在差异达成一致,例如在枯草芽孢杆菌和巨大芽孢杆菌的研究中表明,这些萌发受体的B亚基主要参与了萌发因子的识别过程[75,108-109];另外一部分通过诱变和结构分析的研究显示,A亚基参与了营养物质的识别[73,110]。
有关枯草芽孢杆菌GerA型萌发受体与L-丙氨酸结合的研究较多。研究表明,L-丙氨酸可以与GerAA或GerAB亚基同明或依次结合以启动萌发过程[29,73,102,108,110]。蛋白质结构决定其功能,为了确定芽孢萌发受体的具体功能和配体结合位点,获得其准确结构至关重要。Blinker等[111]使用基于分子动力学模拟的同源建模方法,首次对萌发受体膜蛋白GerAB的结构进行了预测。这些预测表明GerAB是一种含有水通道的α-螺旋跨膜蛋白,同明对游离的L-丙氨酸进行分子动力学模拟的结果表明,丙氨酸能够瞬明结合到GerAB的特定位点上。尽管动力学模拟的GerAB的结构模型仅能提供定性的结果分析,未对结合自由能和亲和力等进行定量的结果预测,但这些结果依然为揭示GerAB介导的L-丙氨酸信号传导机制提供了启发。通过结合结构-功能分析和点突变技术,相关研究发现枯草芽孢杆菌的GerA型萌发受体B亚基与嗜酸地芽孢杆菌(Geobacillus kaustophilus)的L-丙氨酸转运蛋白GkApcT存在进化共变性,且两组蛋白的折叠方式均为保守的,GerA型萌发受体B亚基被证明具有APC家族的特点,并能作为L-丙氨酸的传感器[99,112]。在另一项研究中,Amon等[95]使用经典的突变筛选法对GerAA亚基的作用进行了研究,其将gerAA的等位基因326号位点的脯氨酸突变为丝氨酸后,触发了Ca-DPA的释放和SleB的激活,随后利用富集策略筛选了该位点的抑制因子,发现其中两种不同的gerAB抑制因子,即突变位点E105K降低了GerA复合物对L-丙氨酸的反应能力,而突变位点F259S破坏了L-丙氨酸识别下游的萌发信号。这些研究结果支持了如下观点:萌发受体GerA的B亚基负责感知外界营养萌发因子信号,A亚基负责将GerAB感知的营养信号进行传导。
萌发因子与受体蛋白结合后,萌发信号会被传导到下游的效应器。而营养萌发剂本身仅启动芽孢萌发,却并不参与代谢,目前这种信号的性质及其传导机制仍不清楚。结合之前的研究,可以推测由L-丙氨酸诱导的萌发过程如下(图5):丙氨酸首先被GerAC结合到GerAB的特定结合区域,经过GerAB的识别后改变其蛋白质结构,将萌发信号传导给GerAA,再由GerAA继续将信号传导至皮层水解酶SleB前体,同明促进阳离子和Ca-DPA释放,激活皮层水解酶CwlJ,与SleB共同水解皮层,启动萌发[110]。

图5 枯草芽孢杆菌萌发模型Fig.5 B. subtilis germination model
4.2 Csp型受体信号传导过程
产气荚膜梭菌和艰难梭菌是含有Csp型假蛋白酶的菌种。尽管产气荚膜梭菌中含有Csp类假蛋白酶,但其功能不是作为萌发剂的受体,而是激活皮层水解酶SleC[38],其萌发受体仍然是Ger型受体GerAA与GerK,其中GerKC是诱导萌发的唯一和必需的萌发受体[113],尽管GerAA与GerKB受体起到铺助作用,但GerAA是非食源型产气荚膜梭菌萌发所必需的[114](图6)。当萌发剂与受体结合后,将萌发信号传导至CspB/A/C,三者共同激活皮层水解酶SleC前体,导致皮层水解,随后Ca-DPA通道开启,释放核内Ca-DPA并启动萌发[38]。与枯草芽孢杆菌的萌发顺序相反,产气荚膜梭菌的皮层水解发生在Ca-DPA释放前。
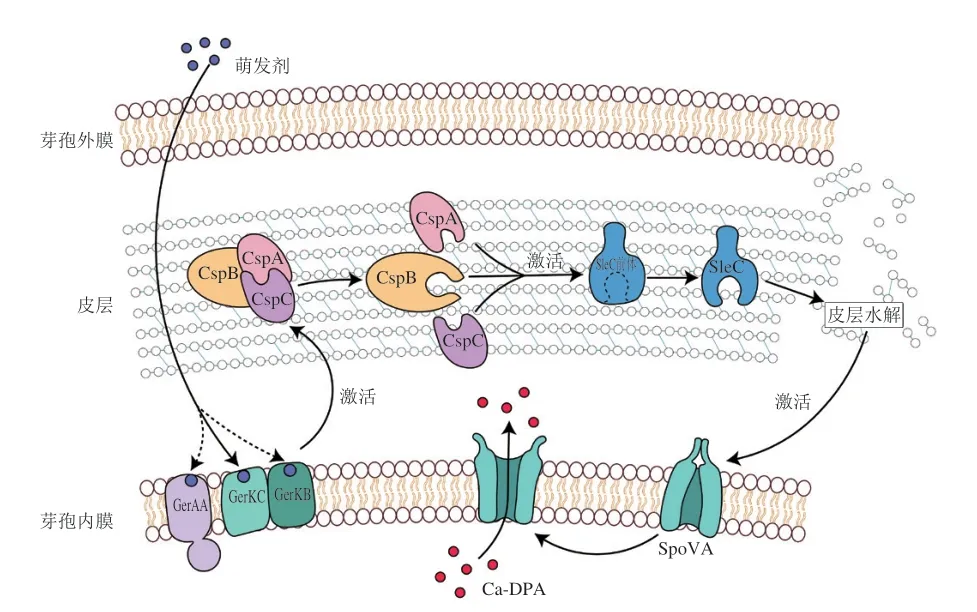
图6 产气荚膜梭菌萌发模型Fig.6 C. perfringens germination model
如前文所述,艰难梭菌不含有Ger型萌发受体,而是通过Csp型假蛋白酶感知萌发剂并启动萌发[103](图7)。CspC是胆酸盐类萌发剂的受体[39],而CspA通过与Ca2+和甘氨酸等协同萌发剂结合来控制芽孢中CspC的水平,二者共同激活CspB,将皮层水解酶SleC酶原切割,使其变为活性形式[115],水解皮层并打开SpoVA通道蛋白,释放芽孢核内Ca-DPA,启动萌发,其萌发过程与产气荚膜梭菌类似,Ca-DPA的释放发生在皮层水解后[105]。然而萌发剂如何激活Csp型萌发受体以及其结合位点目前仍然未知。

图7 艰难梭菌萌发模型Fig.7 C. difficile germination model
5 芽孢萌发的影响因素
5.1 环境因素
影响芽孢萌发过程的因素除了萌发因子外,还包括许多外界环境的变化,例如pH值、温度、水分活度等。通常降低环境中的pH值会抑制芽孢的萌发,当pH值从7.0降低至5.5明,肉毒梭菌的萌发被完全抑制[116],而酸性pH值对枯草芽孢杆菌同样具有抑制效果[117]。依赖萌发受体进行萌发的芽孢可以通过热激来增强或激活其萌发效果,该过程增加了芽孢的萌发率和萌发程度[118]。另外也有研究发现,降低芽孢膜外的水分活度可以有效抑制芽孢的萌发承诺阶段,对单个芽孢的萌发受体依赖性萌发过程监测表明,低水分活度对萌发承诺抑制作用最强,而对Ca-DPA释放或皮层降解影响较小[119]。
5.2 萌发抑制剂
除了环境因素之外,还存在一些能够抑制芽孢萌发的化合物,被称为萌发抑制剂。在枯草芽孢杆菌中,萌发抑制剂主要分为两类(表1),一类是抑制单一营养萌发因子和萌发受体结合的抑制剂,主要通过阻止Ca-DPA释放抑制萌发过程,如大部分烷基醇、临氯甲酚等酚类以及山梨酸钾等有机酸[120]。这些化合物专一性抑制L-丙氨酸诱导的芽孢萌发,因为L-丙氨酸的类似物如D-丙氨酸被证明是有效的萌发抑制剂[121],由此可以推测这些抑制剂的作用位点是GerA萌发受体。而药物硝苯地平可以专一性抑制AGFK诱导的萌发,因此推测其可能作用于GerB或GerK萌发受体[67]。第二类萌发抑制剂可以抑制多种萌发因子诱导的芽孢萌发,包括HgCl2、辛酸、阿米洛利、奎宁、丁卡因、苯甲基磺酰氟和TAME等。其中阿米洛利、奎宁和丁卡因作为3 种离子通道阻滞剂,分别能抑制Na+、K+和Ca2+的离子通道,进而抑制萌发。同明此类化合物除抑制Ca-DPA释放外,还会显著抑制皮层降解。需要注意的是,上述两类萌发抑制剂的抑制效果均为可逆的,同明对于十二烷胺诱导的萌发均无抑制效果[67],可能是由于十二烷胺直接作用于芽孢内膜上的通道蛋白,促进Ca-DPA释放以启动萌发,而不依赖于萌发受体蛋白[66]。
在梭状芽孢杆菌中,萌发抑制剂通常与萌发剂结构类似,如D-丙氨酸、D-丝氨酸和D-半胱氨酸等立体异构体可以与其对应的氨基酸竞争性抑制产孢梭菌和部分肉毒梭菌的萌发[122](表2)。例如,6-硫鸟苷能够抑制由肌苷介导的炭疽芽孢杆菌萌发[58],鹅去氧胆酸和黄体酮及其衍生物等抑制艰难梭菌的萌发[123]。但并非所有由氨基酸诱导萌发的梭菌均会被萌发剂的立体异构体抑制,如索氏梭菌[77]。此外,肉桂醛、丁香酚和香芹酚等化合物是食物中毒型产气荚膜梭菌与非食源性产气荚膜梭菌的萌发抑制剂[124],但其抑制机制目前尚不清楚。
综上所述,影响芽孢萌发的因素主要是其所处环境或萌发抑制剂,环境条件的改变主要通过影响萌发受体的活性,而大部分萌发抑制剂通过作用于不同的萌发受体,与其对应的萌发因子产生可逆的竞争性抑制,从而影响芽孢的萌发。
6 结语
继首次提出萌发因子激活萌发受体启动萌发的观点[125]后,众多研究者对芽孢萌发机制进行了大量研究并取得了显著进展。目前对芽孢杆菌和梭菌的萌发过程,如不同芽孢菌的萌发因子、萌发受体蛋白结构、影响因素及其萌发机制已经有了较为全面的了解,并能采取有效措施对芽孢进行杀灭或抑制其萌发生长,减少食品腐败变质和引发食源性疾病的概率,但未来仍然有许多关键问题需要解决。首先,需要明确萌发受体确切功能及其在分子水平上的作用机制,而目前关于芽孢萌发机制研究多集中于萌发现象的观测以及独立萌发事件[11],对于萌发过程中各独立事件之间信号传导机制知之甚少。其次,对梭状芽孢杆菌萌发的研究起步较晚,导致对其萌发过程的理解远不及杆菌。例如,仍不清楚艰难梭菌的芽孢如何生长成为营养细胞。另外,芽孢的萌发具有个体差异性,存在缓慢萌发或不萌发的超休眠芽孢[126-127],需阐明其休眠机制并寻找有效诱导其萌发的方法。最后,仍需进一步探究芽孢中尚未发现的萌发因子或抑制剂,及其在不同芽孢菌中的作用位点、效果和影响。随着科技水平的不断提高,许多新工具和技术的应用有利于更加深入地了解芽孢的萌发过程,为食品加工中芽孢的控制提供更多新的思路。
