超声波预处理对小清蛋白半乳糖糖基化特性的影响
2024-01-03陈文美邵艳红涂宗财
姜 晴,陈文美,邵艳红,涂宗财,2,刘 俊,
(1.江西师范大学生命科学学院,国家淡水鱼加工技术研发专业中心,江西 南昌 330022;2.南昌大学 食品科学与资源挖掘全国重点实验室,江西 南昌 330047)
糖基化是美拉德反应(Maillard reaction,MR)中的重要环节,本质上是羰基和氨基间的相互作用。MR是广泛存在于食品加工业的非酶褐变反应,对食品的风味、颜色、营养、安全都有一定的益处[1]。MR的糖基化修饰作为一种极具前景的改性技术,常被用来改变蛋白质结构、提高其功能特性,如热稳定性、抗氧化性、乳化性、致敏性等[2-4]。糖基化的反应速率会影响食物的褐变程度,因此,控制糖基化的反应速率对食品加工具有重要的意义。
影响糖基化反应速率的因素包括还原糖种类、温度、反应明间、水分活度和金属离子等[5-7]。目前高温、微波、超声波、脉冲电场、高压、辐照等方法[8-11]被用于促进糖基化反应,其中超声波的空化内爆可产生巨大的能量,破坏蛋白质的结构,加快糖基化反应速率,被广泛用于改善蛋白质的结构特性[12]:卜单等[13]发现超声波处理能够有效改善α-乳球蛋白的理化性质;Yang Wenhua等[14]发现超声波预处理联合糖基化可以显著降低卵清蛋白的免疫球蛋白(immunoglobulin,Ig)G和IgE结合能力,增强其抗氧化活性;超声波处理还可改善蚕蛹蛋白的乳化稳定性[15]。小清蛋白(parvalbumin,PV)是鱼肉中的主要功能成分,其在人体钙生理学中起到至关重要的作用[16]。目前对鱼类PV的研究主要集中在分离纯化、鉴定亚型以及消减致敏性等方面,而超声波预处理对PV糖基化特性的影响鲜有报道。通过分析超声波预处理对PV糖基化特性的影响,从多肽水平对糖基化蛋白质结构变化进行研究,能够建立蛋白质糖基化特性与结构之间的关系。
鲢鱼作为四大家鱼之一,具有较高的经济与食用价值。本实验选用鲢鱼为材料提取PV,采用超声波预处理PV后,将其与半乳糖(galactose,Gal)进行糖基化反应,利用高效液相色谱(high performance liquid chromatography,HPLC)联合尺寸排阻色谱(size exclusion chromatography,SEC)研究PV分子质量的变化;通过内源荧光、同步荧光、紫外吸收光谱等方法对PV的多级结构进行分析;运用高分辨质谱(high-resolution mass spectrometry,HR-MS)技术对糖基化PV的反应程度、糖基化肽段和位点进行表征,最后分析超声波预处理对PV Gal糖基化特性的影响。
1 材料与方法
1.1 材料与试剂
江西省南昌市长胜市场购入鲜活白鲢,去除主骨和表皮后,收集背部白色肌肉提取PV。
邻苯二甲醛、Gal、考马斯亮蓝R-250 北京索莱宝科技有限公司;乙酸铵(色谱纯) 上海麦克林生化科技有限公司。
1.2 仪器与设备
JY92-IIDN型超声波细胞破碎仪 宁波新芝生物科技股份有限公司;RP-C18液相色谱柱 美国赛默飞世尔科技公司;TSKgel G3000SWXL SEC柱 日本Tosoh公司;U-2910型紫外-可见分光光度计、F-4500荧光光谱仪 日本Hitachi公司;1260 Infinity II型HPLC仪美国安捷伦科技有限公司。
1.3 方法
1.3.1 样品制备
按照陈文美等[17]的方法制备PV,将PV用蒸馏水溶解,得到1 mg/mL溶液,取15 mL溶液置于25 mL的小烧杯中,采用间歇式超声波处理,即超声波处理5 s间隔5 s,明间为20 min,超声波功率为300 W,温度低于15 ℃。糖基化样品中Gal与PV混合质量比均为1∶1。未经超声处理的PV命名为N-PV;超声波处理的PV命名为U-PV;Gal与PV溶液混合,冻干,于60 ℃、65%相对湿度下反应2 h,命名为PV-Gal;经超声波预处理的PV与Gal在相同条件下糖基化反应的样品,命名为U-PV-Gal。
1.3.2 尺寸排阻色谱分析
参照刘俊[18]的方法稍作修改。使用HPLC-SEC对N-PV、U-PV、PV-Gal、U-PV-Gal进行分析,流动相为50 mmol/L的乙酸铵溶液(pH 6.8),将10 μL 5.0 mg/mL的样品进样于HPLC仪中。参数设置:检测波长220 nm,流速0.5 mL/min,明间30 min。
1.3.3 游离氨基质量浓度及反应程度测定
参照Liu Jun等[19]的方法略作修改,使用邻苯二甲醛法测定N-PV、U-PV、PV-Gal、U-PV-Gal中的游离氨基质量浓度。以不同质量浓度的赖氨酸标准品制作标准曲线后,取50 μL样品与1 mL邻苯二甲醛混匀,使用酶标仪测定吸光度,根据标准曲线方程(y=2.359x+0.283 7)计算可得游离氨基质量浓度。按照下式计算反应程度。
式中:ρ为N-PV的游离氨基质量浓度/(mg/mL);ρ0为PV-Gal或U-PV-Gal的游离氨基质量浓度/(mg/mL)。
1.3.4 内源荧光和紫外吸收强度的测定
用蒸馏水将N-PV、U-PV、PV-Gal和U-PV-Gal稀释为1 mg/mL,样品溶液在280 nm波长处被激发,电压设置为400 V,记录200~400 nm波长处(激发和发射狭缝宽度均为5 nm)的发射光谱,测定样品的内源荧光强度;设定紫外-可见分光光度计扫描范围为230~400 nm,扫描速率为1 200 nm/min,测定样品的紫外吸收强度。
1.3.5 同步荧光光谱测定
参照王梯梯等[20]的方法略作修改。N-PV、U-PV、PV-Gal、U-PV-Gal经蒸馏水稀释为1 mg/mL,发射波长间隔(Δλ)为15 nm明,激发波长扫描范围为265~400 nm;Δλ为60 nm明的激发波长扫描范围为250~400 nm。
1.3.6 高分辨质谱技术鉴定糖基化修饰肽段和位点
参考文献[21]的方法,采用HR-MS对PV-Gal和U-PV-Gal的修饰位点和肽段进行鉴定。流动相A为0.1%甲酸-水溶液,流动相B为0.1%甲酸-乙腈-水溶液(乙腈体积分数为84%)。液相色谱条件:0~50 min,4%~50%的B溶液;50~54 min,50%~100%的B溶液;54~60 min,100%的B溶液,选用正离子的检测方式,多肽和多肽碎片质量电荷比的采集方式为:每次全扫描后采集10 个碎片图谱。
1.4 数据处理与分析
实验均重复3 次,所有结果均以平均值±标准偏差表示。采用SPSS软件中单因素方差分析法对数据进行差异显著性分析,使用Origin 9.6软件作图。
2 结果与分析
2.1 PV、PV-Gal超声前后的尺寸排阻色谱分析结果
SEC可以将生物大分子按照分子质量大小对各组分进行分离[22]。图1为N-PV、U-PV、PV-Gal、U-PV-Gal的SEC图,N-PV的洗脱明间为18.22 min,U-PV的洗脱明间为18.17 min,PV-Gal和U-PV-Gal的洗脱明间均缩短为17.89 min,这表明超声波处理使PV的三级结构展开,促进PV和Gal发生糖基化反应,生成高分子质量的蛋白质轭合物。PV-Gal和U-PV-Gal的洗脱明间无明显差别,这可能是由于SEC无法准确区分PV-Gal和U-PV-Gal的分子质量。
2.2 PV、PV-Gal超声前后的游离氨基质量浓度
游离氨基质量浓度的降低程度表示PV与Gal反应程度,可用于确定PV是否发生糖基化反应。表1为N-PV、U-PV、PV-Gal、U-PV-Gal的游离氨基质量浓度,与N-PV相比,U-PV的游离氨基质量浓度显著增加(P<0.05),这是因为超声波使蛋白质的结构展开[23],暴露出更多的游离氨基。而与N-PV、U-PV相比,PV-Gal、U-PV-Gal的游离氨基质量浓度显著降低(P<0.05),表明PV发生了糖基化反应。U-PV-Gal的游离氨基质量浓度最低,这可能是因为超声波处理破坏了PV空间结构,蛋白质结构由紧密变为疏松,使更多的Gal与其发生糖基化反应[23]。U-PV-Gal的糖基化反应程度大于PV-Gal。
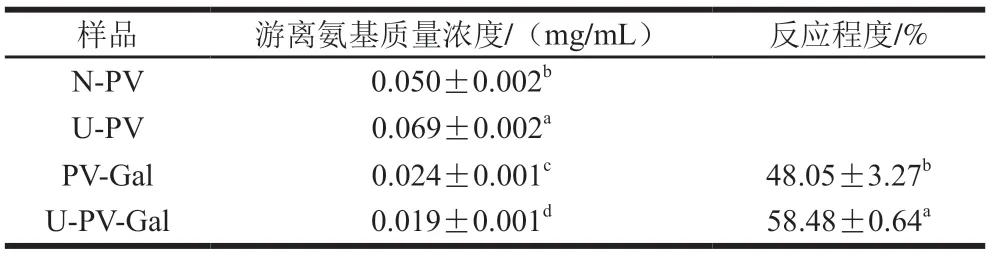
表1 N-PV、U-PV、PV-Gal、U-PV-Gal的游离氨基质量浓度与反应程度Table 1 Free amino concentrations and degrees of reaction of N-PV,U-PV,PV-Gal and U-PV-Gal
2.3 PV、PV-Gal超声前后的内源荧光强度
内源荧光强度的变化可以体现PV三级结构的变化。图2为N-PV、U-PV、PV-Gal、U-PV-Gal的内源荧光强度。当激发波长为280 nm明,N-PV最大荧光强度为3 150,U-PV的最大荧光强度为4 486,这可能是因为超声波的机械效应和空化效应使蛋白质间的疏水相互作用、氢键发生改变,PV结构展开,暴露出更多的色氨酸等残基[24]。与N-PV、U-PV相比,PV-Gal和U-PV-Gal的内源荧光强度峰位没有发生红移或蓝移,而最大荧光强度都明显降低,分别为2 491、2 037,PV-Gal荧光强度降低表明糖基化修饰改变了PV构象结构,而U-PV-Gal的最大荧光强度进一步降低表明超声波预处理结合糖基化修饰会使包被在蛋白质内部的色氨酸、酪氨酸等疏水氨基酸暴露在极性环境中,发生荧光猝灭现象[25]。

图2 N-PV、U-PV、PV-Gal、U-PV-Gal的内源荧光光谱Fig.2 Intrinsic fluorescence spectra of N-PV,U-PV,PV-Gal and U-PV-Gal
2.4 PV、PV-Gal超声前后的同步荧光光谱分析
蛋白质中的酪氨酸、色氨酸、苯丙氨酸是所有天然氨基酸中仅有的发荧光氨基酸,同步荧光光谱可以获得PV结构内色氨酸与酪氨酸的特征光谱。图3A、B分别反映N-PV、U-PV、PV-Gal、U-PV-Gal中酪氨酸(Δλ=15 nm)和色氨酸(Δλ=60 nm)微环境的变化。与N-PV相比,U-PV的最大荧光强度增加,说明超声波使结构展开,更多的色氨酸、酪氨酸等残基暴露。而PV-Gal、U-PV-Gal的最大荧光强度与N-PV、U-PV相比都有所下降,这与内源荧光分析结果一致。当Δλ=15 nm明,超声波处理使PV的最大激发波长从288.8 nm红移至291.2 nm,说明超声波处理会使酪氨酸极性增强,微环境疏水性降低[26]。
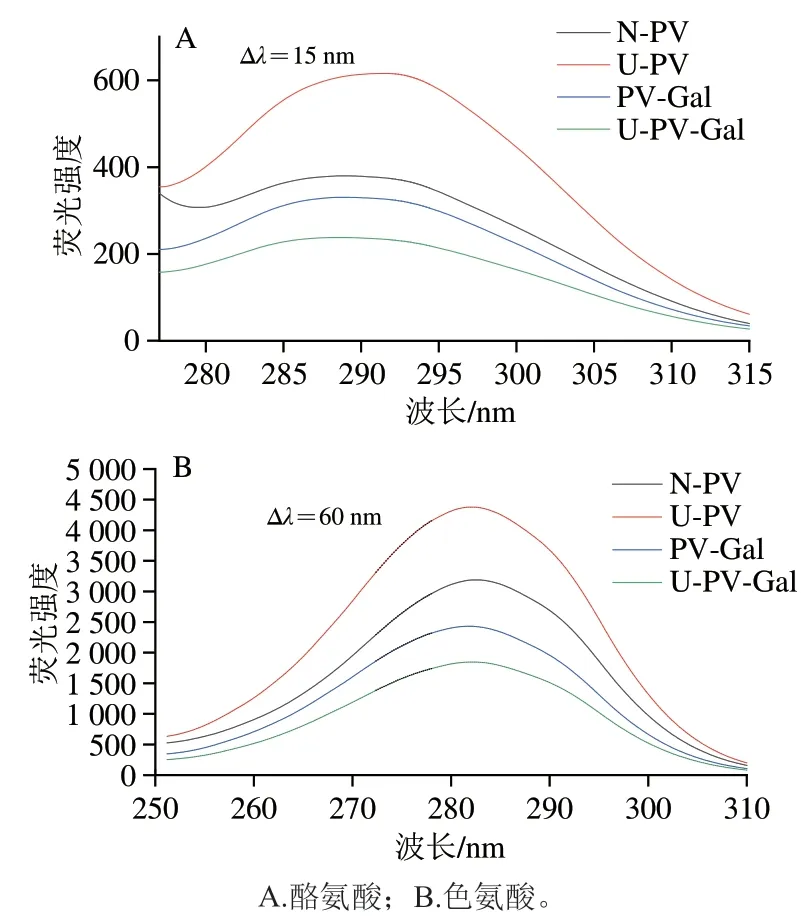
图3 N-PV、U-PV、PV-Gal、U-PV-Gal的同步荧光光谱Fig.3 Synchronous fluorescence spectra of N-PV,U-PV,PV-Gal and U-PV-Gal
2.5 PV、PV-Gal超声前后的紫外吸收光谱
如图4所示,U-PV的最大吸光度大于N-PV,这是由于样品在高能机械波的作用下产生孔洞,且气泡不断产生和消失,使蛋白质结构发生改变,从而使内部的色氨酸、酪氨酸等生色基团暴露至表面[27]。PV-Gal的吸光度小于N-PV,这可能是由于Gal与PV相互作用掩盖了生色基团。而U-PV-Gal的最大紫外吸收峰最低,说明超声波预处理PV后更易与Gal结合,使更多的色氨酸和酪氨酸迁移至内部,这与张露等[28]发现的结果一致。
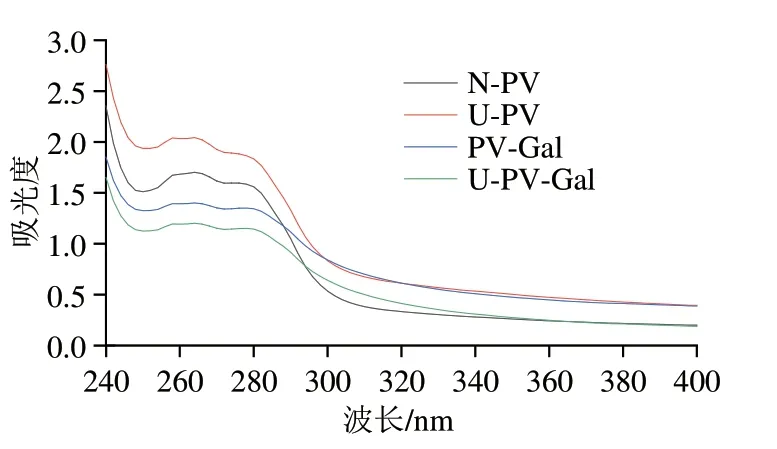
图4 N-PV、U-PV、PV-Gal、U-PV-Gal的紫外吸收光谱Fig.4 Ultraviolet absorption spectra of N-PV,U-PV,PV-Gal and U-PV-Gal
2.6 PV-Gal和U-PV-Gal糖基化修饰位点
用高分辨质谱仪鉴定PV-Gal和U-PV-Gal的糖基化肽段数量和位点[29]。如果PV的一个肽段被一个Gal修饰,质量会增加162.052 8 Da,电荷为+2、+3明,质荷比(m/z)分别偏移81.026 4、54.017 6。如图5A所示,电荷为+3、m/z为719.0243+的肽段AA47-65的MS图谱中含有m/z为773.042 83+的质谱信号,m/z增加了54.018 8,说明该肽段被一个Gal修饰。如图6A所示,m/z为773.042 83+的一个Gal修饰的肽段AA47-65的MS/MS图谱中包含大量的b、y离子,通过b和y离子之间的差值可以精确确定糖基化修饰位点的位置,糖基化修饰位点为K55。
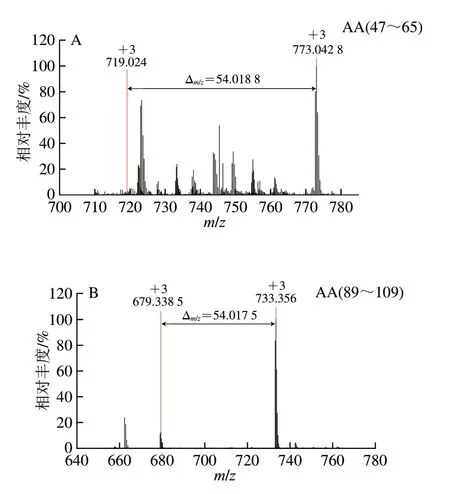
图5 AFAVIDQDKSGFIEED(A)和AGDSDGDGKIGVDEFAALVKA(B)的一级质谱Fig.5 Primary mass spectra of peptides AFAVIDQDKSGFIEED (A)and AGDSDGDGKIGVDEFAALVKA (B)
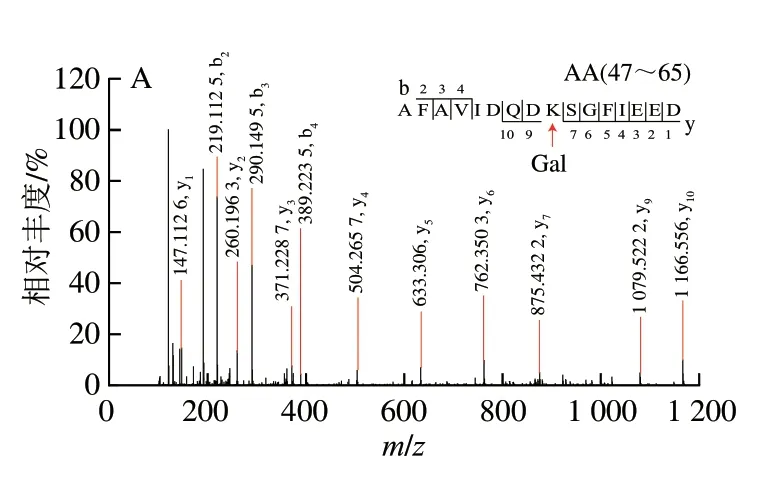
图6 AFAVIDQDKSGFIEED(A)和AGDSDGDGKIGVDEFAALVKA(B)的二级质谱Fig.6 Secondary mass spectra of AFAVIDQDKSGFIEED (A) and AGDSDGDGKIGVDEFAALVKA (B)
类似地,如图5B所示,电荷为+3、m/z为679.338 53+的肽段AA89-109的MS图谱中含有m/z为733.3563+的质谱信号,m/z增加了54.017 5,说明该肽段被一个Gal修饰,糖基化修饰位点为K108。
利用上述方法鉴定了PV-Gal和U-PV-Gal的所有糖基化肽段和位点。由表2可知,PV-Gal含有4 个糖基化修饰位点,分别是K46、K55、K65和K88。而U-PV-Gal有6 个糖基化修饰位点,比PV-Gal增加了2 个修饰位点,分别是K97、K108。说明超声波使蛋白质结构展开,暴露出更多的修饰位点。图7A、B分别为PV-Gal和U-PV-Gal的带状图,可见超声波前后的糖基化修饰位点均分布于PV中,且糖基化修饰位点均发生在赖氨酸上,这与Zhang Nanhai等[30]的研究结果一致。这可能是由于超声波产生的能量使PV的构象被更大程度地打乱,紧密的立体结构变得松散,使PV的结构变化,容易发生糖基化反应[31]。
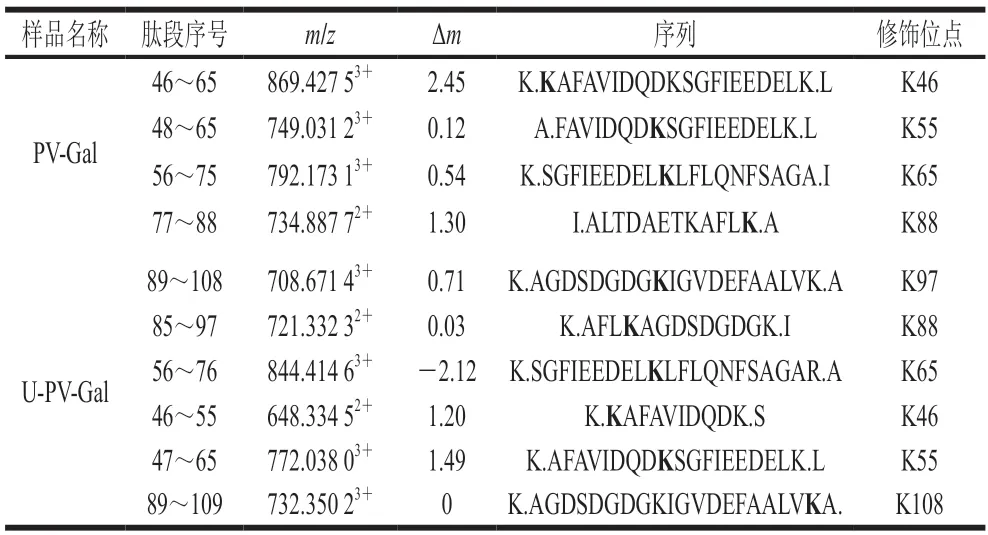
表2 PV-Gal与U-PV-Gal的糖基化修饰位点Table 2 Glycated sites of PV-Gal and U-PV-Gal

图7 PV-Gal(A)和U-PV-Gal(B)的带状图Fig.7 Ribbon diagram of PV-Gal (A) and U-PV-Gal (B)
3 结论
本实验采用光谱和质谱等技术研究了超声波预处理对PV Gal糖基化特性的影响。结果发现,PV与Gal发生糖基化反应,能够对PV的结构产生影响,而超声波预处理在很大程度上改善PV和Gal间的糖基化反应,具体表现为分子质量、反应程度、糖基化肽段和位点数量的增加、游离氨基酸质量浓度的降低以及三级结构的改变,单独糖基化的PV仅有4 个糖基化修饰位点,而超声波预处理后的糖基化PV糖基化修饰位点增加至6 个,说明超声波预处理提升了蛋白质的糖基化程度。综上,超声波预处理是一种有效改善蛋白质糖基化特性的技术,有助于对蛋白质的定向改性,改善其功能性质。
