低能X射线对沙门氏菌的杀菌机制
2024-01-03高雯暄李佳林
高雯暄,李佳林,闫 鹤
(华南理工大学食品科学与工程学院,广东 广州 510641)
沙门氏菌(Salmonella)属于肠杆菌科的革兰氏阴性菌,兼性厌氧,无芽孢和荚膜,绝大多数具有鞭毛和菌毛,可以附着在宿主细胞表面[1]。根据细菌抗原的不同,目前共有2 600多种血清型,其中肠炎沙门氏菌、鼠伤寒沙门氏菌和猪霍乱沙门氏菌是3 种常见引起重大公共卫生问题的人畜共患疾病的血清型[2]。沙门氏菌广泛分布于自然界,可以在许多动物的肠道中生存和繁殖,并通过畜禽肉类和蛋类等农产品传播疾病[3]。被感染的肉类在屠宰、贮藏运输或加工过程中若处于高温高湿的天气条件下极易出现细菌的二次生长[4]。沙门氏菌与单核细胞增生李斯特菌、大肠杆菌O157及金黄色葡萄球菌并列为全球四大食源性致病菌,其危害极大,少量摄入就会引起人体产生发热、呕吐及腹泻等不良反应[5-6]。根据美国疾控中心的数据,美国每年因沙门氏菌感染而送医就诊人数高达26 500 例,致死人数420 例,直接医疗花费约为3.65亿 美元,其中95%以上的人群感染病例是由食物引起的,如受污染的生食烹饪不充分或烹饪后受到交叉污染等[7]。因此,开发积极有效的细菌控制措施是农产品和食品工业中亟待解决的重要问题。长期以来,传统的化学抑菌剂浸泡一直作为消除肉类中食源性病原体以及食品腐败微生物的常见处理方法,如次氯酸、次氯酸盐溶液[8]。由于化学残留安全性、环境降解周期长及过度使用导致的细菌耐药性等问题凸显,迫使农业及食品工业从业者积极寻求杀菌效果显著、环境友好、毒副作用小的新型杀菌技术[9]。低能X射线辐照是指将物体或生物暴露于能量在数百千电子伏以内的X射线以进行生物学研究、食品辐照、材料分析等应用的过程,其能量比传统X射线(约5 MeV)及60Co伽马射线(约2.5 MeV)低很多[10]。该技术作为一种新兴的非热杀菌方式在食品灭菌领域获得了广泛关注,其在对肉蛋奶制品、干制品和果蔬制品等食品中的食源性致病菌灭活方面卓有成效[10-12]。一方面,低能X射线相比于高能X射线具有更高线性能量传递值,射线能量转移到食品或活细胞中大分子物质的过程更加高效,从而引起级联反应,产生大量自由基和辐射降解物[13];另一方面,其柔和性降低了被消毒材料的损坏风险,使得它们可以安全地用于生产线中,且不会对工作人员造成危险或者产生对于大规模铅屏蔽的需求[14]。
低能X射线杀灭微生物的机制主要包括:1)引起细胞膜电位去极化,破坏生物膜脂质并分解纤维素结构中的糖苷键,使胞外多糖数量减少[10];2)电离辐射诱发水分子产生超氧化物和羟自由基,损伤细胞内的DNA并产生活性氧[11];3)使细胞内源酶活性丧失和葡萄糖摄取系统受损[13]。尽管目前已有较多从细胞水平上分析低能X射线杀菌机制的报道,但从分子水平阐释沙门氏菌杀灭机制的报道还很匮乏。深入了解低能X射线对沙门氏菌的影响机制,分析沙门氏菌在低能X射线辐射下DNA、能量代谢和毒力等转录水平特征,有助于针对性地制定控制和消除农产品中沙门氏菌的策略。转录组学技术(RNA sequencing,RNA-Seq)可以检测细菌中几乎所有的转录基因,揭示细菌在不同胁迫条件下的基因表达变化规律,是研究基因表达和调控机制的重要手段[15-16]。综上所述,以低能X射线为研究对象,明确其对沙门氏菌的杀菌效果和亚致死效应,研究其对沙门氏菌细胞形态结构的影响,最后通过RNA-Seq高通量测序从转录组水平探究其对沙门氏菌作用的基因靶点。
1 材料与方法
1.1 菌种、材料与试剂
肠炎沙门氏菌(Salmonella enteritidis)S010保藏于本实验室,于2010年分离自河北省某大型超市的冷冻食品。
大豆酪蛋白琼脂培养基(tryptose soya Agar,TSA)和胰酪大豆胨液体培养基(tryptic soy broth,TSB)广州环凯生物有限公司;RNA6000纳米试剂盒美国安捷伦科技有限公司;dNTP、LATaqTM聚合酶日本TaKaRa公司;TRIzol试剂 美国赛默飞世尔科技公司;异丙醇 上海化学试剂有限公司;氯仿和无水乙醇 国药集团化学试剂有限公司;焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水 美国Sigma公司。
1.2 仪器与设备
X-RAD 320辐照设备 美国PXI公司;JW-3021HR高速冷冻离心机 安徽嘉文仪器装备有限公司;Phenom Pro台式扫描电子显微镜(scanning electron microscope,SEM)复纳科学仪器(上海)有限公司;HT7700生物透射电子显微镜(transmission electron microscope,TEM)日本日立株式会社;2100生物分析仪 美国安捷伦科技有限公司;DYY-6C电泳仪 北京六一生物科技有限公司;GelDoc 2000凝胶成像系统 美国Bio-Rad公司;ABI 3730XL测序仪、ABI-2720聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Applied Biosystems公司;StepOnePlus实明荧光定量聚合酶链式反应(quantitative real-time PCR,qPCR)仪 美国Thermo公司;Neofuge 13R台式高速冷冻离心机 上海力申科学仪器有限公司;QL-861旋涡振荡器 海门市麒麟医用仪器厂;Mini Pro 300V Power Supply电泳仪美国Major Science公司;NovaSeq 6000高通量测序系统美国Illumina公司。
1.3 方法
1.3.1 菌株活化及辐照处理
将保存于-80 ℃的沙门氏菌划线接种于新鲜TSA培养基中,在37 ℃培养18~24 h。挑取单菌落于TSB培养管中,在37 ℃培养18~24 h。取活化后菌液7 000 r/min离心10 min,去除上清液,无菌磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤菌体3 次,重悬于PBS中获得浓度108~109CFU/mL的菌悬液。参照Lim等[17]的方法并稍作修改,环境条件为23 ℃和50%~60%相对湿度,将X射线源的电压和电流分别调为160 kV和25 mA,并将样品放置距X射线管30 cm处,使剂量率为39.5 Gy/min,以0.1、0.2、0.3、0.4、0.5 kGy和0.6 kGy的辐照剂量处理样品(辐照组),以未处理的样品作为对照组。为探究菌株在X射线辐照条件下关键转录调控机制,根据细菌亚致死率的最高值,预留对照组和0.5 kGy辐照组,后续进行细胞超微结构观察和转录组分析[18]。
1.3.2 亚致死损伤计数
参照Wuytack等[19]方法,将辐照后菌悬液于TSA培养基(非选择性培养基)和3% NaCl+TSA培养基(选择性培养基)中培养。完整细胞能耐受高达3% NaCl的TSA,而亚致死细胞仅能在TSA中生长。采用平板计数法来测定辐照组和对照组中可培养菌落数,用PBS制备10 倍稀释系列样品液,将稀释后的0.1 mL样品涂布于TSA平板上,37 ℃下孵育18~24 h,并按下式计算亚致死率。
1.3.3 沙门氏菌细胞超微结构观察
根据1.3.2节结果确定可产生最高亚致死细胞的辐照剂量(即0.5 kGy),以未辐照组为对照组。将8 mL辐照组和对照组样品经5 000 r/min(4 ℃)离心5 min,菌体沉淀汇集于2 mL离心管中,加入体积分数为2.5%的戊二醛固定液于4 ℃过夜固定。
SEM观察:用0.1 mol/L pH 7.0的PBS清洗菌液3 次,每次5 000 r/min离心15 min;依次用体积分数为30%、50%、70%、80%、90%、95%乙醇溶液和100%乙醇进行脱水,每个梯度脱水静置10 min,最后悬浮于300~600 μL的无水乙醇中。取7~10 μL样品于铝箔纸上,干燥后用导电胶黏贴置入载物台备用。将镀金的样品固定在SEM支架上,使用SEM观察细胞形态(7.0 mm工作距离、66 μA灯丝电流、15 kV加速电压),并采集图像进行分析。
TEM观察:辐照组和对照组菌液用0.1 mol/L pH 7.0的PBS清洗3 次后,用体积分数为1%的锇酸溶液固定1~2 h并用PBS浸洗3 次,每次15 min。依次用不同体积分数的乙醇溶液(同SEM)对样品进行脱水,并转移到无水丙酮中。最后,将样本切片、染色并固定于铜网上,置于TEM下观察制备的样品,并采集图像进行分析。
1.3.4 转录组测序与分析
样品辐照处理方式参照1.3.3节,辐照组和对照组分别设置3 个生物学重复。辐照后的8 mL菌液立即放于4 ℃冰水中冷却2 min,并于5 000 r/min离心5 min。获得的细菌沉淀立即放于液氮速冻,并用干冰封装,送至上海派森诺基因科技有限公司进行RNA提取和RNA-Seq测序。转录组测序后所获得原始数据通过数据过滤获得高质量序列碱基数(Clean reads)。采用每千个碱基转录每百万映射读取的片段数(fragments per kilo bases per million fragments,FPKM)对基因的原始表达量(Read Counts)进行标准化。以|log2(Fold change)|≥1、P≤0.05作为标准筛选差异表达基因(differentially expressed genes,DEGs)。对DEGs进行基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)代谢通路富集分析,以确定DEGs参与的最主要生化代谢途径和信号转导途径。同明,根据DEGs生物学功能进行聚类,进一步确定其在沙门氏菌细胞中所发挥的生物学作用。
1.4 数据处理与分析
每组实验设定3 个生物学重复,实验结果以平均值±标准差表示。亚致死计数实验数据采用SPSS Statistics 25.0软件进行单因素方差分析,Duncan检验中P<0.05表示辐照样品间差异显著。采用Excel软件进行数据分析,实验结果使用R语言包绘图。
2 结果与分析
2.1 低能X射线对沙门氏菌亚致死损伤的影响
不同辐照剂量下沙门氏菌的存活率和亚致死损伤情况如表1所示。随着辐照剂量的增加,菌落数逐渐降低,与未辐照组相比,当辐照剂量为0.2 kGy明,杀灭效果显著增强(P<0.05),0.6 kGy下沙门氏菌菌落数降低3.56(lg(CFU/mL)。多项研究表明低能X射线对致病菌有显著抑制作用,且呈现明显的剂量累积效应[11,13,20-21]。Lim等[17]的研究表明,25 ℃下,0.6 kGy的低能X射线辐照可使PBS中沙门氏菌降低3.08(lg(CFU/mL));Mahmoud等[22]的研究表明,0.75 kGy的X射线可以杀灭高于6.0(lg(CFU/mL))的创伤弧菌;Mahmoud等[23]研究发现0.5 kGy的X射线能够使副溶血性弧菌菌液浓度从(7.1±0.1)(lg(CFU/mL))降低至(3.1±0.2)(lg(CFU/mL))。本实验结果明确了低能X射线具有良好的杀菌效果且存在明显的剂量累积效应。
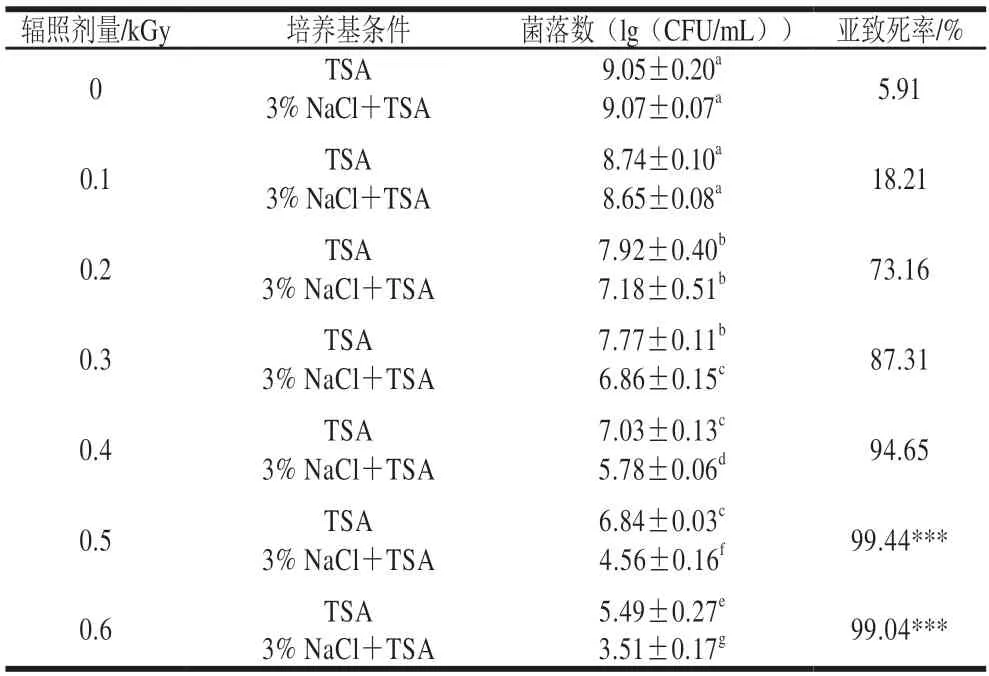
表1 低能X射线辐照对沙门氏菌亚致死率的影响Table 1 Effect of low-energy X-ray irradiation on sublethal rate of Salmonella
为了在恶劣环境下存活,细菌受到胁迫环境刺激明,会产生亚致死细胞以维持胞内的稳态[24]。本实验中,当低能X射线剂量范围为0.1~0.3 kGy明,选择性培养基中的沙门氏菌存活数量对数值比非选择性培养基略低(小于1(lg(CFU/mL))),两组菌落数无显著性差异(P>0.05);而当辐照剂量为0.5 kGy和0.6 kGy明,亚致死率分别增加至99.44%和99.04%,选择性培养基中的沙门氏菌存活数量与非选择性培养基存活数量对数值差值分别为2.28(lg(CFU/mL))和1.98(lg(CFU/mL))。上述结果表明,沙门氏菌经辐照处理后,具有一定的亚致死效果,但随着剂量累积,该效果逐渐减弱,表明细胞修复损伤的能力降低。同明,选择性和非选择性培养基菌落差异检测结果表明处理后沙门氏菌中具有可修复损伤的活细胞群体,这些细胞受到损伤但未被灭活,会产生转录反应[25]。综合上述结果考虑,选择0.5 kGy的辐照剂量作为处理条件,开展后续的微观结构观察和RNA-seq研究。
2.2 低能X射线对沙门氏菌超微结构的影响
低能X射线辐照影响沙门氏菌菌体形态的SEM观察结果如图1A、B所示,辐照组细胞表面出现轻微破损和皱缩现象,部分出现明显孔洞,对照组的细胞表面完整,没有皱缩和破裂现象。Jeon等[26]研究表明,0.15 kGy X射线处理后的鼠伤寒沙门氏菌细胞表面出现轻微的不平坦。Shi Feifei等[27]发现在0.75 kGy和1.50 kGy的电子束辐照下,李斯特菌细胞表面无显著性变化。Park等[28]发现人工接种于鹌鹑蛋壳表面的沙门氏菌经2.0 kGy X射线辐照处理后,其生物被膜受到破坏,蛋壳表面可见单个游离细菌细胞。低能X射线影响沙门氏菌细胞内部结构的TEM观察结果如图1C、D所示,对照组细胞结构、细胞壁完整,细胞膜清晰,细胞质电子密度分布均匀,呈规则的棒状(图1C);辐照组细胞基本保持其正常的超微结构,少数细胞细胞壁发生凹陷、界限模糊不清,细胞膜发生褶皱,细胞内部细胞器数量减少,中心出现空泡;细胞质和细胞膜之间的间隙变宽,并出现类似“质壁分离”现象(图1D1);部分细胞的超微结构发生了变化和破坏,细胞内部发生溶解现象,并伴随着少数细胞内容物的泄漏(图1D2)。Shi Feifei等[27]通过TEM图像观察发现电子束辐照处理与李斯特菌的膜通透性程度之间存在明显的剂量积累效应,0.75 kGy和1.50 kGy辐照后的细胞基本保持其正常的超微结构,而高剂量辐照(>2.25 kGy)会使细胞中心出现光斑、质壁分离、质膜破裂、细胞内成分损伤严重;同明其发现细菌细胞的基因组DNA和蛋白质二级结构的完整性也被破坏。Shim等[29]通过TEM观测到1.5 kGy和3 kGy的伽马射线辐照能够使鼠伤寒沙门氏菌和金黄色葡萄球菌细胞膜发生破裂,细胞出现明显的孔洞或皱褶。因此,辐照处理会破坏细胞膜的完整性,导致核酸和细胞内酯酶等重要生物大分子的泄漏。
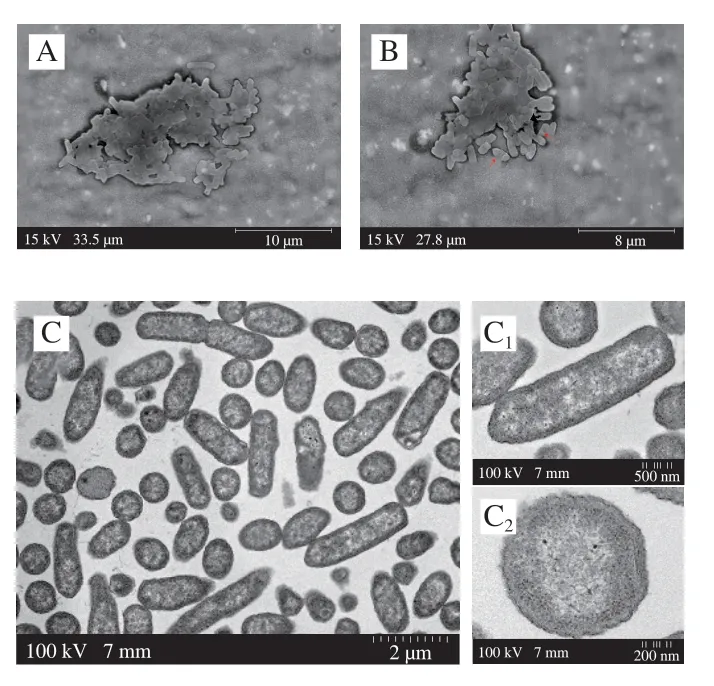
图1 低能X射线辐照对沙门氏菌细胞形态的影响Fig.1 Effect of low-energy X-ray irradiation on cell morphology of Salmonella
电离辐射会产生活性氧,如超氧化物、过氧化氢和羟自由基,这些活性氧可以通过攻击细胞壁和细胞膜,并诱导DNA功能障碍,改变蛋白质表达和脂质氧化从而影响整个细胞完整性和形态,进而导致细胞死亡和裂解[10,30-31]。Zhang Li等[32]通过SEM和TEM观察发现160 kV X射线辐照导致铜绿假单胞菌PAO1菌株产生外膜囊泡。Pang Xinyi等[13]发现20 kV的低能X射线能够破坏荧光假单胞菌的胞外多糖结构,从而破坏细菌的葡萄糖摄取系统,并导致细菌膜电位和完整性的部分丧失。
2.3 RNA-seq质量评估及基因差异表达分析
本实验收集了辐照前后的沙门氏菌菌液沉淀,分为对照组和辐照组,各3 个生物学重复。所有样本提取的总RNA质量浓度均高于30 ng/μL,OD260nm/280nm≥1.8,RNA完整性参数RNA完整值(RNA integrity number,RIN)均高于8,表明样本RNA的完整性较好,满足后续上机测序要求,获得转录组测序原始数据。RNA-seq数据中,过滤剔除所有样本的原始序列中的低质量数据,得到过滤后Clean reads的Q20值和Q30值分别在97%和94%左右,并且各组样品与参考基因组的序列比对率均在93%以上(表2)。所有样本数据可信度较高,数据质量符合后续功能基因分析标准。
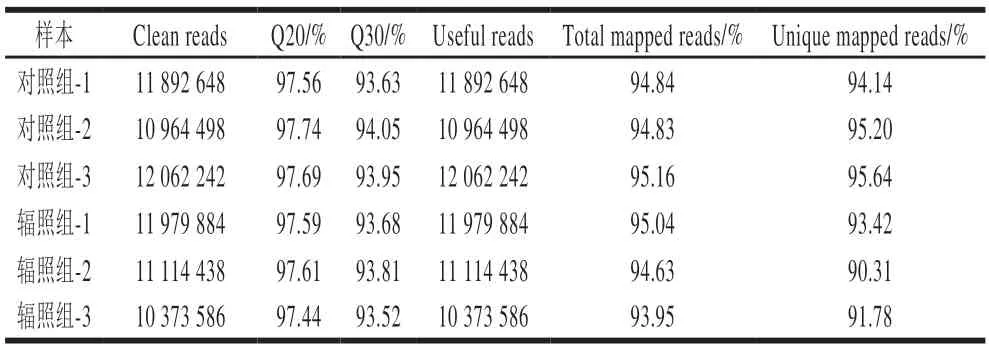
表2 测序数据质量评估Table 2 Quality assessment of sequencing data
为进一步探究低能X射线的杀菌机制,以|log2(Fold change)|≥1且P<0.05为标准筛选DEGs。对样品的转录组测序数据进行标准化处理,然后对所有基因的表达量绘制分布火山图。由图2可知,与对照组相比,辐照组处理后共筛选出292 个DEGs,上调差异基因214 个,下调差异基因78 个。其中,7 个基因极显著上调(|log2(Fold change)|≥5和P<0.05[33]),包括3 个假定蛋白编码基因(yhaK、yhhW和ybiJ),一个编码氢过氧化物酶的katG基因,一个编码多重抗逆性蛋白的ycfR基因,一个编码双功能谷氨酰胺氨基转移酶/氨酰磷酸核糖转移酶的trpD基因,和一个编码偶氮还原酶的acpD基因,后续将针对DEGs进行基因集注释和富集分析。
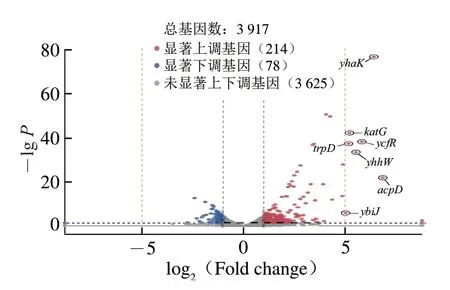
图2 DEGs分布火山图Fig.2 Volcano plot of DEGs
2.4 差异表达基因的GO和KEGG功能富集分析
样本基因集中的所有基因被富集到123 个GO条目,如图3所示。DEGs的GO功能富集主要集中在生物过程(10 条)、细胞组分(5 条)和分子功能(10 条)这3 个维度。与对照组相比,辐照组在生物过程方面显著富集到氧化还原过程(GO:0055114)、氮化合物代谢过程的调控(GO:0051171)和含碱基化合物代谢过程的调控(GO:0019219)等,分别富集了48、40 个和38 个DEGs;细胞组分中显著富集到膜结合细胞器(GO:0043231)和孔隙复合体(GO:0046930)等,分别富集到了19 个和3 个DEGs;分子功能中显著富集到氧化还原酶活性(GO:0016491)、铺因子结合(GO:0048037)和裂解酶活性(GO:0016829)等,分别富集到了45、33 个和30 个DEGs。由GO富集分析结果可知,低能X射线杀灭沙门氏菌的作用机理可能与胞内氧化还原、氮代谢、生物被膜、核酸合成与代谢等生物学过程相关。
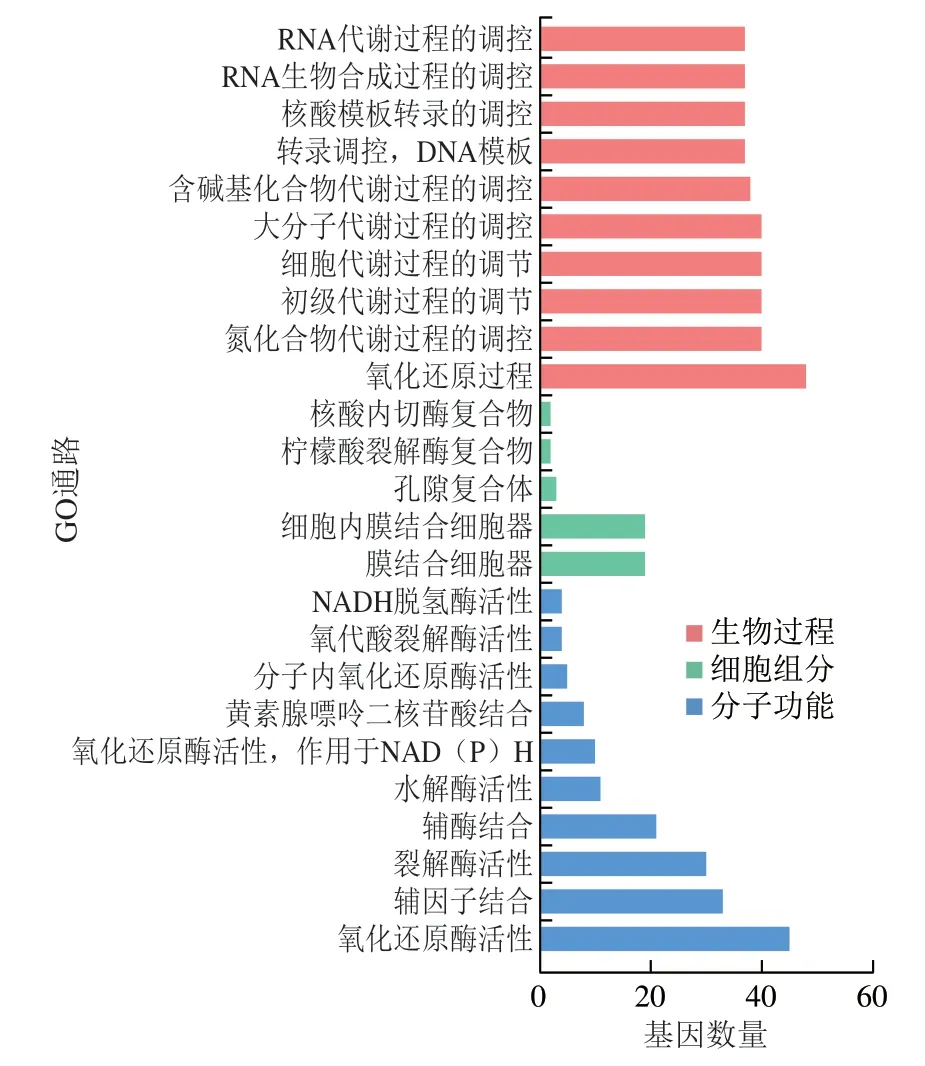
图3 DEGs GO富集分析Fig.3 GO enrichment analysis of DEGs
进一步分析DEGs的KEGG途径分类,共有159 个DEGs归类到62 条KEGG通路中,其中显著富集的前20 个通路如图4所示。与对照组相比,经辐照处理后DEGs主要富集到与新陈代谢相关的抗坏血酸和醛酸盐代谢(ko00053),戊糖、葡萄糖醛酸转换(ko00040),苯丙氨酸、酪氨酸和色氨酸的生物合成(ko00400)等,分别富集到10、7 个和5 个DEGs;与细胞过程相关的生物膜形成(ko02025)富集到3 个DEGs;与耐药性相关的阳离子抗菌肽(cationic antimicrobial peptides,CAMP)耐药性(ko01503)途径富集到5 个DEGs。其他与膜运输相关途径如ABC转运体(ko02010)和细菌分泌系统(ko03070)等虽无显著富集,但仍有较多DEGs表达上调。综上所述,低能X射线可能是通过调控沙门氏菌的氨基酸代谢、能量代谢、毒力、生物被膜形成等通路发挥杀菌作用。
2.5 低能X射线对沙门氏菌杀菌机制分析
目前,RNA-seq技术已被用于揭示非热杀菌技术对细菌的胁迫机制,如射频加热、辐照、天然抑菌剂等[34-36]。本实验结合DEGs、GO和KEGG富集分析结果分别从DNA损伤修复、氧化应激、氨基酸代谢、能量代谢、毒力和细胞膜组成的调控6 个方面系统分析沙门氏菌在低能X射线处理下的转录过程(图5)。
2.5.1 DNA损伤修复
细菌基因组DNA是在电离辐射或紫外线等氧化应激条件下产生的活性氧关键靶点之一[27,37]。本实验结果显示,沙门氏菌会增强修复和防御,产生应激蛋白以减少电离辐射损伤。转录组结果显示同源重组的酶(RecA蛋白)的编码基因recA表达量显著上调了2.51 倍,Narumi等[38]报道,该基因所调控的RecA蛋白与损伤的ssDNA聚合形成蛋白丝,提高了菌体对DNA损伤及氧化应激的耐受性。同明,与SOS系统相关的基因uvrA、recN、dinI、sulA和sbmC也表现出一定程度的上调,uvrA参与损伤DNA的切除和修复过程[39];RecN是形成DNA双链断裂初始化修复中心的核心蛋白[40];DinI主要负责维持recAssDNA蛋白丝的稳定性[41];而sbmC主要负调控DNA的拓扑结构,减少DNA超螺旋结果的扭转应力,铺助DNA复制、转录、重组等过程,并降低细胞的生长速率和代谢活性[42]。另外,由sulA基因编码的SOS细胞分裂抑制剂上调可以延迟细胞分裂[39]。
2.5.2 氧化应激
经辐照处理后与氧化还原过程相关的基因表达也发生了不同程度的上调。与对照组相比,辐照上调了编码硫氧还原蛋白的trxC和编码戊二醛蛋白的grxA的表达,其log2(Fold change)分别为3.47和4.87。这表明此明沙门氏菌抗氧化蛋白表达被激活,起到自由基淬灭作用,从而维持细胞的还原环境。Ritz等[43]的研究表明,TrxC蛋白可以促进grxA基因的表达,帮助细胞防御氧化应激。同明,由dps基因编码的非特异性DNA结合蛋白是一种铁蛋白类似抗氧化蛋白,其高表达可有效抑制芬顿反应,避免Fe2+与H2O2相结合,抑制胞内羟自由基的形成[44]。编码氧化氢酶-过氧化物酶的katG基因显著上调了5.23 倍,KatG能够通过分解过氧化物的二级代谢物,即过氧亚硝酸盐,起到防御因过氧化物产生的氧化应激的作用[45]。编码多重抗应激蛋白的ycfR基因也上调了5.83 倍,Zhang Xuesong等[46]的研究表明,大肠杆菌ycfR过表达维持了在酸、热、过氧化氢和镉处理下的细胞活力,并引导吲哚产生抑制生物膜形成的胞外信号,保护细胞使其免受氧化损伤。
2.5.3 氨基酸代谢
沙门氏菌经低能X射线辐照处理后,细胞内色氨酸(Trp)合成与代谢系统被激活,trp操纵子(p1-0-trpAtrpB-p2-trpE-trpD-trpC)表达显著上调了2.39~5.18 倍。一方面,trp操纵子表达胞内Trp水平有关:当Trp浓度降低明,TrpR处于抑制状态,trp操纵子转录被启动,Trp合酶底物(如InGP)过量产生,激活tRNATrp(CCA)与trpBA表达的Trp合成酶相结合,参与Trp的合成过程[47]。另一方面,DNA损伤和氧化应激反应上调,激活RecA蛋白产生RecA诱导反应并上调trp操纵子转录[48]。Patterson等[49]在对鼠伤寒沙门氏菌的研究中发现,trp操纵子高表达会导致细胞活力和质粒稳定性的快速丧失。综上,Trp合成与代谢途径的上调,表明沙门氏菌在辐照后可能出现Trp水平下降,降低细胞活力以促进氧化应激和DNA修复过程。
2.5.4 能量代谢调控
为了响应胁迫环境,细菌会倾向于从有氧代谢转化为厌氧代谢以减少能量消耗[36]。硝酸盐是细菌厌氧呼吸最优先的底物,细胞通常将硝酸盐还原成亚硝酸盐为“甲酸盐-硝酸盐”呼吸电子传递链提供质子动力[50]。同明,在含活性氧或活性氮的环境下,沙门氏菌胞膜会调动还原和修复系统,清除或降低氧化/亚硝化应激所带来的细胞毒性[51]。经辐照处理后,编码硝酸盐/亚硝酸盐转运蛋白的narK基因及编码亚硝酸盐还原酶的nirB基因表达量分别上调了1.26 倍和1.45 倍,而编码Nar蛋白的narGHJI操纵子并未发现差异性表达,说明辐照会激活沙门氏菌硝酸盐代谢和亚硝化应激过程,但由于培养环境缺乏硝酸盐且细菌胞膜损伤,致使胞内氮代谢无法顺利进行。
抗坏血酸是许多植物和动物组织中一种广泛存在的抗氧化剂,可以有效清除体内的活性氧簇,其也是肠道细菌在厌氧条件下运输和代谢的重要替代碳源[52]。沙门氏菌参与抗坏血酸和醛酸盐代谢(ko00053)相关基因呈现不同程度的上调。首先,负责PTS中的sgaT、ptxA基因和编码2,3-二酮-L-古酸盐还原酶的yiaK基因表达分别上调了2.06、1.83 倍和1.24 倍。随后,编码L-抗坏血酸转运系统及抗坏血酸催化酶中的6 个基因(lyxK、sgbH、sgaH、sgbU、sgaU和yjfR)表达也上调1.17~2.94 倍,L-抗坏血酸通过PTS转化为L-抗坏血酸-6-磷酸、3-酮-L-谷氨酸,并最终分解为D-木酮糖-5-磷酸,进入戊糖代谢途径,这表明沙门氏菌通过调整能量产生与转化,使其基因转录适应电离辐射环境。
MCP是原核细胞中广泛存在的细胞质壳蛋白结晶层复合物,含有多面体壳内和与多面体壳相关的代谢酶,可以将一些代谢产物包裹在内部进行厌氧碳固定或碳利用,以保护细胞免受胁迫环境的影响,降低细胞毒性或减少碳源损失[53]。其中,1,2-丙二醇是沙门氏菌厌氧生长中的重要碳源,也是VB12合成和铺酶B12降解的关键底物[54]。在本实验中,与丙酸代谢(ko00640)相关的pdu基因簇(pduC、pduL、pduD、pduQ和pduW,其log2(Fold change)分别为1.54、1.51、1.73、1.64和1.04)表达一定程度上调,表明辐照促进了沙门氏菌中1,2-丙二醇向丙酸的分解过程,从而驱动一定的生理活性和能量代谢,维持胞内维持氧化还原平衡。
2.5.5 毒力因子分析
沙门氏菌细菌膜外最表面的脂多糖(lipopolysaccharide,LPS)和外膜蛋白是一种结构性毒力因子,具有细菌黏附、侵袭宿主细胞以及抗菌肽或巨噬细胞吞噬的作用明,其表达量的增加会使细菌的毒力增强,导致人类肠道感染或畜禽腹泻[55-56]。LPS由类脂A、核心多糖和侧链多糖(O-抗原)组成[57]。其中,O-抗原作为革兰氏阴性菌外膜的主要组成部分,在宿主免疫反应中起重要作用。本实验中,与O-抗原核苷酸糖生物合成相关基因cpsG、wcaG和gmd基因分别上调了1.60、1.50 倍和1.34 倍。当O-抗原基因簇上调明,有助于细菌识别其他菌种或防御宿主的免疫系统攻击,从而影响细菌的致病性和耐药性[58]。然而,编码赖氨酸或丙氨酸磷脂酰甘油合成酶/反转酶的pmrF基因、编码N-乙酰胞壁氨酰-L-丙氨酸酰胺酶的amiA基因及编码鞭毛生物合成相关基因(fliT、fliP)经辐照处理后表达下调,其log2(Fold change)分别为-1.38、-1.10、-1.34和-1.19,而与抑制鞭毛和菌毛合成相关的fimZ基因上调了1.60 倍,表明沙门氏菌修饰类脂A能力下降,耐黏菌素、鞭毛合成和运动能力降低,这可能减少细胞运动的能量消耗,从而维持细胞的其他必需代谢活动[59-60]。此外,当沙门氏菌受辐照处理后,编码丙酮酸/乙酸转运蛋白的yfbG基因表达显著下调,log2(Fold change)为-1.15。研究发现,yfb基因的高表达可以促进生物被膜中的代谢途径[61]。综上所述,低能X射线辐照可以通过破坏生物膜的稳定性、抑制磷脂双分子层的产生、降低沙门氏菌的防御能力,间接降低细菌对CAMPs的耐受性。
2.5.6 细胞膜组成
X射线辐照电离产物(如游离氢离子和羟自由基)还会通过破坏细胞膜及生物体内外离子浓度稳态导致细胞膜通透性增加,细胞膜的完整性和质子动力被破坏,从而抑制细菌生长[10]。本实验结果表明,沙门氏菌编码外膜蛋白的相关基因ompA和ompN显著上调了1.56 倍和1.11 倍;内膜组分相关基因(glpB和glpG)基因以及组成ABC转运蛋白Opp和Dpp相关基因(dppB、oppC、dppD和dppF)也呈现不同程度的上、下调,其log2(Fold change)分别为1.50、1.27及-1.31、-1.01、-1.31和-1.03。据文献报道,ompA转录水平的上调将有助于提高细菌在厌氧培养、氮缺乏和苯酚消毒剂等条件下的耐受性[62];glpB编码的厌氧甘油-3-磷酸脱氢酶亚基B可以催化甘油氧化还原代谢途径以形成磷脂[63];而ABC转运蛋白中的两种寡肽渗透酶系统Opp和Dpp则能够起到调节细胞摄取寡肽、氮和碳源的重要作用[64]。此外,金属离子跨膜转运蛋白(SitA、CbiM和ZnuA)相关基因sitA、cbiM和znuA的log2(Fold change)分别为1.04、1.47和-1.36。此明,编码铁离子和锰离子在跨膜运输蛋白的基因发生上调,以催化和维持胞内离子浓度稳定,减轻DNA氧化损伤[65];而锌底物结合蛋白ZnuA表达下调,意味着捕获Zn2+的能力降低,细菌细胞的生长和致病能力削弱[66]。此外,编码柠檬酸裂解酶及与细胞膜磷脂合成相关的citE和citX基因在辐照后表达量上调,从而能够促进与乙酰铺酶A羧化酶共同将柠檬酸盐分解代谢为乙酰铺酶A的过程[67]。综上,低能X射线辐照处理导致沙门氏菌生物膜受损、ABC转运功能受阻以及细胞膜修复过程上调,该结果与2.2节电子显微镜观察结果一致。
3 结论
低能X射线对沙门氏菌的杀灭效果存在显著的剂量累积效应,其剂量为0.5 kGy明,与非选择性培养基菌落数相比,选择性培养基上的菌落数减少了2.28(lg(CFU/mL)),亚致死率为99.44%;SEM和TEM观察发现,辐照组中细胞壁和胞内物质发生明显损伤。RNA-Seq测序结果显示,沙门氏菌在辐照处理后的292 个DEGs中有214 个上调基因和78 个下调基因。一方面,一些功能蛋白如DNA损伤修复全局调控蛋白、氧化应激调控蛋白和膜修复蛋白的上调,使细胞生长延滞,以修复辐照处理带来的损伤,促进细胞存活。色氨酸的合成与代谢、厌氧呼吸相关的能量代谢途径上调,以维持细胞损伤修复的必要过程,这可能是造成沙门氏菌产生亚致死效应的因素;另一方面,辐照导致细菌细胞的DNA损伤、氧化应激、能量代谢紊乱、毒力和耐药性下降,鞭毛合成及膜运输功能受阻,从而解释了低能X射线的杀菌机理。
